Журнал "Гастроэнтерология" Том 54, №2, 2020
Вернуться к номеру
Влияние базисной терапии на состав кишечной микробиоты у пациентов с неспецифическим язвенным колитом
Авторы: Дорофеев А.Э.(1), Ткач С.М.(2), Дорофеева А.А.(3), Мосейко В.В.(3), Деркач И.А.(4), Кирьян Е.А.(5)
(1) — Национальная медицинская академия последипломного образования имени П.Л. Шупика,
г. Киев, Украина
(2) — Украинский научно-практический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев, Украина
(3) — Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины, г. Киев, Украина
(4) — Трускавецкая городская больница, г. Трускавец, Украина
(5) — Украинская медицинская стоматологическая академия, г. Киев, Украина
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Метою даної роботи була порівняльна оцінка впливу терапії месалазином і системними глюкокортикостероїдами (ГКС) на зміни кишкового мікробіому у хворих на неспецифічний виразковий коліт (НВК). Матеріали та методи. Під нашим наглядом перебувало 238 пацієнтів із лівобічним НВК віком від 19 до 64 років. За активністю запального процесу в товстому кишечнику пацієнти були розподілені на хворих з мінімальною активністю НВК — 112 (47,0 %), помірною активністю — 78 (32,8 %) і високою активністю — 48 (20,2 %) пацієнтів. Для оцінки змін кишкового мікробіому на тлі базисної терапії була обрана група пацієнтів із лівобічним НВК помірної активності. 32 (41,0 %) пацієнти цієї групи як базисну терапію для індукції ремісії отримували месалазин (Пентасу) у дозі 4,0 г на добу, препарат хворі приймали 3,0 г per os і 1,0 г per rectum. 27 (34,6 %) хворих із лівобічним НВК помірної активності як індукційну базисну терапію приймали ГКС у дозі 30–40 мг у перерахунку на преднізолон. 19 (24,4 %) пацієнтів цієї групи отримували комбіновану терапію месалазином і стероїдами і в дослідження не включалися. Були вивчені рівні Firmicutes, Actinobacteria, Bacteroidetes і Faecalibacterium prausnitzii до і після лікування. Результати. Клінічна ефективність месалазину (Пентаси) у дозі 4,0 г на добу порівнянна з ефективністю застосування системних глюкокортикостероїдів 30–40 мг на добу, але месалазин є більш безпечним. Застосування Пентаси справляє позитивний коригуючий вплив на кишковий мікробіом у хворих на НВК з нормалізацією Bacteroidetes і збільшенням кількості Firmicutes і Faecalibacterium prausnitzii. У хворих на НВК, які приймали системні ГКС, відзначається збільшення кількості Actinobacteria при зниженні Faecalibacterium prausnitzii.
Целью данной работы была сравнительная оценка влияния терапии месалазином и системными глюкокортикостероидами (ГКС) на изменения кишечного микробиома у больных неспецифическим язвенным колитом (НЯК). Материалы и методы. Под нашим наблюдением находилось 238 пациентов с левосторонним НЯК в возрасте от 19 до 64 лет. По активности воспалительного процесса в толстом кишечнике пациенты были распределены на больных с минимальной активностью НЯК — 112 (47,0 %), умеренной активностью — 78 (32,8 %) и высокой активностью — 48 (20,2 %) пациентов. Для оценки изменений кишечного микробиома на фоне базисной терапии была выбрана группа пациентов с левосторонним НЯК умеренной активности. 32 (41,0 %) пациента этой группы в качестве базисной терапии для индукции ремиссии получали месалазин (Пентасу) в дозировке 4,0 г в сутки, препарат больные принимали 3,0 г per os и 1,0 г per rectum. 27 (34,6 %) больных с левосторонним НЯК умеренной активности в качестве индукционной базисной терапии принимали ГКС в дозировке 30–40 мг в пересчете на преднизолон. 19 (24,4 %) пациентов этой группы получали комбинированную терапию месалазином и стероидами и в исследование не включались. Были изучены уровни Firmicutes, Actinobacteria, Bacteroidetes и Faecalibacterium prausnitzii до и после лечения. Результаты. Клиническая эффективность месалазина (Пентасы) в дозе 4,0 г в сутки сопоставима с эффективностью применения системных глюкокортикостероидов 30–40 мг в сутки, но месалазин является более безопасным. Применение Пентасы оказывает позитивное корригирующее влияние на кишечный микробиом у больных НЯК с нормализацией Bacteroidetes и увеличением количества Firmicutes и Faecalibacterium prausnitzii. У больных НЯК, принимавших системные ГКС, отмечается увеличение количества Actinobacteria при снижении Faecalibacterium prausnitzii.
Background. The purpose of this work was a comparative assessment of the effect of therapy with mesalazine and systemic glucocorticosteroids on changes in the intestinal microbiome in patients with ulcerative colitis (UC). Materials and methods. Under our supervision, there were 238 patients with left-sided UC aged 19 to 64 years. According to the activity of the inflammatory process in the colon, all patients were divided into those with minimal activity of UC — 112 (47.0 %), moderate activity of UC — 78 (32.8 %) and high activity of UC — 48 (20.2 %). To assess changes in the intestinal microbiome on the background of basic therapy, a group of patients with moderate left-sided UC was selected. Thirty-two (41.0 %) patients of this group received mesalazine (Pentasa) at a dose of 4.0 g per day as the basic therapy for inducing remission: 3.0 g per os and 1.0 g per rectum. Twenty-seven (34.6 %) patients with moderate left-sided UC took glucocorticosteroids at a dose of 30–40 mg in terms of prednisolone as induction basic therapy. Nineteen (24.4 %) patients in this group received combination therapy with mesalazine and steroids and were not included in the study. The levels of Firmicutes, Actinobacteria, Bacteroidetes and Faecalibacterium prausnitzii were studied before and after treatment. Results. The clinical efficacy of mesalazine (Pentasa) at a dose of 4.0 g per day is comparable to the efficacy of systemic glucocorticosteroids 30–40 mg per day, but is safer. The use of Pentasa has a positive corrective effect on intestinal microbiome in patients with UC with normalization of Bacteroidetes and an increase in the number of Firmicutes and Faecalibacterium prausnitzii. An increase in Actinobacteria with a decrease in Faecalibacterium prausnitzii is noted in patients with UC taking systemic corticosteroids.
кишковий мікробіом; неспецифічний виразковий коліт; месалазин
кишечный микробиом; неспецифический язвенный колит; месалазин
intestinal microbiome; ulcerative colitis; mesalazine
Введение
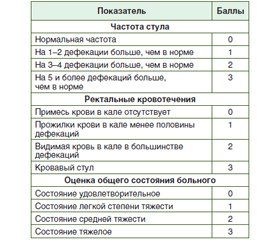
Материалы и методы
/77.jpg)
Результаты и обсуждение
Выводы
- Ткач С.М., Дорофєєв А.Е., Харченко Н.В., Захараш Ю.П., Степанов Ю.М., Звягінцева Т.Д., Скрипник І.М., Щвець О.В. Клінічні рекомендації Української гастроентерологічної асоціації по веденню хворих на неспецифічний виразковий коліт з перебігом легкої та середньої тяжкості. Рекомендації УГА. Затверджено 03.10.2019. Київ, 2019. 18 с.
- Дорофеева А.А. Оценка изменений кишечного микробиома при позднем дебюте неспецифического язвенного колита. ScienceRise: Biological Science. 2018. 4. 44-50.
- Burisch J., Munkholm P. The epidemiology of inflammatory bowel disease. Scand. J. Gastroenterol. 2015 Aug. 50 (8). 942-51.
- Bou-Fakhredin R., Halawi R., Roumi J., Taher A. Insights into the diagnosis and management of iron deficiency in inflammatory bowel disease. Expert Rev. Hematol. 2017 Sep. 10 (9). 801-808. doi: 10.1080/17474086.2017.1355233.
- Carstens А. The Gut Microbiota in Collagenous Colitis Shares Characteristics With Inflammatory Bowel Disease-Associated Dysbiosis. Clin. Transl. Gastroenterol. 2019 Jul. 10 (7). e00065. doi: 10.14309/ctg.0000000000000065.
- Gionchetti P., Rizzello F., Annese V., Armuzzi A., Biancone L., Castiglione F., Comberlato M., Cottone M., Danese S., Daperno M., D'Incà R., Fries W., Kohn A., Orlando A., Papi C., Vecchi M., Ardizzone S. Use of corticosteroids and immunosuppressive drugs in inflammatory bowel disease: Clinical practice guidelines of the Italian Group for the Study of Inflammatory Bowel Disease. Dig. Liver Dis. 2017 Jun. 49 (6). 604-617. doi: 10.1016/j.dld.2017.01.161.
- Heida A., Park K.T., van Rheenen P.F. Clinical Utility of Fecal Calprotectin Monitoring in Asymptomatic Patients with Inflammatory Bowel Disease: A Systematic Review and Practical Guide. Inflamm. Bowel. Dis. 2017 Jun. 23 (6). 894-902. doi: 10.1097/MIB.0000000000001082.
- Hisamatsu T., Wada Y., Kanai T. Inflammatory bowel disease and bone decreased bone mineral density. Clin. Calcium. 2015 Nov. 25 (11). 1639-44. doi: CliCa151116391644. Japanese.
- Khan I., Ullah N., Zha L., Bai Y. et al. Alteration of Gut Microbiota in Inflammatory Bowel Disease (IBD): Cause or Consequence? IBD Treatment Targeting the Gut Microbiome. Pathogens. 2019 Sep. 8 (3). 126. doi: 10.3390/pathogens8030126.
- Marteau P., Probert C.S., Lindgren S. et al. Combined oral and enema treatment with Pentasa (mesalazine) is superior to oral therapy alone in patients with extensive mild/moderate active ulcerative colitis: a randomised, double blind, placebo controlled study. Gut. 2005. 54 (7). 960-965.
- Quevrain E., Maubert M.A., Michon C. et al. Identification of an anti-inflammatory protein from Faecalibacterium prausnitzii, a commensal bacterium deficient in Crohn's disease. Gut. 2016. 65. 415-25.
- Sokol H., Pigneur B., Watterlot L. et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc. Natl. Acad. Sci USA. 2008. 105. 16731-6.
- Thomas L.V., Suzuki K., Zhao J. Probiotics: a proactive approach to health. A symposium report. Br. J. Nutr. 2015 Dec. 114. Suppl. 1. S1-15. doi: 10.1017/S0007114515004043.
- Tong J., Zheng Q., Zhang C. et al. Incidence, prevalence, and temporal trends of microscopic colitis: A systematic review and meta-analysis. Am. J. Gastroenterol. 2015. 110. 265-76.

/78.jpg)