Международный эндокринологический журнал Том 16, №3, 2020
Вернуться к номеру
Рівень 25(ОН)D, 10-річна ймовірність основних остеопоротичних переломів, мінеральна щільність та якість кісткової тканини, жирова та знежирена маса в жінок у період пре- та постменопаузи
Авторы: Поворознюк В.В., Іваник O.C.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», Український науково-медичний центр проблем остеопорозу НАМН України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
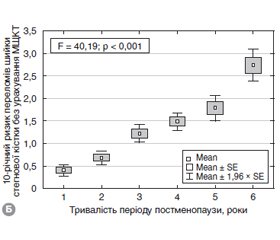
Актуальність. Постменопаузальний остеопороз викликає особливе занепокоєння, оскільки призводить до підвищеного ризику переломів з подальшим негативним впливом на здоров’я жінок літнього віку. Діагноз остеопорозу може бути встановлений за наявності низькоенергетичних переломів, що виникають без суттєвої травми, або на підставі низької мінеральної щільності кісткової тканини, визначеної методом двохенергетичної рентгенівської денситометрії. Мета дослідження: вивчити рівень 25(ОН)D, 10-річний ризик основних остеопоротичних переломів, мінеральну щільність та якість кісткової тканини, жирову та знежирену масу та визначити зв’язок між ними в жінок у період пре- та постменопаузи. Матеріали та методи. Обстежені 302 жінки віком 45–80 років (середній вік — 61,3 ± 7,7 року), які в подальшому відповідно до тривалості періоду пре- та постменопаузи були розподілені на 6 підгруп: І — пременопаузні жінки (n = 36; середній вік — 50,1 ± 3,4 року); II–VI — постменопаузні жінки (n = 266; середній вік — 62,8 ± 6,8 року). Всім обстеженим виконували дослідження мінеральної щільності кісткової тканини (МЩКТ) методом двофотонної рентгенівської денситометрії (ДРА) на двохенергетичному рентгенівському денситометрі Prodigy, GE Medical systems, model 8743, 2005, за стандартним протоколом. Оцінювали МЩКТ та Т-критерій поперекового відділу хребта, шийки стегнової кістки та всього скелета. Показник TBS поперекового відділу хребта визначали за допомогою методики TBS iNsight (Med-Imaps, Pessac, Франція). Рівень загального 25(ОН)D у сироватці крові визначали за допомогою електрохемілюмінесцентного методу на аналізаторі Еlecsus 2010 Roche Diagnostics (Німеччина), тест-системами Cobas. Десятирічну ймовірність основних остеопоротичних переломів і переломів стегнової кістки визначали з використанням української моделі FRAX без показників ДРА. Показники загальної жирової та знежиреної маси оцінювали з використанням ДРА. Результати. Виявлено вірогідний вплив тривалості періоду пре- та постменопаузи на варіабельність показників якості та щільності кісткової тканини (TBS (F = 6,85; p < 0,001), МЩКТ поперекового відділу хребта (F = 5,53; p < 0,001), МЩКТ шийки стегнової кістки (F = 10,25; p < 0,001), МЩКТ всього скелета (F = 12,28; p < 0,001)). Серед 266 обстежених жінок у періоді постменопаузи на рівні поперекового відділу хребта остеопороз виявлено в 90 (33,8 %) осіб, остеопенію — у 108 (40,6 %), норму — у 68 (25,6 %); на рівні шийки стегнової кістки остеопороз виявлено в 47 (17,7 %) осіб, остеопенію — в 187 (70,3 %), норму — в 32 (12,0 %). 10-річний ризик ймовірності основних остеопоротичних переломів порівняно з пременопаузою вірогідно збільшувався в наступні періоди постменопаузи: 5–9 років — 3,58 ± 1,97 та 6,72 ± 3,23, p < 0,0001; 10–14 років — 3,58 ± 1,97 та 6,90 ± 2,78, p < 0,0001; 15–19 років — 3,58 ± 1,97 та 7,19 ± 3,23, p < 0,0001; 20–24 роки — 3,58 ± 1,97 та 8,03 ± 2,45, p < 0,0001. Дефіцит вітаміну D виявлено в 39,7 % (n = 120), недостатність — в 30,4 % (n = 92), норму — в 29,9 % (n = 90). Нами не виявлено вірогідного впливу сезонності та місяця обстеження на показники 25(ОН)D (F = 0,51; p = 0,89). Рівень 25(OH)D мав негативну кореляцію з показниками маси, ІМТ і жирової маси та позитивну кореляцію з 10-річною ймовірністю основних остеопоротичних переломів. Висновки. Встановлено вірогідний негативний вплив тривалості пре- та постменопаузи на варіабельність показників якості та мінеральної щільності кісткової тканини та позитивний вплив на варіабельність показників 10-річної ймовірності основних остеопоротичних переломів і переломів стегнової кістки. У жінок у постменопаузі ожиріння вважається захисним фактором для втрати кісткової маси й розвитку остеопорозу. За результатами регресійного аналізу доведено вірогідний негативний зв’язок між масою тіла, індексом маси тіла, загальною жировою масою та рівнем 25(ОН)D у сироватці крові, що потребує адекватного підходу до терапії дефіциту вітаміну D в умовах ожиріння.
Актуальность. Постменопаузальный остеопороз приводит к повышенному риску переломов с последующим отрицательным влиянием на здоровье женщин пожилого возраста. Диагноз остеопороза может быть установлен на основе низкoэнергетических переломов, возникающих без существенной травмы или на основании низкой минеральной плотности костной ткани (МПКТ), измеренной методом двухэнергетической рентгеновской денситометрии. Цель исследования: изучить уровень 25(ОН)D, 10-летнюю вероятность основных остеопоротических переломов, минеральную плотность и качество костной ткани, жировую и обезжиренную массу и определить связь между ними у женщин в периоде пре- и постменопаузы. Материалы и методы. Обследованы 302 женщины в возрасте 45–80 лет (средний возраст — 61,3 ± 7,7 года), которые в дальнейшем согласно продолжительности периода пре- и постменопаузы были распределены на 6 подгрупп: I — пременопаузные женщины (n = 36; средний возраст — 50,1 ± 3,4 года); II–VI — постменопаузные женщины (n = 266; средний возраст — 62,8 ± 6,8 года). Всем обследованным проводилось исследование МПКТ методом двухфотонной рентгеновской денситометрии (ДРА) на двухэнергетическом рентгеновском денситометре Prodigy, GE Medical systems, model 8743, 2005, по стандартному протоколу. Оценивали МПКТ и Т-критерий поясничного отдела позвоночника, шейки бедренной кости и всего скелета. Показатель TBS поясничного отдела позвоночника определяли с помощью методики TBS iNsight (Med-Imaps, Pessac, Франция). Уровень общего 25(ОН)D в сыворотке крови определяли с помощью электрохемилюминесцентного метода на анализаторе Еlecsus 2010 Roche Diagnostics (Германия), тест-системами Cobas. 10-летнюю вероятность основных остеопоротических переломов и переломов бедренной кости определяли с использованием украинской модели FRAX без показателей ДРА. Показатели общей жировой и обезжиренной массы оценивали с использованием двухфотонной рентгеновской денситометрии (Prodigi, GE). Результаты. Установлено влияние длительности периода пре- и постменопаузы на вариабельность показателей качества и плотности костной ткани (TBS (F = 6,85; p < 0,001), МПКТ поясничного отдела позвоночника (F = 5,53; p < 0,001), МПКТ шейки бедренной кости (F = 10,25; p < 0,001), МПКТ всего скелета (F = 12,28; p < 0,001)). Среди 266 обследованных женщин в периоде постменопаузы на уровне поясничного отдела позвоночника остеопороз выявлен у 90 (33,8 %) лиц, остеопения — у 108 (40,6 %), норма — у 68 (25,6 %); на уровне шейки бедренной кости остеопороз выявлен у 47 (17,7 %) лиц; остеопения — у 187 (70,3 %), норма — у 32 (12,0 %). 10-летняя вероятность основных остеопоротических переломов по сравнению с пременопаузой достоверно увеличивалась в следующие периоды постменопаузы: 5–9 лет — 3,58 ± 1,97 и 6,72 ± 3,23, p < 0,0001; 10–14 лет — 3,58 ± 1,97 и 6,90 ± 2,78, p < 0,0001; 15–19 лет — 3,58 ± 1,97 и 7,19 ± 3,23, p < 0,0001; 20–24 года — 3,58 ± 1,97 и 8,03 ± 2,45, p < 0,0001. Дефицит витамина D выявлен у 39,7 % больных (n = 120), недостаточность — у 30,4 % (n = 92), норма — у 29,9 % (n = 90). Нами не выявлено вероятного влияния сезонности и месяца обследования на показатели 25(ОН)D (F = 0,51; p = 0,89). Уровень 25(OH)D имел отрицательную характеристику с показателями массы, ИМТ и жировой массы и положительную характеристику с 10-летней вероятностью основных остеопоротических переломов. Выводы. Полученные нами результаты свидетельствуют о вероятном негативном влиянии продолжительности пре- и постменопаузы на вариабельность показателей качества и минеральной плотности костной ткани и положительное влияние на вариабельность показателей 10-летней вероятности основных остеопоротических переломов и переломов бедренной кости. У женщин в постменопаузе ожирение является защитным фактором для потери костной массы и развития остеопороза. По результатам регрессионного анализа установлена вероятная отрицательная связь между массой тела, индексом массы тела, общей жировой массой и уровнем 25(ОН)D в сыворотке крови, что требует адекватного подхода к терапии дефицита витамина D при ожирении.
Background. Postmenopausal osteoporosis is an issue of great concern as it results in an elevated risk of fractures with a further negative impact on the elderly women’s health. The osteoporosis may be diagnosed based on the low-energy fractures occurring with no major trauma, or based on the low bone mineral density (BMD) measured by dual-energy X-ray absorptiometry (DXA). The purpose of study is to examine 25(ОН)D level, 10-year probability of major osteoporotic fractures, bone mineral density and quality, fat and lean mass and to analyze their associations in the pre- and postmenopausal women. Materials and methods. Three hundred and two women aged 45–80 years (mean age — 61.3 ± 7.7 years) were examined and divided into 6 groups according to the pre- and postmenopausal period duration: group I — premenopausal women (n = 36; mean age — 50.1 ± 3.4 years); groups II–VI — postmenopausal women (n = 266; mean age — 62.8 ± 6.8 years). All the examined patients were subjected to bone mineral density measurement by the DXA on Prodigy system (GE Medical Systems, model 8743, 2005) according to the standard protocol. BMD and T-score of the lumbar spine, femoral neck and total skeleton were evaluated. Trabecular bone score of lumbar spine was measured by TBS iNsight (Med-Imaps, Pessac, France). Total 25(ОН)D was assessed by electrochemoluminescent method using Еlecsys 2010 analyzer (Roche Diagnostics, Germany) and Cobas test systems. The 10-year probability of major osteoporotic fractures and hip fractures was calculated by the Ukrainian FRAX model without DXA results considered. Total body fat and lean mass was assayed by the dual-energy X-ray absorptiometry (Prodigy, GE). Results. We found a significant association between the pre- and postmenopausal period duration and bone density and quality variables (trabecular bone score (F = 6.85; p < 0.001), BMD of lumbar spine (F = 5.53; p < 0.001), BMD of femoral neck (F = 10.25; p < 0.001), BMD of total skeleton (F = 12.28; p < 0.001)). Among 266 postmenopausal women examined, 90 (33.8 %) had osteoporosis diagnosed at the lumbar spine, 108 (40.6 %) had osteopenia, 68 (25.6 %) — normal bones; 47 (17.7 %) people had osteoporosis diagnosed at the femoral neck, 187 (70.3 %) women had osteopenia, 32 (12.0 %) had normal bones. The 10-year probability of major osteoporotic fractures significantly increased compared with a premenopausal age during the following postmenopausal stages: 5–9 years — 3.58 ± 1.97 and 6.72 ± 3.23, p < 0.0001; 10–14 years — 3.58 ± 1.97 and 6.90 ± 2.78, p < 0.0001; 15–19 years — 3.58 ± 1.97 and 7.19 ± 3.23, p < 0.0001; 20–24 years — 3.58 ± 1.97 and 8.03 ± 2.45, p < 0.0001. Vitamin D deficiency was observed in 39.7 % (n = 120) of cases, insufficiency — in 30.4 % (n = 92), 29.9 % of women had normal bones (n = 90). We didn’t register any seasonal or monthly impact as far as 25(ОН)D is concerned (F = 0.51; p = 0.89). The 25(ОН)D level had a negative correlation with body weight, body mass index, fat mass indices, and positive — with a 10-year probability of major osteoporotic fractures. Conclusions. The obtained results indicate a significant negative impact of pre- and postmenopause duration on bone mineral density and quality variability, and a positive one — on the 10-year probability of major osteoporotic fractures and hip fractures. For the postmenopausal women, obesity is a protective factor against bone loss and developing osteoporosis, which is likely due to the elevated adipocyte rate. According to the regression analysis, there is a confirmed negative correlation between body weight, body mass index, total fat mass and 25(ОН)D concentration in the blood serum. The above-mentioned fact requires elaboration of an adequate therapeutic approach when the vitamin D deficiency is associated with obesity.
25(ОН)D; 10-річна ймовірність основних остеопоротичних переломів; загальна жирова маса; остеопороз
25(ОН)D; 10-летняя вероятность основных остеопоротических переломов; общая жировая масса; остеопороз
25(ОН)D; 10-year probability of major osteoporotic fractures; total fat mass; osteoporosis
Вступ
Матеріали та методи
Результати
Обговорення
/30.jpg) У 1997 р. Європейський фонд остеопорозу та кісткових захворювань (згодом — Міжнародний фонд остеопорозу (IOF)) опублікував настанови щодо діагностики та лікування остеопорозу, оновлені в 2008 та 2013 р. IOF та Європейським товариством клінічної та економічної оцінки остеопорозу та остеоартриту (ESCEO). Метою нових настанов (2018 р.) є перегляд та оновлення діагностики остеопорозу, терапевтичних втручань і способів їх використання для розробки стратегій управління для запобігання остеопоротичним переломам у жінок в постменопаузі [1].
У 1997 р. Європейський фонд остеопорозу та кісткових захворювань (згодом — Міжнародний фонд остеопорозу (IOF)) опублікував настанови щодо діагностики та лікування остеопорозу, оновлені в 2008 та 2013 р. IOF та Європейським товариством клінічної та економічної оцінки остеопорозу та остеоартриту (ESCEO). Метою нових настанов (2018 р.) є перегляд та оновлення діагностики остеопорозу, терапевтичних втручань і способів їх використання для розробки стратегій управління для запобігання остеопоротичним переломам у жінок в постменопаузі [1].Висновки
- Kanis J.A., Cooper C., Rizzoli R., Reginster J.Y. Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos. Int. 2019. № 30(1). Р. 3-44. doi: 10.1007/s00198-018-4704-5.
- Поворознюк В.В., Григор’єва Н.В. Менопауза і остеопороз. Репродуктивна гінекологія. 2012. № 2(4). Р. 40-47.
- Dadoniene J., Cypiene A., Rinkuniene E., Badariene J., Laucevičius A. Vitamin D, cardiovascular and bone health in postmenopausal women with metabolic syndrome. Adv. Clin. Ex.p Med. 2018. № 27(11). Р. 1555-1560. doi: 10.17219/acem/75147.
- Jorde R., Grimnes G. Vitamin D and metabolic health with special reference to the effect of vitamin D on serum lipids. Prog. Lipid Res. 2011. № 50(4). Р. 303-312.
- Lerchbaum E. Vitamin D and menopause: A narrative review. Maturitas. 2014. № 79(1). Р. 3-7.
- Kanis J.A. on behalf of the World Health Organization Scientific Group. Assessment of Osteoporosis at the primary healthcare level. Technical Report. WHO Collaborating Centre, University of Sheffield, UK. Available at http://www.Shef.ak.uk/FRAX/pdfs/WHO_Technical_Report.pdf. [Accessed November 22 2019].
- Поворознюк В.В., Григор’єва Н.В., Kanis J.A., Johansson H., McCloskey E.V. Українська версія FRAX: критерії діагностики й лікування остеопорозу. Біль. Суглоби. Хребет. 2019. № 9(4). С. 9-16. doi: 10.22141/2224-1507.9.4.2019.191921.
- Povoroznyuk V.V., Grygorieva N.V., Kanis J.A. et al. Epidemiology of hip fracture and the development of FRAX in Ukraine. Arch. Osteoporos. 2017. № 12(1). Р. 53. doi: 10.1007/s11657-017-0343-2.
- Vasic J., Petranova T., Povoroznyuk V. et al. Evaluating spine microarchitectural texture (via TBS) discriminates major osteoporotic fractures from controls both as well as independent of site matched BMD: the Eastern European TBS study. J. Bone Miner. Metab. 2014. № 32(5). Р. 556-562.
- Krueger D., Fidler E., Libber J. et al. Spine trabecular bone score subsequent to bone mineral density improves fracture discrimination in women. J. Clin. Densitom. 2014. № 17(1). Р. 60-65.
- Richards C., Hans D., William D., Leslie W.D. Trabecular Bone Score (TBS) Predicts Fracture in Ankylosing Spondylitis: The Manitoba BMD Registry. J. Clin. Densitometry. 2020. doi.org/10.1016/j.jocd.2020.01.003
- Shevroja E., Lamy J., Kohlmeier L., Koromani F., Rivadeneira F., Hans D. Use of Trabecular Bone Score (TBS) as a Complementary Approach to Dual-energy X-ray Absorptiometry (DXA) for Fracture Risk Assessment in Clinical Practice. J. Clin. Densitometry. 2017. № 20(3). Р. 334-345 doi: 10.1016/j.jocd.2017.06.019.
- Pereira-Santos M., Costa P.R., Assis A.M., Santos C.A., Santos D.B. Obesity and vitamin D deficiency: A systematic review and meta-analysis. Obes. Rev. 2015. № 16(4). Р. 341-9. doi: 10.1111/obr.12239.
- Soskić S., Stokić E., Isenović E.R. The relationship between vitamin D and obesity. Curr. Med. Res. Opin. 2014. № 30(6). Р. 1197-9. doi: 10.1185/03007995.2014.900004.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society Clinical Practice Guideline. J. Clin. Endocrinol. Metab. 2011. № 96(7). Р. 1911-30. doi: 10.1210/jc.2011-0385.
- Greco E.A., Lenzi A., Migliaccio S.І. The obesity of bone. Ther. Adv. Endocrinol. 2015. № 6(6). Р. 273-286.
- Zhao L.-J., Liu Y.-J., Liu P.-Y. et al. Relationship of obesity with osteoporosis. J. Clin. Endocrinol. Metab. 2007. № 92(5). Р. 1640-1646.
- Nielson C.M., Srikanth P., Orwoll E.S. Obesity and fracture in men and women: an epidemiologic perspective. J. Bone Miner. Res. 2012. № 27(1). Р. 1-10.
- Kim K.C., Shin D.H., Lee S.Y. et al. Relation between obesity and bone mineral density and vertebral fractures in Korean postmenopausal women. Yonsei Med. J. 2010. № 51(6). Р. 857-863.
- Parikh S.J., Edelman M., Uwaifo G. et al. The relationship between obesity and serum 1,25-dihydroxyvitamin D concentrations in healthy adults. J. Clin. Endocrinol. Metab. 2004. № 89. Р. 1196-9.

/25.jpg)
/27.jpg)
/28.jpg)
/26.jpg)
/29.jpg)