Международный эндокринологический журнал Том 16, №3, 2020
Вернуться к номеру
Підвищення ефективності лікування пацієнтів із метаболічним синдромом шляхом застосування комплексу селену та вітамінів Оксилік
Авторы: Пашковська Н.В., Абрамова Н.О.
ВДНЗУ «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Метаболічний синдром (МС) вражає приблизно чверть населення планети, супроводжується абдомінальним ожирінням та інсулінорезистентністю, що є чинниками дисліпідемії, артеріальної гіпертензії і гіперглікемії. Синдром нетиреоїдної патології розвивається в 75 % госпіталізованих пацієнтів і супроводжується периферичним гіпотиреозом через пригнічення периферичної конверсії тиреоїдних гормонів. Через те, що близько 80 % гормонів щитоподібної залози виробляється в периферичних органах і вони регулюють майже всі процеси в організмі, патологічні зміни, які супроводжують синдром нетиреоїдної патології, можна вважати суттєвими й такими, що потребують корекції. Однак ефективність складних вітамінних комплексів у поєднанні із селеном при лікуванні МС залишається невідомою. Мета дослідження: вивчити ефективність лікування порушень вуглеводного, ліпідного обміну, ендотеліальної функції, антиоксидантної системи, тиреоїдного гомеостазу у хворих на МС із застосуванням комплексу Оксилік. Матеріали та методи. Досліджено ефективність призначення комплексу селену та вітамінів Оксилік по одній капсулі протягом одного місяця з метою впливу на ланки МС. Для підтвердження ефективності запропонованого способу лікування нами обстежені й проліковані 65 пацієнтів із МС: 30 хворих на МС (перша група), які отримували Оксилік протягом одного місяця на тлі базисного лікування антигіпертензивними й цукрознижувальними препаратами, і 35 осіб із МС (друга група), які отримували тільки базисну терапію. Результати. Додаткове призначення комплексу Оксилік пацієнтам із МС по одній капсулі протягом одного місяця призводить до вірогідного покращення чутливості рецепторів до інсуліну, що проявляється зниженням індексу HOMA-IR, показників функціонального стану ендотелію (зниження продукції судинного ендотеліального фактора росту й десквамації ендотеліоцитів) і ліпідного обміну (зниження вмісту загального холестерину, зростання рівня ліпопротеїнів високої щільності й зниження коефіцієнта атерогенності), зниженням рівня вільного тироксину (вТ4), зростанням вільного трийодтироніну (вТ3) і співвідношення вТ3/вТ4, що свідчить про покращення периферичної конверсії тиреоїдних гормонів шляхом підвищення периферичного дейодування Т4 у більш активний Т3. Висновки. Комплекс селену та вітамінів Оксилік можна рекомендувати для хворих із метаболічним синдромом.
Актуальность. Метаболический синдром (МС) поражает примерно четверть населения планеты и сопровождается абдоминальным ожирением и инсулинорезистентностью, которые являются факторами дислипидемии, артериальной гипертензии и гипергликемии. Синдром нетиреоидной патологии развивается у 75 % госпитализированных пациентов и сопровождается периферическим гипотиреозом из-за подавления периферической конверсии тиреоидных гормонов. Так как около 80 % гормонов щитовидной железы производится в периферических органах и они регулируют почти все процессы в организме, патологические изменения, которые сопровождают нетиреоидную патологию, можно считать существенными и требующими коррекции. Однако эффективность сложных витаминных комплексов в сочетании с селеном при лечении МС остается неизвестной. Цель исследования: изучить эффективность лечения нарушений углеводного, липидного обмена, эндотелиальной функции, антиоксидантной системы, тиреоидного гомеостаза у больных с МС путем применения комплекса Оксилик. Материалы и методы. Нами исследована эффективность назначения комплекса селена и витаминов Оксилик по одной капсуле в течение одного месяца с целью влияния на звенья МС. Для подтверждения эффективности предлагаемого способа лечения нами обследовано и пролечено 65 пациентов с МС: 30 больных МС (первая группа), получавших Оксилик в течение одного месяца на фоне базисного лечения антигипертензивными и сахароснижающими препаратами, и 35 человек с МС (вторая группа), получавших только базисную терапию. Результаты. Дополнительное назначение комплекса Оксилик пациентам с МС по одной капсуле в течение одного месяца приводит к достоверному улучшению чувствительности рецепторов к инсулину, что отражается в снижении индекса HOMA-IR, показателей функционального состояния эндотелия (снижение продукции сосудистого эндотелиального фактора роста и десквамации эндотелиоцитов) и липидного обмена (снижение общего холестерина, рост липопротеинов высокой плотности и снижение коэффициента атерогенности), снижении титра уровня свободного тироксина (свТ4), возрастании свободного трийодтиронина (свТ3) и соотношения свТ3/свТ4, что свидетельствует об улучшении периферической конверсии тиреоидных гормонов путем повышения периферического дейодирования Т4 в более активный Т3. Выводы. Комплекс селена и витаминов Оксилик можно рекомендовать для больных с метаболическим синдромом.
Background. Metabolic syndrome (MS) affects about a quarter of the world population and is accompanied by abdominal obesity and insulin resistance, which are the factors of dyslipidemia, hypertension and hyperglycemia. Nonthyroidal illness syndrome affects about 75 % of hospitalized patients and is accompanied by peripheral hypothyroidism due to inhibition of peripheral conversion of thyroid hormones. Due to the fact that about 80 % of thyroid hormones are produced in peripheral organs, and they regulate almost all processes in the body, the pathological changes that accompany nonthyroidal illness syndrome can be regarded significant. However, the effectiveness of vitamin complexes in combination with selenium in treatment of MS remains unknown. The purpose of the research was to study the effectiveness of Oxylyc in the comprehensive treatment of disorders of carbohydrate, lipid metabolism, endothelial function, antioxidant system, thyroid homeostasis in patients with metabolic syndrome. Materials and methods. Sixty-five patients were enrolled to the study. All patients were previously diagnosed with metabolic syndrome. To assess the effectiveness of treatment, patients were randomized into two groups. Patients of the first group (30 people) received Oxylyc — one capsule for 1 month on the background of basic treatment. Representatives of the second group (35 people) received basic treatment. Results. Additional administration of Oxylyc in treatment of patients with MS for 1 month leads to a significant improvement in the sensitivity of receptors to insulin, which is reflected in a decrease in HOMA-IR, indicators of the functional state of the endothelium (decreased production of vascular endothelial growth factor, and desquamation of endothelium), lipid metabolism (decrease in cholesterol, increase in high density lipoproteins and decrease in atherogenic coefficient, decrease in the titer of the free thyroxine (fТ4), increase in the free triiodothyronine (fТ3) and the ratio of fT3/fT4, which indicates an improvement of the peripheral conversion of thyroid hormones). Conclusions. Oxylyc can be recommended in comprehensive treatment of metabolic syndrome.
метаболічний синдром; селен; комплекс селену та вітамінів Оксилік
метаболический синдром; селен; комплекс селена и витаминов Оксилик
metabolic syndrome; selenium; selenium and vitamin complex Oxylyc
Вступ
Матеріали та методи
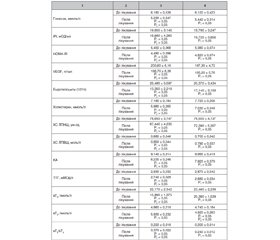
Результати
Обговорення
Висновки
- De Oliveira C.M., Pavani J., Krieger J.E. et al. Body adiposity index in assessing the risk of type 2 diabetes mellitus development: the Baependi Heart Study. Diabetol. Metab. Syndr. 2019. 11. 76. URL: https://doi.org/10.1186/s13098-019-0467-1.
- Cercato C., Fonseca F.A. Cardiovascular risk and obesity. Diabetol. Metab. Syndr. 2019. 11. 74. doi: 10.1186/s13098-019-0468-0.
- Gupta D., Krueger C.B., Lastra G. Over-nutrition, obesity and insulin resistance in the development of β-cell dysfunction. Curr. Diabetes Rev. 2012. 8(2). 76-83. DOI:10.2174/157339912799424564.
- Шишкин А.Н., Лындина М.Л. Эндотелиальная дисфункция, метаболический синдром и микроальбуминурия. Нефрология. 2009. 13(3). 24-31.
- Loebig M., Klement J., Schmoller A., Betz S., Heuck N., Schweiger U., Peters A., Schultes B., Oltmanns K.M. Evidence for a relationship between VEGF and BMI independent of insulin sensitivity by glucose clamp procedure in a homogenous group healthy young men. PLoS One. 2010. 5(9). e12610. doi: 10.1371/journal.pone.0012610.
- Schiapaccassa A., Maranhão P.A., de Souza M.D.G.C., Panazzolo D.G., Nogueira Neto J.F., Bouskela E., Kraemer-Aguiar L.G. 30-days effects of vildagliptin on vascular function, plasma viscosity, inflammation, oxidative stress, and intestinal peptides on drug-naïve women with diabetes and obesity: a randomized head-to-head metformin-controlled study. Diabetology & Metabolic Syndrome. 2019. 11. 70. DOI: 10.1186/s13098-019-0466-2.
- Li R., Li W., Lun Z., Zhang H., Sun Z., Kanu J.S. et al. Prevalence of metabolic syndrome in mainland china: a meta-analysis of published studies. BMC Public Health. 2016. 16. 296. doi: 10.1186/s12889-016-2870-y.
- Wajner S.M., Maia A.L. New Insights toward the Acute Non-Thyroidal Illness Syndrome. Front Endocrinol (Lausanne). 2012. 3. 8. doi:10.3389/fendo.2012.00008.
- Wang B., Liu S., Li L., Yao Q., Song R., Shao X., Li Q., Shi X., Zhang J.A. Non-thyroidal illness syndrome in patients with cardiovascular diseases: A systematic review and meta-analysis. Int. J. Cardiol. 2017. 226. 1-10. doi: 10.1016/j.ijcard.2016.10.039.
- El-Ella S.S.A., El-Mekkawy M.S., El-Dihemey M.A. Prevalence and prognostic value of non-thyroidal illness syndrome among critically ill children. An. Pediatr (Barc). 2019. 90(4). 237-243. doi: 10.1016/j.anpedi.2018.01.021.
- Roman M., Jitaru P., Barbante C. Selenium biochemistry and its role for human health. Metallomics. 2014. 6(1). 25-54. doi: 10.1039/c3mt00185g.
- Бекарова А.М. Грудное вскармливание. Consilium medicum. Педиатрия. 2009. 3. 8-13.
- Himoto T., Yoneyama H., Kurokohchi K., Inukai M., Masugata H., Goda F. et al. Selenium deficiency is associated with insulin resistance in patients with hepatitis C virus-related chronic liver disease. Nutr. Res. 2011. 31(11). 829-35. doi: 10.1016/j.nutres.2011.09.021.
- Smith A.D., Cheung E., Beshah E., Shea-Donohue T., Urban J.F. Selenium status alters the immune response and expulsion of adult Heligmosomoides bakeri in mice. Infection and immunity. 2013. 81(7). 2546-2553. doi: 10.1128/IAI.01047-12.
- Zhang Q., Qian Z.Y., Zhou P.H., Zhou X., Zhang D.L., He N. et al. Effects of oral selenium and magnesium co-supplementation on lipid metabolism, antioxidative status, histopathological lesions, and related gene expression in rats fed a high-fat diet. Lipids Health Dis. 2018. 17. 165. doi: 10.1186/s12944-018-0815-4.
- Farhangi M.A., Keshavarz S.A., Eshraghian M., Ostadrahimi A., Saboor-Yaraghi A.A. The effect of vitamin A supplementation on thyroid function in premenopausal women. J. Am. Coll. Nutr. 2012. 31(4). 268-74. DOI: 10.1080/07315724.2012.10720431.

/54.jpg)
/55.jpg)
/56.jpg)