Журнал «Травма» Том 21, №3, 2020
Вернуться к номеру
Нова технологія двохетапного ревізійного ендопротезування кульшового суглоба із застосуванням цифрової поляризаційної і лазерно-індукованої автофлуоресцентної мікроскопії та інтраопераційного виготовлення спейсерів II покоління
Авторы: Васюк В.Л.(1), Васильчишин Я.М.(2), Процюк В.В.(2)
(1) — Вищий державний навчальний заклад України «Буковинський державний медичний університет»,
м. Чернівці, Україна
(2) — Шведсько-український медичний центр Angelholm, м. Чернівці, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Застосування лазерних джерел у діагностиці септичної нестабільності компонентів ендопротеза кульшового суглоба показало, що найбільшу чутливість, специфічність та точність демонструє метод спектрополяриметрії: чутливість досягає 92–93 %, специфічність — 82–86 %, а точність — 88–89 %. При цьому дослідження триває 1–2 години. У 2017 році нами було розроблено прес-форми для інтраопераційного виготовлення спейсерів ІІ покоління. Метою даного дослідження було покращення результатів лікування септичної нестабільності компонентів ендопротеза кульшового суглоба шляхом виконання цифрової поляризаційної мікроскопії синовіальної рідини та інтраопераційного виготовлення й застосування цементно-антибіотикових спейсерів ІІ покоління. Матеріали та методи. Диференційна діагностика септичного чи асептичного характеру нестабільності компонентів ендопротеза здійснювалася завдяки проведенню комплексу оптико-фізичних і флуоресцентних досліджень полікристалічної структури синовіальної рідини. Застосування розробленої нами технології інтраопераційного виготовлення спейсера із застосуванням прес-форм дозволяє швидко виготовити під час операції спейсер потрібного розміру. До цементу додають високі дози антибіотиків з урахуванням даних антибіотикограми конкретного пацієнта. Результати. Удосконалена нами технологія застосована при хірургічному лікуванні перипротезної інфекції у 52 пацієнтів. Проведений аналіз віддалених результатів двохетапного ревізійного ендопротезування кульшового суглоба у 49 пацієнтів (94,2 %) показав, що ерадикація інфекції та добрі функціональні результати досягнуті у 89,7 % випадків. Середня оцінка у них становила 87,18 ± 6,44 бала за шкалою Harris Hip Score. Визначено для статистичних моментів 3-го і 4-го порядків, що характеризують асиметрію та ексцес розподілів параметра оптичної анізотропії полікристалічних плівок синовіальної рідини правого та лівого кульшового суглоба, діапазони зміни величини чутливості — 88 % ≤ Se ≤ 96 %; специфічності — 84 % ≤ Sр ≤ 92 % і збалансованої точності поляризаційного відтворення розподілів двопроменезаломлення — 86 % ≤ Ас ≤ 92 %. Висновки. У лікуванні 52 пацієнтів з перипротезною інфекцією кульшового суглоба для виконання першого етапу ревізійного ендопротезування нами розроблена та впроваджена нова технологія інтраопераційного виготовлення спейсерів ІІ покоління із застосуванням розроблених прес-форм. Вартість такого спейсера в рази менша, ніж вартість стандартного спейсера, виготовленого на заводі. Диференційна діагностика септичного характеру нестабільності компонентів ендопротеза здійснювалася за допомогою азимутально-інваріантної Мюллер-матричної мікроскопії двопроменезаломлення полікристалічної складової синовіальної рідини. Ерадикація інфекції та добрі функціональні результати досягнуті у 89,7 % випадків. Середня оцінка за шкалою Harris Hip Score під час контрольного огляду становила 87,18 ± 6,44 бала.
Актуальность. Применение лазерных источников в дифференциальной диагностике септической нестабильности компонентов эндопротеза тазобедренного сустава показало, что наибольшую чувствительность, специфичность и точность демонстрирует метод спектрополяриметрии: чувствительность достигает 92–93 %, специфичность — 82–86 %, а точность — 88–89 %. При этом исследование длится 1–2 часа. В 2017 году нами были разработаны пресс-формы для интраоперационного изготовления спейсеров ІІ поколения. Целью данного исследования было улучшение результатов лечения септической нестабильности компонентов эндопротеза тазобедренного сустава путем выполнения цифровой поляризационной микроскопии синовиальной жидкости и интраоперационного изготовления и применения цементно-антибиотиковых спейсеров ІІ поколения. Материалы и методы. Дифференциальная диагностика септического или асептического характера нестабильности компонентов эндопротеза осуществлялась благодаря проведению комплекса оптико-физических и флуоресцентных исследований поликристаллической структуры синовиальной жидкости. Применение разработанной нами технологии интраоперационного изготовления спейсера с применением пресс-форм позволяет быстро изготовить во время операции спейсер нужного размера. В цемент добавляют высокие дозы антибиотиков с учетом данных антибиотикограммы конкретного пациента. Результаты. Усовершенствованная нами технология применена при хирургическом лечении перипротезной инфекции у 52 пациентов. Проведенный анализ отдаленных результатов двухэтапного ревизионного эндопротезирования тазобедренного сустава у 49 пациентов (94,2 %) показал, что эрадикация инфекции и хорошие функциональные результаты достигнуты в 89,7 % случаев. Средняя оценка у них составила 87,18 ± 6,44 балла по шкале Harris Hip Score. Определены для статистических моментов 3-го и 4-го порядков, характеризующих асимметрию и эксцесс распределений параметра оптической анизотропии поликристаллических пленок синовиальной жидкости тазобедренного сустава, диапазоны изменения величины чувствительности — 88 % ≤ Se ≤ 96 %; специфичности — 84 % ≤ Sp ≤ 92 % и сбалансированной точности поляризационного воспроизведения распределений двулучепреломления — 86 % ≤ Ас ≤ 92 %. Выводы. При лечении 52 пациентов с перипротезной инфекцией тазобедренного сустава для выполнения первого этапа ревизионного эндопротезирования нами разработана и внедрена новая технология изготовления спейсеров ІІ поколения с применением разработанных нами пресс-форм. Стоимость такого спенсера в разы меньше, чем стоимость стандартного спенсера, изготовленного на заводе. Дифференциальная диагностика септического характера нестабильности компонентов эндопротеза осуществлялась с помощью азимутально-инвариантной Мюллер-матричной микроскопии двулучепреломления поликристаллической структуры синовиальной жидкости. Эрадикация инфекции и хорошие функциональные результаты достигнуты в 89,7 % случаев. Средняя оценка по шкале Harris Hip Score в ходе контрольного осмотра составила 87,18 ± 6,44 балла.
Background. The results of two-stage hip revision arthroplasty depend much on accuracy in differentiating septic component instability from aseptic one. Conventionally, it is based on microbiological assessment of joint aspirate or samples from the wound. The results are available in 8–10 days, and in case of anaerobic infection as late as in 2–3 weeks. Using laser sources for diagnosing the septic instability of hip endoprosthesis components showed spectropola-rimetry to have the highest sensitivity, specificity, and accuracy: its sensitivity reached 92–93 %, specificity — 82–86 %, and accuracy — 88–89 %. The result could be ready in 1–2 hours. In 2012, new reusable molds for intraoperative production of the antibiotic impregnation spacers based on the patient’s antibioticogram were designed by us. Such contained the antibiotics for which the patient’s infection was susceptible, and resembled the shape of a monopolar endoprosthesis. In 2017, the second-generation spacer and new reusable die molds for intraoperative production of the new variant of spacers were designed by us. The second-generation spacer consists of a spacer-head and a spacer-stem separately. They are simultaneously made intra-operatively. Also, there was strengthened a reinforcing rod inside the spacer-stem. This design reduces operations time and traumatism and provides a safe active motor mode between two stages of revision arthroplasty. The purpose of the study was to improve the results of cement spacers treatment for septic instabi-lity of hip endoprosthesis or its components using digital polarization and laser-induced autofluorescence microscopy of synovial fluid, and intraoperative production and application of second-generation antibiotic impregnated cement spacers in accordance with the patient’s antibioticogram. Materials and methods. Differential diagnosis of septic or aseptic nature of the endoprosthesis components was performed by means of complex optical and fluorescent assessment of synovial fluid polycrystalline structure. The sensitivity was shown to be the highest for circular birefringence Mueller-matrix microscopy of polycrystalline component in synovial fluid. The newly designed technique for hip spacer molding using die molds allows to quickly produce a spacer of exact shape and size during surgery. It is done routinely by scrub nurse, saving the surgeon’s time. The spacer’s head has perfectly spherical smooth surface. Mechanical strength provided by reinforce wires allows postoperative movements and ambulation. High doses of antibiotics according to the patient’s pathogen susceptibility were added to the cement. Results. The improved technique of two-stage revision hip arthroplasty was used in surgical treatment of 52 patients. Follow-up results were studied in 49 patients (94.2 %) after two-stage hip revision. Infection eradication and good functional outcome was achieved in 89.7 %. The mean Harris Hip Score was 87.18 ± 6.44. There were determined for statistical moments of the 3rd and 4th orders, which characterize the asymmetry and excess distributions of the optical anisotropy parameter of polycrystalline films of synovial fluid of the right and left hip joints: ranges of sensitivity 88 % ≤ Se ≤ 96 %; specificity 84 % ≤ Sp ≤ 92 % and balanced accuracy 86 % ≤ Ас ≤ 92 % of polarization reconstruction of birefringence distributions. Conclusions. A new technique of two-stage hip revision arthroplasty was designed. Intra-operative production of second-generation cement spacers using the designed die molds was implemented in the treatment of 52 patients with hip joint periprosthetic infection. Septic nature of the instability in the endoprosthesis components was diagnosed using circular birefringence Mueller-matrix microscopy of polycrystalline component in synovial fluid. Infection eradication and good functional outcome was achieved in 89.7 %. The mean Harris Hip Score at follow-up was 87.18 ± 6.44.
кульшовий суглоб; ревізійне ендопротезування; септична нестабільність; спейсери; поляризаційна мікроскопія; автофлуоресцентна мікроскопія
тазобедренный сустав; ревизионное эндопротезирование; септическая нестабильность; спейсеры; поляризационная микроскопия; аутофлуоресцентная микроскопия
hip joint; revision arthroplasty; septic instability; spacers; polarization microscopy; autofluorescence microscopy
Вступ
Матеріали та методи
Методика забору та виконання оптико-лазерного дослідження мазка синовіальної рідини методами поляризаційної, Мюллер-матричної та лазерно-індукованої флуоресцентної мікроскопії при діагностиці глибокої ППІ кульшового суглоба
/32.jpg)
/33_2.jpg)
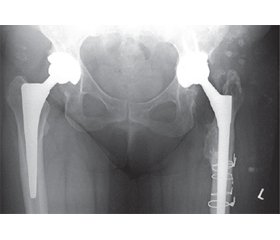
Результати та обговорення
/40_3.jpg)
Висновки
1. Васильчишин Я.М., Васюк В.Л., Білик С.В. Пристрій для тимчасового реендопротезування проксимальної частини стегнової кістки. Деклараційний патент України на корисну модель № 25286 від 27.09.2010. Промислова власність. Бюл. № 18. 2010.
2. Васюк В.Л., Кваснюк Д.І., Ушенко О.Г., Васюк С.В. Диференційна діагностика септичних та асептичних артритів, місце та роль поляризаційно-мікроскопічних та спектрополяризаційних методик. Монографія. Чернівці: ВДНЗУ «Буковинський державний медичний університет», 2016. 200 с.
3. Кваснюк Д.І., Васюк С.В, Ушенко О.Г. Диференційна діагностика реактивного та септичного артритів методом фазометрії синовіальної рідини людини. Ортопедия, травматология и протезирование. 2012. 4. 69-72.
4. Климовицкий Р.В., Филиппенко В.А., Тяжелов А.А., Гончарова Л.Д., Стауде В.А. Дооперационная подготовка пациентов к эндопротезированию тазобедренного сустава. Травма. 2018. 2.
5. Колов Г.Б. Діагностика та лікування гнійних ускладнень після ендопротезування кульшового та колінного суглобів: Автореф. дис. … на здобуття наук. ступеня канд. мед. наук: спец. 14.01.21 «Травматологія та ортопедія». К., 2008. 19 с.
6. Філіпенко В.А., Марущак О.П., Леонтьєва Ф.С., Морозенко Д.В., Кузнєцова Н.В. Результати лабораторних досліджень рідини з колінних та кульшових суглобів після ендопротезування для ранньої діагностики періпротезної інфекції. Травма. 2019. № 1. Т. 20. C. 49-55.
7. Akgün D., Perka C., Trampuz A., Renz N. Outcome of hip and knee periprosthetic joint infections caused by pathogens resistant to biofilm-active antibiotics: results from a prospective cohort study. Arch. Orthop. Trauma Surg. 2018. 138(5). 635-642. https://doi.org/10.1007/s00402-018-2886-0.
8. Armstrong M.D., Carli A.V., Abdelbary H., Poitras S., Lapner P., Beaulé P.E. Tertiary care centre adherence to unified guidelines for management of periprosthetic joint infections: a gap analysis. Can. J. Surg. 2018. 61(1). 34-41. https://doi.org/10.1503/cjs.008617.
9. Fagotti L., Tatka J., Salles M.J.C., Queiroz M.C. Risk Factors and Treatment Options for Failure of a TwoStage Exchange. Curr. Rev. Musculoskelet Med. 2018. 11(3). 420-427. https://doi.org/10.1007/s12178-018-9504-1.
10. Karbysheva S., Renz N., Yermak K., Cabric S., Trampuz A. New Methods in the Diagnosis of Prosthetic Joint Infection. Traumatology and Orthopedics of Russia. 2019. 25(4). 56-63. https://doi.org/10.21823/2311-2905-2019-25-4-56-63.
11. Kosyakov О.M., Burianov О.A., Karpinska О.D., Bondar V.K. Determination of risk factors for negative results of total hip replacement using Physiohip trabecular bionic leg. TRAUMA. 2018. 19(5). 130-134.
12. Liventsov V.N., Bozhkova S.A., Kochish A.Y., Artyukh V.A., Razorenov V.L., Labutin D.V. Difficult-To-Treat Periprosthetic Hip Infection: Outcomes of Debridment. Traumatology and Orthopedics of Russia. 2019. 25(4). 88-97 (In Russ.). https://doi.org/10.21823/2311-2905-2019-25-4-88-97.
13. Shohat N., Bauer T., Buttaro M., Budhiparama N., Cashman J., Della Valle C.J. et al. Hip and knee section, what is the definition of a periprosthetic joint infection (PJI) of the knee and the hip? Can the same criteria be used for both joints? Proceedings of international consensus on orthopedic infections. J. Arthroplasty. 2019. 34(2S). S325-S327. https://doi.org/10.1016/j. arth.2018.09.045.
14. Yacovelli S., Parvizi J. Who Should Manage Periprosthetic Joint Infection? The Case for a Multidisciplinary Approach. Traumatology and Orthopedics of Russia. 2019. 25(4). 28-32. https://doi.org/10.21823/2311-2905-2019-25-4-28-32.
15. Zmistowski B.M., Manrique J., Patel R., Chen A.F. Recurrent Periprosthetic Join Infection After Irrigation and Debridement With Component Retention Is Most Often Due to Identical Organisms. J. Arthroplasty. 2016. 31(9 Suppl.). 148-151. https://doi.org/10.1016/j. arth.2016.05.040.

/33.jpg)
/34.jpg)
/36.jpg)
/37.jpg)
/37_2.jpg)
/38_2.jpg)
/38.jpg)
/39_2.jpg)
/40_2.jpg)
/39.jpg)
/40.jpg)