Журнал «Медицина неотложных состояний» Том 16, №4, 2020
Вернуться к номеру
Влияние нестероидных противовоспалительных препаратов на некоторые показатели иммунного ответа при онкохирургических операциях
Авторы: Лесной И.И., Храновская Н.Н., Скачкова О.В.
Национальный институт рака, г. Киев, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті наводяться результати дослідження впливу періопераційного знеболювання аналгетиками декскетопрофеном і парекоксибом натрію на деякі показники, що характеризують стан клітинної ланки імунної системи у хворих на рак нирки, яким виконана нефректомія або резекція нирки. Встановлено, що при використанні декскетопрофену та парекоксибу натрію післяопераційна імуносупресія має менш виражений характер, що проявляється стабільною кількістю імунокомпетентних клітин, кількістю натуральних кілерних клітин і їх цитотоксичною активністю. Імунозберігаючий ефект більш виражений у декскетопрофену, ніж у парекоксибу натрію.
В статье приводятся результаты исследования влияния периоперационного обезболивания аналгетиками декскетопрофеном и парекоксибом натрия на некоторые показатели, характеризующие состояние клеточного звена иммунной системы у больных раком почки, которым выполнена нефрэктомия или резекция почки. Установлено, что при использовании декскетопрофена и парекоксиба натрия послеоперационная иммуносупрессия имеет менее выраженный характер, что проявляется стабильным количеством иммунокомпетентных клеток, количеством натуральных киллерных клеток и их цитотоксической активностью. Иммуносберегающий эффект более выражен у декскетопрофена, чем у парекоксиба натрия.
The article presents the results of a study on the effect of perioperative analgesia with dexketoprofen and parecoxib sodium on some indicators characterizing the state of the cellular link of the immune system in patients with kidney cancer who underwent nephrectomy or kidney resection. It was found that when using dexketoprofen and parecoxib sodium, postoperative immunosuppression is less pronounced, which is manifested itself in a stable number of immunocompetent cells, the number of natural killer cells and their cytotoxic activity. The immunosaving effect is more pronounced in dexketoprofen than in parecoxib sodium.
декскетопрофен; парекоксиб натрію; імунна система; нирковоклітинний рак
декскетопрофен; парекоксиб натрия; иммунная система; почечноклеточный рак
dexketoprofen; parecoxib sodium; immune system; renal cell carcinoma
Материалы и методы
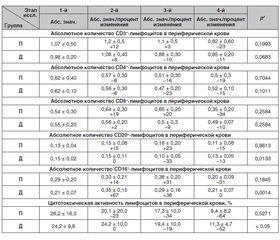
Результаты исследования
Обсуждение результатов исследования
Заключение
- Ogawa K., Hirai M., Katsube T. et al. Suppression of cellular immunity by surgical stress. Surgery. 2000. 127. 329-36.
- Page G.G. Surgery-induced immunosuppression and postoperative pain management. AACN Clin. Issues. 2005. 16. 302-9.
- Kurosawa S., Kato M. Anesthetics, immune cells, and immune responses. J. Anesth. 2008. 22. 263-277.
- Michael D., Brigitte V. Surgical trauma: hyperinflammation versus immunosuppression? Langenbecks Arch. Surg. 2004. 389. 475-484.
- Shimaoka M., Hosotsubo K., Sugimoto M. et al. The influence of surgical stress on T cells: enhancement of early phase lymphocyte activation. Anesth. Analg. 1998. 87. 1431-5.
- Гриневич Ю.А., Барабой В.А. Новообразовательный процесс и стрессовая патология. К.: Логос, 2010. 155 с.
- Meiler S. Long-term outcome after anesthesia and surgery: remarks on the biology of a newly emerging principle in perioperative care. Anesthesiology Clin. N. Am. 2006. 24. 255-278.
- Homburger J., Meiler S. Anesthesia drugs, immunity, and long-term outcome. Curr. Opin. Anesthesiol. 2006. 19. 423-428.
- Kusmartsev S., Gabrilovich D. Immature myeloid cells and cancer-associated immune suppression. Cancer. Immunol. Immunother. 2006. 51. 293-8.
- Serafini P., De Santo C., Marigo I. et al. Derangement of immune responses by myeloid suppressor cells. Cancer. Immunol. Immunother. 2004. 53. 64-72.
- Page G.G. Surgery-induced immunosuppression and postoperative pain management. AACN Clin. Issues. 2005. 16. 302-9.
- Procopio M.A., Rassias A.J., DeLeo J.A. et al. The in vivo effects of general and epidural anesthesia on human immune function. Anesth. Analg. 2001. 93. 460-5.
- Al-Hasani R., Bruchas M. Molecular mechanisms of opioid Receptor dependent signaling and behavior. Anesthesiology. 2011. 115. 1363-1381.
- Martin J., Koodie L., Krishnan A. et al. Chronic morphine administration delays wound healing by inhibiting immune cell recruitment to the wound site. Am. J. Pathol. 2010. 176. 786-799.
- Yuan F., Xiaozhou H., Yilin Y. Current Research on Opioid Receptor Function. Curr. Drug Targets. 2012. 13(2). 230-246.
- Welters I., Menzebach A., Goumon Y. et al. Morphine suppresses complement receptor expression, phagocytosis, and respiratory burst in neutrophils by a nitric oxide and µ3 oipate receptor-dependent mechanism. J. Neuroimmunol. 2000. 111. 139-145.
- Mojadadi S., Jamali A., Khansarinejad B. et al. Acute morphine administration reduces cell-mediated immunity and induces reactivation of latent herpes simplex virus type 1 in BALB/c mice. Cell. Mol. Immunol. 2009. 6. 111-116.
- Bӧrner C., Warnick B., Smida M. et al. Mechanisms of opioid-mediated inhibition of human T cell receptor signaling. J. Immunl. 2011. 183. 882-889.
- Wang J., Barke R., Charboneau R. et al. Morphine negatively regulates interferon-gamma promoter activity in activated murine T cells through two distinct cyclic AMP-dependent pathways. J. Biol. Chem. 2003. 278. 37622-37631.
- Bӧrner C., Kraus J., Bedini A. et al. T-cell receptor/CD28-mediated activation of human T lymphocytes induces expression of functional µ-opioid receptors. Mol. Pharmacol. 2008. 74. 496-504.
- Sacerdote P. Opioid-induced immunosuppression. Curr. Opin. Support. Palliat. Care. 2008. 2. 14-18.
- Sjodahl R. Nonsteroidal anti-inflammatory drugs and the gastrointestinal tract. Extent, mode, and dose dependence of anticancer effects. Am. J. Med. 2001. 110(1A). 66-69.
- González-Pérez А., Luis A., Rodríguez G. Effects of non-steroidal anti- inflammatory drugs on cancer sites other than the colon and rectum: a meta-analysis. BMC Cancer. 2003. 3. 28. 124-134.
- Бережная Н.М., Чехун В.Ф. Иммунология злокачественного роста. Киев: Наукова думка, 2005. С. 125-128.
- Murphy K. Janeway’s Immunobiology. 8th ed. Garland Science. 2012.
- Kurosawa Sh., Kato M. Anesthetics, immune cells, and immune responses. J. Anesth. 2008. 22. 263-277
- Mizota T., Tsujikawa H., Shoda T. Dual modulation of the T-cell receptor-activated signal transduction pathway by morphine in human T lymphocytes. J. Anesth. 2013. 27. 80-87.
- Hashiguchi S., Morisaki H., Kotake Y., Takeda J. Effects of morphine and its metabolites on immune function in advanced cancer patients. J. Clin. Anesthesia. 2005. 17. 575-580.
- Munegowda M., Xua S., Freywaldb A. et al. CD4+ Th2 cells function alike effector Tr1 and Th1 cells through the deletion of a single cytokine IL-6 and IL-10 gene. Molecular. Immunology. 2012. 51. 143-149.
- Jiang J., Dingledine R. Prostaglandin receptor EP2 in the crosshairs of anti-inflammation, anti-cancer, and neuroprotection. Trends Pharmacol. Sci. 2013. 34(7). 413-423.
- Shakhar G., Ben-Eliyahu S. Potential prophylactic measures against postoperative immunosuppression: Could they reduce recurrence rates in oncological patients? Ann. Surg. Oncol. 2003. 10(8). 972-92.
- Page G.G., Ben-Eliyahu S. Indomethacin attenuates the immunosuppressive and tumor-promoting effects of surgery. J. Pain. 2002. 3. 301-8.
- Gutkin D., Shurin M. Clinical evaluation of systemic and local immune responses in cancer: time for integration. Cancer. Immunol. Immunother. 2014. 63(1). 45-57.
- Forget P., Collet V., Lavand’homme P., Kock de M. Does analgesia and condition influence immunity after surgery? Effects of fentanyl, ketamine and clonidine on natural killer activity at different ages. Eur. J. Anaesthesiol. 2010. 27. 233-240.
- Sacerdote P., Bianchi M., Gaspani L. et al. The Effects of Tramadol and Morphine on Immune Responses and Pain After Surgery in Cancer Patients. Anesthesia&Analgesia. 2000. 90(6). 1411-1414.
- Liu J.F., Zhang S.W., Jamieson G.G. et al. The effects of a COX-2 inhibitor meloxicam on squamous cell carcinoma of the esophagus in vivo. Int. J. Cancer. 2008. 122(7). 1639-44.
- Martin L.A., Davies G.L., Weigel M.T. et al. Pre-surgical study of the biological effects of the selective cyclo-oxygenase-2 inhibitor celecoxib in patients with primary breast cancer. Breast. Cancer. Res. Treat. 2010. 123(3). 829-36.
- Guo Y.C., Chang C.M., Hsu W.L. et al. Indomethacin inhibits cancer cell migration via attenuation of cellular calcium mobilization. Molecules. 2013. 18(6). 6584-96.
- Karnezis T., Shayan R., Caesar C. et al. VEGF-D promotes tumor metastasis by regulating prostaglandins produced by the collecting lymphatic endothelium. Cancer. Cell. 2012. 21(2). 181-95.
- Yoshinaka R., Shibata M.A., Morimoto J. et al. COX-2 inhibitor celecoxib suppresses tumor growth and lung metastasis of a murine mammary cancer. Anticancer. Res. 2006. 26(6B). 4245-54.
- Fisher J.C., Gander J.W., Haley M.J. et al. Inhibition of cyclo-oxygenase 2 reduces tumor metastasis and inflammatory signaling during blockade of vascular endothelial growth factor. Vascular. Cell. 2011. 3. 22
- Qadri S.S., Wang J.H., Coffey J.C. et al. Surgically induced accelerated local and distant tumor growth is significantly attenuated by selective COX-2 inhibition. Ann. Thorac. Surg. 2005. 79(3). 990-5.
- Tanaka T., Delong P.A., Amin K. et al. Treatment of lung cancer using clinically relevant oral doses of the cyclooxygenase-2 inhibitor rofecoxib: potential value as adjuvant therapy after surgery. Ann. Surg. 2005. 241(1). 168-78.
- Ren X.F., Li W.Z., Meng F.Y. et al. Differential effects of propofol and isoflurane on the activation of T-helper cells in lung cancer patients. Anaesthesia. 2010. 65(5). 478-82.
- Inada T., Kubo K., Shingu K. Possible link between cyclooxygenase-inhibiting and antitumor properties of propofol. J. Anesth. 2011. 25(4). 569-75.

/69.jpg)