Журнал «Актуальная инфектология» Том 8, №4, 2020
Вернуться к номеру
Аналіз частоти формування мутацій резистентності ВІЛ, асоційованих зі стійкістю до антиретровірусних препаратів
Авторы: Люльчук М.Г., Щербінська А.М., Кирпичова В.В.
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Актуальність. В Україні зростають масштаби охоплення ВІЛ-інфікованих осіб специфічною антиретровірусною терапією (АРТ). Необхідне запровадження постійного моніторингу за формуванням і поширенням штамів ВІЛ, резистентних до антиретровірусних препаратів (АРВП). Мета: проаналізувати вплив тривалості АРТ, віку й статі пацієнтів на частоту формування мутацій резистентності (МР) ВІЛ до АРВП різних класів. Матеріали та методи. Досліджували зразки плазми крові ВІЛ-інфікованих пацієнтів з вірусологічною неефективністю АРТ. Секвенування геному ВІЛ проводили на тест-системах ViroSeqTM Genotyping System v.2.1 (Celera Diagnostics, США) згідно з інструкцією виробника. Результати. Визначено, що вірогідно частіше (р ≤ 0,05) МР ВІЛ до АРВП виявлялися у ВІЛ-інфікованих чоловіків (59,7 %), ніж у жінок (40,3 %). Встановлено, що в 59,92 % випадків вірусологічна неефективність АРТ обумовлена формуванням МР ВІЛ хоча б до одного з АРВП. Серед МР ВІЛ до ненуклеозидних інгібіторів зворотної транскриптази найбільш поширеними були G190S (75,8 %), K101E (72,7 %), Y181C (68,1 %), K103N (38,8 %); серед МР до нуклеозидних інгібіторів зворотної транскриптази переважали: M184V (69 %), K65R (61 %), D67N (20 %). МР ВІЛ до інгібітору протеази зустрічалися в поодиноких випадках. Висновки. Показано, що тривалість АРТ і вік пацієнтів суттєвого впливу на стійкість ВІЛ до АРВП не мали. Вирішальне значення мав генетичний бар’єр АРВП: на тлі прийому препаратів з низьким генетичним бар’єром частота формування МР ВІЛ дорівнювала 5,3 %; прийом препаратів з високим генетичним бар’єром супроводжувався формуванням МР ВІЛ значно рідше — в 1,1 % випадків. Доведено, що біоповедінкові особливості пацієнтів-чоловіків є фактором, що асоціюється з підвищеним ризиком формування МР ВІЛ до АРВП.
Актуальность. В Украине проводится широкомасштабная антиретровирусная терапия (АРТ) больных ВИЧ-инфекцией. Необходимо постоянное наблюдение за развитием устойчивости ВИЧ к антиретровирусным препаратам (АРВП). Цель: проанализировать влияние продолжительности АРТ, возраста и пола пациентов на частоту формирования мутаций резистентности (МР) ВИЧ к АРВП разных классов. Материал и методы. Исследовали образцы плазмы крови ВИЧ-инфицированных пациентов с вирусологической неэффективностью АРТ. Секвенирование генома ВИЧ проводили на тест-системах ViroSeqTM Genotyping System v.2.1 (Celera Diagnostics, США) согласно инструкции производителя. Результаты. Достоверно чаще (р ≤ 0,05) МР ВИЧ к АРВП выявлялись у ВИЧ-инфицированных мужчин (59,70 %), чем у женщин (40,3 %). Установлено, что в 59,9 % случаев вирусологическая неэффективность АРТ была обусловлена формированием МР ВИЧ хотя бы к одному из АРВП. Среди МР ВИЧ к ненуклеозидным ингибиторам обратной транскриптазы наиболее распространенными были G190S (75,8 %); K101E (72,7%); Y181C (68,1 %); K103N (38,8 %); среди МР к нуклеозидным ингибиторам обратной транскриптазы преобладали: M184V (69 %), K65R (61 %), D67N (20 %). МР ВИЧ к ингибитору протеазы встречались редко. Выводы. Показано, что продолжительность АРТ и возраст пациентов существенного влияния на устойчивость ВИЧ к АРВП не оказывали. Решающее значение имел генетический барьер АРВП: на фоне приема препаратов с низким генетическим барьером частота выявления МР ВИЧ составляла 5,3 %; прием препаратов с высоким генетическим барьером сопровождался формированием МР ВИЧ значительно реже — в 1,1 % случаев. Доказано, что биоповеденческие особенности пациентов-мужчин являются фактором, ассоциирующимся с повышенным риском формирования МР ВИЧ к АРВП.
Background. The large-scale antiretroviral therapy (ART) for patients with human immunodeficiency virus (HIV) infection is carried out in Ukraine. Continuous monitoring of antiretroviral drugs (ARDs) resistance development is needed. Purpose: to analyze the influence of ART duration, the age and gender of patients on the frequency of the formation of HIV mutations associated with resistance to different classes of ARDs. Material and methods. Blood plasma samples of HIV-infected patients with antiretroviral treatment failure were analyzed. Sequencing of the HIV genome was performed using the ViroSeqTM Genotyping System v.2.1 test systems (Celera Diagnostics, USA) according to the manufacturer instructions. Results. Significantly more often (p ≤ 0.05), HIV drug resistance mutations (DRMs) were detected in HIV-infected men (59.7 %) than in women (40.3 %). It was found that in 59.92 % of cases, the causes of virologic treatment failure were mutations of HIV resistance to at least one antiretroviral drug. The most common nucleoside reverse transcriptase inhibitor mutations were G190S (75.8 %), K101E (72.7 %), Y181C (68.1 %), K103N (38.8 %); and the most common non-nucleoside reverse transcriptase inhibitor mutations were M184V (69 %), K65R (61 %) and D67N (20 %). HIV DRMs associated with protease inhibitor were rare. Conclusions. It was shown that the duration of ART and the age of the patients had no significant effect on HIV resistance to ARDs. The genetic barrier of ARDs was crucial. Against the background of taking drugs with a low genetic barrier, the frequency of HIV DRMs was 5.3 %; administration of drugs with a high genetic barrier was accompanied by the formation of HIV DRMs much less often — in 1.1 % of cases. The bio-behavioral features of male patients have been proven to be a factor associated with risk of HIV DRMs.
вірус імунодефіциту людини; мутації резистентності ВІЛ; антиретровірусна терапія; ВІЛ-інфекція
вирус иммунодефицита человека; мутации резистентности ВИЧ; антиретровирусная терапия; ВИЧ-инфекция
human immunodeficiency virus; HIV drug resistance mutations; antiretroviral therapy; HIV-infection
Вступ
Проблема ВІЛ-інфекції все ще залишається пріоритетною для країн Східної Європи, у тому числі для України. Аналіз епідемічної ситуації з ВІЛ/СНІДу свідчить про те, що впродовж останніх 5 років в Україні спостерігається поступове зниження кількості виявлених ВІЛ-позитивних осіб — з 19 273 в 2014 р. до 15 749 у 2018 р.; дещо зменшилось число людей, які захворіли на СНІД, — з 9844 до 8839 відповідно, проте кількість смертей від хвороб, обумовлених СНІДом, не зазнала суттєвих змін — 3426 у 2014 р. і 3448 у 2018 р. Згідно з прийнятою ЮНЕЙДС (Joint United Nations Programme on HIV/AIDS UNAIDS — Об’єднана програма ООН із ВІЛ/СНІДу) стратегією «Прискорення: припинення епідемії СНІДу до 2030 року» [1], основними завданнями якої в досягненні зазначеної мети стало виявлення й своєчасне лікування хворих на ВІЛ-інфекцію, в Україні антиретровірусну терапію (АРТ) отримує понад 100 000 хворих на ВІЛ-інфекцію. Ефективність лікування обумовлена насамперед пригніченням реплікації ВІЛ в організмі хворого й визначається рівнем вірусного навантаження в крові [2, 3]. Відомо, що ВІЛ належить до вірусів із високою мутагенною активністю, що швидко проявляється під тиском антиретровірусних препаратів (АРВП) унаслідок появи мутацій резистентності в гені протеази й зворотної транскриптази, що призводить до зниження чутливості вірусу до АРВП [4–7]. Накопичення мутацій резистентності в процесі АРТ може призвести до високого рівня стійкості ВІЛ до препаратів і становити терапевтичну й епідеміологічну небезпеку, а тому потребує постійного моніторингу за появою і циркуляцією резистентних штамів ВІЛ [8–11].
Метою роботи було провести аналіз частоти формування мутацій резистентності ВІЛ, асоційованих зі стійкістю до АРВП, в умовах масштабної антиретровірусної терапії в Україні.
Матеріали та методи
Секвенування геному ВІЛ проводили з використанням тест-системи ViroSeqTM Genoty–ping System v.2.1 (фірма Abbott, США) згідно з інструкцією виробника [12, 13]. Аналіз мутацій і визначення їх зв’язку з розвитком резистентності досліджували з використанням кількох різних алгоритмів: GRADE — 04/2007, ANRS — 07/2006, HIVDB_4.3.0.2GA_V7.1.1 (http://www.hiv_ade.de/grade/deployed/grade.pl?program=hivalg) і програмного забезпечення ViroSeq Genotyping System Software v.2.6. Для цього отримані послідовності порівнювали з референсним штамом ВІЛ-1 HXB-2 [14].
Результати та обговорення
Нами був проведений ретроспективний аналіз результатів генотипування ВІЛ, отриманих при тестуванні зразків крові ВІЛ-інфікованих пацієнтів із вірусологічною неефективністю АРТ. У групу дослідження увійшла 801 особа — ВІЛ-інфіковані пацієнти, які протягом 2012–2014 років перебували під диспансерним наглядом у регіональних центрах профілактики й боротьби зі СНІДом і клініці ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», отримували АРТ і мали рівень вірусного навантаження ВІЛ понад 2000 РНК-копій/мл (тобто мала місце вірусологічна неефективність лікування). Зазначену групу хворих обстежили на наявність МР ВІЛ до АРВП. Отримані дані показали, що з 801 зразка крові ампліфікацію пройшли 656, з них у 176 осіб (21,97 ± 1,46 %) жодної МР ВІЛ до АРВП не виявлено, це означало, що рівень вірусного навантаження ВІЛ у пацієнтів зріс унаслідок порушення ними режиму прийому АРТ. Ще в 145 (18,10 ± 1,36 %) зразках сиквенси отримати не вдалося, оскільки результат тестування був негативним у полімеразній ланцюговій реакції, що може мати місце, коли рівень вірусного навантаження ВІЛ у зразку є меншим, ніж 2000 РНК-копій/мл, або зразок крові невідповідним чином відбирався, оброблявся чи зберігався. У решті зразків (59,92 ± 1,73 %) виявлено мутації резистентності ВІЛ до хоча б одного з антиретровірусних препаратів.
Історії хвороб 474 пацієнтів із мутаціями резистентності ВІЛ було проаналізовано за статтю та віком. Виявилося, що більшість (437 осіб — 92,19 ± 1,23 %) становили пацієнти віком 25–49 років. Привернув увагу той факт, що вірогідно більше (р ≤ 0,05) було чоловіків з МР ВІЛ (59,7 ± 2,33%), ніж жінок (40,3 ± 2,33 %). Пацієнти віком понад 50 років становили значно меншу групу — 31 особа (6,54 ± 1,13 %), з них чоловіків 17 (54,8 %); жінок — 14 (45,2 %). Пацієнтів віком 18–24 років було тільки 6 (1,26 ± 0,51 %), із них 5 жінок. За літературними даними відомо, що чоловіки, які живуть із ВІЛ, є більш вразливими, ніж жінки, не тільки щодо захворювання на СНІД і смерті від СНІДу, але й щодо формування МР ВІЛ на тлі АРТ.
Усі пацієнти знаходилися на схемах АРТ, які складалися з 2 нуклеозидних інгібіторів зворотної транскриптази (НІЗТ) та 1 ненуклеозидного інгібітору зворотної транскриптази (ННІЗТ) або 2 НІЗТ та одного інгібітору протеази (ІП).
Тобто схеми АРТ мали однакову НІЗТ-основу, проте відрізнялися за так званими ключовими компонентами (ННІЗТ або ІП). Як ННІЗТ застосовувалися ефавіренз (EFV) або невірапін (NVP) — препарати першого покоління, що характеризуються низьким генетичним бар’єром (ГБ); ІП було представлено препаратом Lpv/rtv — із високим ГБ.
Генетичний бар’єр антиретровірусних препаратів, визначений як число вірусних мутацій ВІЛ, необхідних для подолання селективного тиску лікарського засобу, є важливою характеристикою різних класів АРВП. Відомо, що препарати класу ІП мають високий генетичний бар’єр, тобто вимагають накопичення декількох мутацій резистентності МР ВІЛ, перш ніж вірус стане нечутливим до АРВП [15–17]. І навпаки, ненуклеозидні інгібітори зворотної транскриптази мають низький генетичний бар’єр, і розвиток стійкості ВІЛ може відбутися дуже швидко, за умови формування лише однієї МР ВІЛ.
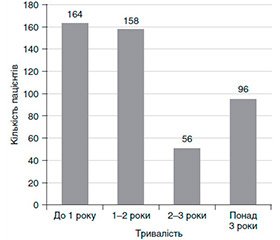
За тривалістю прийому АРТ усі пацієнти були поділені на 4 групи (рис. 1):
1) пацієнти, які отримували АРТ протягом від 6 місяців до 1 року, — 164 (34,59 ± 2,18 %) особи;
2) від 1 до 2 років — 158 (33,33 ± 2,16 %) осіб;
3) від 2 до 3 років — 56 (11,81 ± 1,48 %) осіб;
4) понад 3 роки — 96 (20,25 ± 1,84 %) осіб.
У кожній групі більшість пацієнтів мали в анамнезі дані щодо лікування за схемами з ННІЗТ: у 1-й групі — це 95,3 %; у другій — 91,5%; у 3-й — 81,8 %; у 4-й — 71,0 % (загалом 86,5%). Зі збільшенням тривалості прийому АРТ кількість схем із ННІЗТ дещо знижувалася за рахунок збільшення частки схем з ІП (рис. 2).
У кожній з груп значний відсоток випадків призначення схем з ННІЗТ супроводжувався формуванням мутацій резистентності вірусу до вказаного класу препаратів (рис. 3). Так, навіть при нетривалому лікуванні (до 1 року) у пацієнтів з вірусологічною неефективністю лікування МР ВІЛ до ННІЗТ виявлено в 100 % випадків (у всіх 162 пацієнтів); при тривалості АРТ до 2 років — у 98,7 % випадків (149 з 151); до 3 років — в 96,3 % (у 52 з 54); понад 3 роки — у 94,6 % (у 88 з 93). Загалом із 460 випадків вірусологічної неефективності АРТ на тлі прийому препаратів класу ННІЗТ тільки в 9 (1,96 %) не знайдено МР ВІЛ. Детальний аналіз цих 9 випадків показав, що майже всі пацієнти (8 з 9) мали в анамнезі неодноразову заміну схем терапії і на момент тестування вже тривалий час (від 11 місяців до 8 років) не приймали ННІЗТ, а знаходилися на схемах з ІП.
Відомим фактом є те, що після відміни АРВП мутантні штами ВІЛ можуть бути витіснені так званим диким штамом і нараховувати в популяції не більше ніж 20 %, що проблематично визначити існуючими тест-системами. Саме це, як правило, стає причиною відсутності МР ВІЛ до ННІЗТ у зразках крові пацієнтів, які протягом тривалого часу вже не прий–мають АРВП вказаного класу.
Що стосується ІП, то на тлі нетривалого їх прийому формування МР ВІЛ зареєстровано в поодиноких випадках (від 1 до 4). Зі збільшенням тривалості терапії понад 3 роки кількість МР до ІП зросла до 9 випадків (23,68 ± 6,89 %) із 38.
Слід відзначити, що 316 (66,66 ± 2,16 %) пацієнтів мали в анамнезі тільки одну схему терапії, ще 128 пацієнтів (27,0 ± 2,03 %) схему терапії змінювали від 2 до 6 разів. Невелика кількість пацієнтів мали перерви в лікуванні. Так, 6 (1,26 ± 0,51 %) осіб розпочали АРТ, потім перервали самостійно терапію і знову повернулися на ту саму схему; 12 (2,53 ± 0,72 %) осіб мали дві схеми АРТ в анамнезі й перерву між схемами; ще в 6 (1,26 ± 0,51 %) пацієнтів зафіксовано три схеми в анамнезі та перерву в лікуванні, і ще в 6 (1,26 ± 0,51 %) випадках зареєстровано 4 або 5 схем в анамнезі та декілька перерв у лікуванні.
Ключовим компонентом більшості схем АРТ були препарати, що належать до класу ННІЗТ. Вказані препарати мають відносно низьку вартість, тому більшість пацієнтів починають АРТ саме з них. Частота випадків формування МР ВІЛ до ННІЗТ була високою (у середньому в 98,04 ± 0,64 % випадків) і не залежала від кількості схем терапії в анамнезі пацієнта. Що стосується іншого класу АРВП, то частота випадків формування МР ВІЛ на тлі прийому ІП була відносно низькою (у середньому в 20,83 ± 4,79 % випадків) і також не залежала від кількості замін схем лікування пацієнта.
Встановлено, що вірусологічна неефективність АРТ у 59,92 ± 1,73 % випадків обумовлена формуванням мутацій резистентності ВІЛ хоча б до одного з антиретровірусних препаратів.
Серед мутацій резистентності ВІЛ до ННІЗТ найбільш поширеними були G190S (75,8 %); K101E (72,7 %); Y181C (68,1 %); K103N (38,8 %). Серед МР до НІЗТ переважали: M184V (69 %), K65R (61 %), D67N (20 %), T215F (18 %), K70R (17 %). Серед мутацій резистентності ВІЛ до ІП у поодиноких випадках зустрічалися: M46I (n = 2); V82A/V (n = 1); I54V (n = 1).
Нами визначено, що МР до ННІЗТ стають причиною вірусологічної неефективності лікування в 5,3 % випадків; МР до ІП — в 1,1 % випадків.
Висновки
Встановлено, що тривалість АРТ і кількість замін у схемах лікування ВІЛ-інфікованих пацієнтів суттєвого впливу на частоту формування мутацій резистентності ВІЛ не мали. Вагомим фактором залишався генетичний бар’єр АРВП: на тлі прийому препаратів класу ННІЗТ з низьким генетичним бар’єром частота формування МР ВІЛ становила 5,3 %. Прийом препаратів класу ІП з високим генетичним бар’єром супроводжувався формуванням МР ВІЛ значно рідше — в 1,1 % випадків. Отримані дані обґрунтовують необхідність системного моніторингу за формуванням мутацій резистентності в популяції ВІЛ, що циркулює в Україні.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
- 90-90-90 An ambitious treatment target to help end the AIDS epidemic. URL: http://www.unaids.org/sites/default/files/media_asset/90-90-90_en_0.pdf.
- Kukoyi O., Renner L., Powell J., Barry O., Prin M., Kusah J. et al. Viral load monitoring and antiretroviral treatment outcomes in a pediatric HIV cohort in Ghana. BMC Infect. Dis. 2016. 16(1).
- Dat V.Q., Duong B.D., Nhan D.T., Hai N.H., Anh N.T.L., Thu H.H.K. et al. Viral load suppression and acquired HIV drug resistance in adults receiving antiretroviral therapy in Viet Nam: results from a nationally representative survey. West Pacific Surveill Response J. 2018 Sep 30. 9(3). 16-24. URL: https://ojs.wpro.who.int/ojs/index.php/wpsar/article/view/596/835.
- Nikolenko G.N., Delviks-Frankenberry K.A., Pathak V.K. A Novel Molecular Mechanism of Dual Resistance to Nucleoside and Nonnucleoside Reverse Transcriptase Inhibitors. J. Virol. 2010 May 15. 84(10). 5238-49. URL: https://jvi.asm.org/content/84/10/5238.
- Sluis-Cremer N., Tachedjian G. Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors. Virus Res. 2008 Jun. 134 (1–2). 147-56. URL: https://linkinghub.elsevier.com/retrieve/pii/S0168170208000075.
- Останкова Ю.В., Щемелев А.Н., Зуева Е.Б., Чурина М.А., Валутите Д.Э., Семенов А.В. Молекулярная эпидемиология и фармакорезистентность ВИЧ у пациентов с вирусологической неэффективностью антиретровирусной терапии Архангельской области. ВИЧ-инфекция и иммуносупрессии. 2020. 11(4). 79-90. URL: https://hiv.bmoc-spb.ru/jour/article/view/491.
- Чуринa M.A., Oстанкова Ю.В., Семенов А.В. и др. Молекулярная эпидемиология и фармакорезистентность ВИЧ-1 у пациентов с неэффективностью АРВТ в Великом Новгороде. ВИЧ-инфекция и иммуносупрессии. 2017. 9(1). 82-92. URL: http://hiv.bmoc-spb.ru/jour/article/view/242.
- Iyidogan P., Anderson K.S. Current perspectives on HIV-1 antiretroviral drug resistance. Viruses. 2014. 6(10). 4095-139.
- Paton N.I., Kityo C., Hoppe A., Reid A., Kambugu A., Lugemwa A. et al. Assessment of second-line antiretroviral regimens for HIV therapy in Africa. N. Engl. J. Med. 2014. 371(3). 234-47.
- Thao V.P., Quang V.M., Day J.N., Chinh N.T., Shikuma C.M., Farrar J. et al. High prevalence of PI resistance in patients failing second-line ART in Vietnam. J. Antimicrob. Chemother. 2016. 71(3). 762-74.
- Lin B., Sun X., Su S., Lv C., Zhang X., Lin L. et al. HIV drug resistance in HIV positive individuals under antiretroviral treatment in Shandong Province, China. PLoS One. 2017. 12(7). 1-6.
- Cunningham S., Ank B., Lewis D., Lu W., Wantman M., Dileanis J. et al. Performance of the Applied Biosystems ViroSeq Human Immunodeficiency Virus Type 1 (HIV-1) Genotyping System for Sequence-Based Analysis of HIV-1 in Pediatric Plasma Samples. J. Clin. Microbiol. 2001 Apr 1. 39(4). 1254-7. URL: http://jcm.asm.org/cgi/doi/10.1128/JCM.39.4.1254-1257.2001.
- Pineda-Peña A.C., Faria N.R., Imbrechts S., Libin P., Abecasis A.B., Deforche K. et al. Automated subtyping of HIV-1 genetic sequences for clinical and surveillance purposes: Performance evaluation of the new REGA version 3 and seven other tools. Infect Genet Evol. 2013. 19(100). 337-48. URL: http://dx.doi.org/10.1016/j.meegid.2013.04.032.
- Tang M.W., Liu T.F., Shafer R.W. The HIVdb system for HIV-1 genotypic resistance interpretation. Intervirology. 2012. 55(2). 98-101.
- Ssempijja V., Nakigozi G., Chang L., Gray R., Wa–wer M., Ndyanabo A. et al. Rates of switching to second-line antiretroviral therapy and impact of delayed switching on immunolo–gic, virologic, and mortality outcomes among HIV-infected adults with virologic failure in Rakai, Uganda. BMC Infect Dis. 2017. 17(1). 1-10.
- Gupta R.K., Gregson J., Parkin N., Haile-Selassie H., Tanuri A., Andrade Forero L. et al. HIV-1 drug resistance before initiation or re-initiation of first-line antiretroviral therapy in low-income and middle-income countries: a systematic review and meta-regression analysis. The Lancet Infectious Diseases. 2018. Vol. 18. Р. 346-55.
- Günthard H.F., Calvez V., Paredes R., Pillay D., Shafer R.W., Wensing A.M. et al. Human Immunodeficiency Virus Drug Resistance: 2018 Recommendations of the International Antiviral Society — USA Panel. Clin. Infect. Dis. 2019 Jan 7. 68(2). 177-87. URL: https://academic.oup.com/cid/article/68/2/177/ 5055715.

/13-1.jpg)
/13-2.jpg)