Вступ
Україна є державою, населення якої постраждало внаслідок аварії на Чорнобильській атомній електростанції (ЧАЕС) 26 квітня 1986 року. Значна кількість радіонуклідів, що потрапили в навколишнє середовище, спричинила зовнішнє та внутрішнє опромінення організму багатьох людей, визначила формування певних доз опромінення й розвиток низки патологічних станів [1].
Новим аспектом впливу іонізуючої радіації на організм людини є ураження прищитоподібних залоз (ПЩПЗ) в поєднанні з дисбалансом у системі вітаміну-гормона D, а також подальший розвиток вторинного гіперпаратиреозу у віддалені терміни опромінення (понад 20–30 років) [2].
При аварії на ЧАЕС основними дозоутворюючими ізотопами були йод і цезій. Раніше було встановлено, що поглинуті ізотопи радіоактивного йоду, цезію та стронцію, що є тропними до клітин ПЩПЗ, або опромінення ділянки шиї сприяють їх дисфункції [3–9].
Прищитоподібні залози — головні патофізіологічні регулятори кальцій-фосфорного обміну, регулюють і впливають на нирки, кістки, серцево-судинну, нервову та інші системи. При цьому порушення стану ПЩПЗ все ще не настільки важливі та очевидні для багатьох лікарів і фахівців, оскільки ці питання лише нещодавно потрапили до поля зору науковців і клініцистів. Сьогодні вивчаються ці механізми, розробляються діагностичні та лікувальні підходи, особливо до гіперпаратиреозу й гіперплазії ПЩПЗ.
Ультразвукове дослідження (УЗД, сонографія) — сучасний діагностичний неінвазивний тест, що використовує високочастотні звукові хвилі для візуалізації тканин та органів у реальному часі. Воно є високоінформативним методом оцінки стану ПЩПЗ при їх гіперплазії, гіперпаратиреозах, аденомах та раку, що дозволяє своєчасно виявити структурні зміни, визначати ступінь тяжкості їх збільшення, висувати припущення щодо морфологічного варіанта змін. Виникає все більше наукових аргументів на користь виконання УЗД ПЩПЗ для клінічних потреб, у тому числі як скринінг та моніторинг, за умов обізнаності медичного персоналу [10, 11].
У відділі радіаційної ендокринології та клініці Державної установи «Національний науковий центр радіаційної медицини Національної академії медичних наук України» апробовано та впроваджено такі підходи з 2015 р., а ультразвуковий скринінг ПЩПЗ проводиться переважній більшості пацієнтів разом із УЗД щитоподібної залози. Гіперплазія ПЩПЗ виявляється при УЗД, за даними наших досліджень, у 5–25 % дорослих осіб та у 25–70 % дітей [12]. Раніше продемонстровано, що одночасне використання УЗД і сцинтиграфії підвищує чутливість діагностики до рівня 81–98 % [10, 13].
Донедавна візуалізація змінених ПЩПЗ проводилась лише з метою передопераційної оцінки локалізації залоз при первинному або третинному гіперпаратиреозі, однак на сьогодні методика дозволяє отримувати додаткову кількісну та якісну інформацію про стан цих залоз з метою вибору адекватного методу лікування. Дослідження в динаміці (динамічне спостереження) важливе для контролю ефективності медикаментозного або хірургічного лікування, для обрання тактики лікування, в тому числі осіб, опромінених внаслідок аварії на Чорнобильській АЕС. Ультразвуковий метод визнається дієвим методом вибору з огляду на його інформативність, неінвазивність, нешкідливість і доступність.
Мета дослідження — встановити стан прищитоподібних залоз в осіб, які зазнали опромінення внаслідок аварії на ЧАЕС, розробити методологію клінічної оцінки ультразвукового дослідження цих залоз з урахуванням клінічних особливостей.
Матеріали та методи
Дослідження є результатом клінічного спостереження протягом шести років стану ПЩПЗ у понад 6000 пацієнтів, опромінених внаслідок аварії на ЧАЕС, або осіб з групи контролю, яким проводили УЗД ПЩПЗ в стаціонарних або амбулаторних умовах (ДУ «Національний науковий центр радіаційної медицини НАМН України»). При виявленні структурних змін оцінювали гормонально-метаболічні показники (паратгормон, кальцій загальний/кальцій іонізований, 25(OH)D).
Незважаючи на те, що зараз УЗД ПЩПЗ не стандартизовано, відсутні єдині клініко-діагностичні підходи, нами проведено вивчення ультразвукових характеристик і клінічних особливостей структурних змін. Це дозволило підвищити ефективність візуалізації ПЩПЗ та вдосконалити протокол УЗД. Раніше нами вже була опрацьована методика скринінгу та моніторингу ультразвукового дослідження ПЩПЗ [12].
Ультразвукове дослідження щитоподібної залози (ЩПЗ) проводили на апараті Nemio XG SSA-58A (Японія), з 2019 р. — на апараті VINNO E10 (КНР), у режимі реального часу з використанням лінійного мультичастотного датчика 7,5–15 МГц.
В окремому дослідженні [12] в умовах стаціонару ДУ «Національний науковий центр радіаційної медицини НАМН України» було обстежено 1348 осіб, опромінених внаслідок аварії на ЧАЕС, через 27–32 роки після дії іонізуючого випромінювання (учасники ліквідації наслідків аварії на ЧАЕС 1986–1990 років; евакуйовані з 30-кілометрової зони опромінення 26.04–05.05.1986 р.; опромінені внутрішньоутробно, народжені від 26.04.1986 до лютого 1987 р.).
Критеріями включення в дослідження були всі пацієнти, які проходили обстеження в клініці в умовах стаціонару або амбулаторно, незалежно від супутньої патології або її відсутності, яким проводилось УЗД щитоподібної залози та ПЩПЗ.
Гіперплазію ПЩПЗ (Міжнародна класифікація хвороб 10-го перегляду (МКХ-10): Е21.0 та Е21.5) виявляли за допомогою УЗД на загальних принципах. Відомі окремі публікації та розрізнені думки щодо УЗД ПЩПЗ, зокрема топічної діагностики, розмірів, еволюції патологічних змін. У пересічного населення гіперплазія ПЩПЗ зазвичай виявляється при УЗД у 5–7 % осіб дорослого віку. Ми приймали за нормальні розміри ПЩПЗ до 5 мм, за формою «рисового зернятка», за ехогенністю — збіг з тканиною щитоподібної залози. За різними джерелами про нормальні розміри ПЩПЗ та патогістологічними дослідженнями, ПЩПЗ — епітеліальні тільця розмірами до 1,5–5 мм, масою 0,3–0,5 г.
Гіперпаратиреоз (МКХ-10: Е21) є клініко-лабораторним станом, що діагностується за наявності підвищення рівня паратгормону у сироватці крові понад норму (10–65 пг/мл), а гіпопаратиреоз (МКХ-10: Е20) — при виявленні низького рівня. За клінічними проявами та лабораторними маркерами гіперпаратиреоз поділяють на первинний, вторинний і третинний. Первинний гіперпаратиреоз (МКХ-10: Е21.0) діагностують при виявленні підвищеної концентрації паратгормону та іонізованого кальцію у сироватці крові при нормальній концентрації 25(OH)D (≥ 75 нмоль/л). Найбільш частим варіантом гіперпаратиреозу є вторинний (МКХ-10: Е21.1), що діагностується при підвищенні рівня паратгормону у сироватці крові на тлі нормального кальцію (1,05–1,35 ммоль/л) та низького вмісту 25(OH)D. Третинний гіперпаратиреоз (МКХ-10: Е21.2) є наслідком своєчасно неусуненого дефіциту/нестачі вітаміну D та невилікуваного вторинного гіперпаратиреозу. За клінічними проявами й лабораторними маркерами збігається з первинним, але при низьких концентраціях 25(OH)D у сироватці крові.
Гормональні дослідження проводили у сертифікованих лабораторіях. Дослідження вмісту паратгормону, 25(ОН)D, тиреотропного гормона у сироватці крові проводили за допомогою імунохімічного аналізатора ADVIA Centaur XP Architect i2000 SR компанії Siemens (Німеччина), LABLINE-022 компанії LABLINE (Австрія). Іонізований кальцій у крові визначали на аналізаторі електролітів E-Lyte-5 PLUS.
Оскільки в більшості випадків гіперплазія ПЩПЗ і гіперпаратиреоз мають безсимптомний перебіг (за класичними уявленнями), є суб’єктивними ознаками, ми не досліджували скарги пацієнтів.
Дослідження проведені з дотриманням основних біоетичних норм і вимог Гельсінської декларації, прийнятої Генеральною асамблеєю Всесвітньої медичної асоціації, Конвенції Ради Європи про права людини та біомедицину (1977 р.), відповідного положення Всесвітньої організації охорони здоров’я, Міжнародної ради медичних наукових товариств, Міжнародного кодексу медичної етики (1983 р.) та Наказу МОЗ України № 690 від 23.09.2009 р.
Етична експертиза
Проведення дослідження було схвалено локальним науковим етичним комітетом Державної установи «Національний науковий центр радіаційної медицини Національної академії медичних наук України», м. Київ, Україна (протокол № 2 від 20.04.2019 р.). Кожний учасник отримував докладну інформацію щодо проведеного дослідження та давав письмову інформовану згоду на участь.
Статистичну обробку даних здійснювали за допомогою програми Statistica 6 з визначенням параметричних і непараметричних критеріїв (χ2Ятса), за допомогою середніх значень М ± m, при вірогідних значеннях p ≤ 0,05. Використовували програми Microsoft Exсel для Windows, SPSS v.15 для Windows.
Результати
Через 27–32 роки після опромінення нами виявлена висока частота гіперплазій ПЩПЗ в осіб, опромінених внаслідок аварії на ЧАЕС (рис. 1), перш за все в евакуйованих з 30-кілометрової зони відчуження (71,4 %; χ2Ятса = 24,1; р = 0) та мешканців радіоактивно забруднених територій (41,7 %; χ2Ятса = 6,45; р ≤ 0,01), без первинного гіперпаратиреозу [12].
На сьогодні УЗД ПЩПЗ залишається нестандартизованим методом, оскільки незначна кількість фахівців є обізнаними, вміють відокремлювати тканини ПЩПЗ від ЩПЗ, відсутні єдині міжнародні клініко-діагностичні підходи. Тому нами проведено декілька еволюційних досліджень, що дозволили підвищити ефективність візуалізації ПЩПЗ, диференціювати їх від тканини ЩПЗ і вдосконалити бланк протоколу з УЗД.
При скануванні ПЩПЗ використовують датчики частотою 10–15 МГц, зазвичай мультичастотні, враховують такі стандартні ультразвукові клінічні характеристики:
— локалізація (верхні, нижні, атипове розташування);
— кількість;
— розмір/об’єм;
— контур;
— однорідність/неоднорідність;
— ехогенність;
— васкуляризація/кровообіг.
Важливо зазначити, що нормальні незмінені ПЩПЗ, за умов відсутності напруження у системі кальцій-фосфорного обміну і вітаміну-гормона D, за структурою та ехогенністю повністю співпадають з тканиною щитоподібної залози, тому не візуалізуються при проведенні УЗД, хоча є наявними у пацієнтів (рис. 2а).
Розташування
Усі ПЩПЗ можуть бути локалізовані у типовому положенні впритул до щитоподібної залози, а іноді можуть розташовуватися і будь-де (шия, середостіння, поруч з хребтом тощо). Частіше ПЩПЗ знаходяться поруч за капсулою щитоподібної залози на її задній поверхні, дві — на верхньому полюсі та дві — на нижньому (біля перешийку/трахеї, медіально), хоча можуть деколи розташовуватися всередині щитоподібної залози (виглядають як вузловий зоб).
Верхні ПЩПЗ часто розташовуються по задній стінці капсули часток щитоподібної залози, іноді на деякому віддаленні (рис. 3). ПЩПЗ розвиваються в ембріоні із 3–4 зябрових кишень, можуть бути розташовані атипово — ектопія. Існує дуже багато можливих місць розташування цих залоз — вони можуть також знаходитись у вилочковій залозі, поруч з основним судинно-нервовим пучком шиї, за стравоходом, на передній поверхні хребта. Виняткова варіабельність розташування є важливою особливістю ПЩПЗ, яку зобов’язані враховувати лікарі у топічній діагностиці та хірурги при плануванні втручань.
/36.jpg)
Нижні ПЩПЗ у нормі розташовуються на рівні від перешийку до полюсу частки щитоподібної залози. Локалізація нижніх ПЩПЗ дуже варіабельна, однак найбільш часто вони візуалізуються біля нижніх полюсів щитоподібної залози. Збільшені ПЩПЗ можуть бути діагностовані нижче, зокрема у трахеоезофагеальному каналі (ектопія у 3–5 % випадків). При гіперплазії нижні ПЩПЗ можуть виявлятися у тканині щитоподібної залози (3–10 %) або у тимусі (рис. 4, 5).
ПЩПЗ оточені пухкою клітковиною ложа щитоподібної залози.
Кількість
Зазвичай у людини є чотири ПЩПЗ — по дві з кожної сторони щитоподібної залози (80 % випадків): дві верхні розташовані, як правило, на межі між верхньою і середньою третиною частки щитоподібної залози; дві нижні знаходяться біля нижнього полюсу частки щитоподібної залози, однак у 3–5 % [6], а за нашими даними — у 10 % пацієнтів може бути від однієї до 5–12 штук (рис. 6). Верхня пара ПЩПЗ зазвичай розташована поза капсулою щитоподібної залози на рівні перснеподібного хряща гортані (за середніми сегментами щитоподібної залози) [3].
За даними [4], приблизно у 80–90 % випадків є 4 залози, у 5–10 % осіб визначається 5 залоз, а у 5 % випадків — 3 залози. Менш ніж у 5 % обстежуваних виявляються понад 5 ПЩПЗ.
Розмір
Нормальні гістологічно незмінені ПЩПЗ мають розмір від 3 до 6 міліметрів та масу близько 30–40 мг. Однак вважається, що незмінені ПЩПЗ неможливо відокремити від тканини щитоподібної залози за розмірами, структурою і ехогенністю — вони наявні, але не візуалізуються. Тобто в разі, коли ПЩПЗ виявляються при проведенні УЗД — вони є зміненими, тільки тоді вони ідентифікуються та вдається виміряти їх розмір/об’єм.
Єдиної думки щодо нормальних розмірів ПЩПЗ серед дослідників не існує, але наявні окремі думки деяких експертів. Більшість фахівців вважають за нормальні розміри ПЩПЗ до 5 або до 8 мм. Хоча не існує надійного зв’язку між їх розміром і функційною спроможністю. Малі за розміром та незмінені ПЩПЗ (3–5 мм) можуть секретувати багато паратгормону, а великі неоднорідні — мати нормальну функцію.
Результати наших наукових досліджень і клінічних спостережень у дорослих і дітей протягом понад 6 років свідчать, що:
— у нормі ПЩПЗ не візуалізуються;
— виявлення ПЩПЗ слід розцінювати як їх гіперплазію;
— не існує прямої залежності між розміром ПЩПЗ та їх функціональним станом (малі (3–5 мм) можуть бути причиною гіперпаратиреозу, а великі (понад 15 мм) — нормально функціонувати);
— у дітей і підлітків напруження в системі кальцій-фосфорного обміну виявляється частіше при розмірі ПЩПЗ від 4 мм.
Умовно розміри ПЩПЗ, що визначаються при УЗД, можна розподілити:
— на малі — до 5 мм включно;
— середні — 5,1–8 мм;
— великі — 8,1 мм та більше.
Ехогенність
У нормі ехогенність ПЩПЗ зазвичай співпадає з ехогенністю ЩПЗ та оточуючих тканин (рис. 2а, 7а, 7б). При розвитку хронічного автоімунного тиреоїдиту знижується ехогенність щитоподібної залози та ПЩПЗ відповідно (рис. 6б, 6в, 7г).
При виявленні більшого ступеня гіпоехогенності ПЩПЗ, ніж щитоподібної залози, ці залози слід вважати патологічно зміненими, в більшості таких випадків діагностується гіперпаратиреоз та/або дефіцит вітаміну D, гіперплазія ПЩПЗ.
Не існує прямої залежності між ехогенністю ПЩПЗ та їх функціональним станом. Також може траплятися гіперехогенність ПЩПЗ (рис. 7).
Структура та структурні зміни у ПЩПЗ
Нормальні ПЩПЗ при УЗД є ізоехогенними щодо тканини щитоподібної залози та однорідними. Навіть при хірургічному втручанні їх складно відрізнити від тиреоїдної тканини і сусіднього жиру, хоча вони мають характерний гірчично-жовтий колір, тому їх виділення завдає певних технічних труднощів хірургу.
Якщо ПЩПЗ повністю або частково розташована у тканині щитоподібної залози, при проведенні УЗД її неможливо відрізнити від вузлового зоба, однак частіше ПЩПЗ в цих випадках розташована по її задній поверхні або медіально до трахеї (рис. 8). Гіпоехогенність ПЩПЗ спостерігається при поступовому формуванні аденом або її гіперплазії, коли клітинний компонент ПЩПЗ починає переважати над стромою і жировою тканиною [3].
Не існує прямої залежності між структурними змінами (однорідністю) ПЩПЗ та їх функціональним станом.
За УЗД-картиною неможливо впевнено стверджувати: у пацієнта вже сформована аденома ПЩПЗ чи ні, нормальна її функція чи змінена. Однак є певні риси, що можуть певною мірою підказати лікарю клінічну стадію розвитку патологічного ланцюга.
Аденоми прищитоподібних залоз
Аденоми ПЩПЗ можуть мати нормальну функцію, гіперфункцію та будь-який ультразвуковий вигляд: однорідні/неоднорідні, гіпоехогенні/ізоехогенні/гіперехогенні, маленькі (до 5 мм)/великі тощо. Найчастіше аденоми ПЩПЗ є гіпоехогенними (значна гіпоехогенність аж до анехогенності), однорідними, округлими. Принциповим для аденоми ПЩПЗ є активація судинного кровотоку (кровопостачання), що виявляється при допплерографії (рис. 9, 10).
Кісти прищитоподібних залоз
Кісти ПЩПЗ при УЗД можуть бути від 1 мм до 10 см в діаметрі (рис. 11), завжди анехогенні. Справжні кісти ПЩПЗ трапляються рідко, але кістозна дегенерація паратиреоїдного доброякісного новоутворення спостерігається набагато частіше. Гістологічно первинні кісти вистилаються низьким кубоїдним епітелієм.
Гіперплазія прищитоподібних залоз
За відсутності патології ПЩПЗ вони не візуалізуються.
Гіперплазія ПЩПЗ є типовою клінічною ситуацією в значній кількості випадків при проведенні УЗД (10–40 % у дорослих, 20–70 % у дітей), коли фахівець ідентифікує наявні ПЩПЗ (рис. 12).
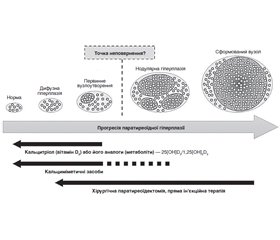
Зазвичай гіперплазія ПЩПЗ пов’язана з будь-яким напруженням у системі кальцій-фосфорного обміну, але частіше за все є наслідком довготривалих нестачі/дефіциту вітаміну D, має поступовий прогресуючий характер, а за відсутності своєчасного призначення адекватної дози вітаміну D перетворюється на аденому ПЩПЗ. Посилення проліферативних процесів у ПЩПЗ проходить кілька стадій: дифузна гіперплазія, рання вузлова гіперплазія, поліклональний вузловий ріст, моноклональний ріст (рис. 13).
Збільшення ПЩПЗ відбувається в разі нестачі вітаміну D, розвитку первинного або вторинного гіперпаратиреозу. Далі, за відсутності лікування, ці зміни прогресують у дифузну поліклональну гіперплазію, яка в подальшому трансформується до моноклональної [13]. Вузлова (аденоматозна) гіперплазія супроводжується дуже високими рівнями паратиреоїдного гормона й ознаками тяжкого ураження кісток, майже не реагує на медикаментозну терапію, потребує хірургічного лікування.
Сонографічно неможливо відрізнити аденоми ПЩПЗ від їх гіперплазії, якщо відсутні додаткові включення (кістозна порожнина, кальцинація, часточковість або ін.). Здебільшого гіперплазовані (змінені) ПЩПЗ мають однорідну будову, проте зрідка виявляється неоднорідна структура залози з наявністю фіброзу, кальцифікатів та/або рідинних включень.
Додатково застосовують, при потребі, кольорову допплерографію. При первинному гіперпаратиреозі з аденомою часто виявляють гіперваскуляризацію, що є патогномонічною ознакою (рис. 10).
Застосування соноеластографії при УЗД ПЩПЗ не має доказової клінічної ефективності, як і при дослідженні щитоподібної залози, її висновки не повинні бути використані.
Обговорення
Таким чином, УЗД є важливим допоміжним клінічним методом візуалізації, що дозволяє відносно ефективно виявляти змінені або гіперплазовані ПЩПЗ при обізнаності та достатній кваліфікації медичного персоналу. УЗД може використовуватися для діагностики, скринінгу патології ПЩПЗ та оцінки ефективності лікування при динамічному спостереженні пацієнтів, в тому числі у доопераційній підготовці та після хірургічного втручання.
Особливо важливе значення УЗД ПЩПЗ має для виявлення їх гіперплазії та порушень функціонального стану в осіб, постраждалих внаслідок аварії на ЧАЕС, або пацієнтів, опромінених при медичних маніпуляціях, в яких існує більш висока ймовірність патологічних змін ПЩПЗ навіть через багато років (понад 25–30 років).
У нормальному незміненому стані ПЩПЗ при УЗД не візуалізуються, їх ехогенність і структура повністю співпадають з тканиною щитоподібної залози. За наявності будь-яких субклінічної напруженості або помірних/значних порушень у системі кальцій-фосфорного обміну, наприклад нестачі/дефіциту вітаміну D, ПЩПЗ починають поступово змінюватися та візуально диференціюватися за розміром, структурою, ехогенністю, вони стають візуалізованими. При проведенні гормонально-метаболічних досліджень у ~60–90 % таких випадків виявляються зниження рівня 25(OH)D, підвищення концентрації паратгормону на 10–30 % в сироватці крові.
У разі несвоєчасного виявлення гіперплазії ПЩПЗ та/або супутньої їх дисфункції поступово формується нодулярна гіперплазія ПЩПЗ, а потім упродовж декількох років розвивається аденома ПЩПЗ зі стійким гіперпаратиреозом, спочатку чутливим до терапії вітаміном 25(OH)D, а згодом — резистентним до нього. Вузлова (аденоматозна) гіперплазія супроводжується дуже високими рівнями паратиреоїдного гормону й ознаками тяжкого ураження кісток, майже не реагує на медикаментозну терапію, потребує хірургічного лікування. Своєчасне/раннє виявлення гіперплазії або дисфункції ПЩПЗ і довготривала терапія вітаміном 25(OH)D в ефективних дозах (2000–6000 МО/добу) з подальшим контролем (УЗД, лабораторний, клінічний) у більшості пацієнтів призводять до зникнення гіперпаратиреозу, зменшення розмірів і структурних змін у ПЩПЗ.
Висновки
1. В осіб, опромінених внаслідок аварії на Чорнобильській АЕС, через 27–32 роки виявлена висока частота гіперплазій прищитоподібних залоз, перш за все в евакуйованих з 30-кілометрової зони відчуження (71,4 %; р = 0) та мешканців радіоактивно забруднених територій (41,7 %; р ≤ 0,01), без ознак первинного гіперпаратиреозу.
2. УЗД прищитоподібних залоз є дієвим діагностичним методом первинного скринінгу та поступового моніторингу клінічної ефективності лікування гіперплазії прищитоподібних залоз і всіх типів гіперпаратиреозу, що супроводжуються змінами розмірів, об’ємів, структури цих залоз.
3. При проведенні УЗД прищитоподібних залоз враховують такі стандартні ультразвукові характеристики: локалізація (верхні, нижні, атипове положення), кількість, розмір/об’єм, контур, однорідність/неоднорідність, ехогенність, васкуляризація/кровообіг.
4. Нормальні незмінені прищитоподібні залози не візуалізуються при проведенні УЗД, хоча є наявними у пацієнтів, за умов відсутності напруження у системі кальцій-фосфорного обміну і вітаміну-гормона D, за структурою та ехогенністю повністю співпадають з тканиною щитоподібної залози.
5. При будь-якому виявленні прищитоподібних залоз необхідно оцінювати їх зміни незалежно від розміру/об’єму, ступеня зміни ехогенності або однорідності/неоднорідності з обов’язковим подальшим визначенням гормонально-метаболічних показників (паратгормон, кальцій загальний/кальцій іонізований, 25(ОН)D) та клінічної оцінки отриманих даних.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
/37.jpg)

/35.jpg)
/36.jpg)
/37_2.jpg)
/38.jpg)
/39.jpg)
/40.jpg)
/41.jpg)
/42.jpg)