Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Неінвазивна діагностика неалкогольної жирової хвороби печінки в дітей: роль зсувнохвильової еластографії та стеатометрії
Авторы: Степанов Ю.М., Завгородня Н.Ю., Завгородня О.Ю., Коненко І.С., Ягмур В.Б., Дементій Н.П., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Здатність певних форм неалкогольної жирової хвороби (НАЖХП), а саме неалкогольного стеатогепатиту (НАСГ), до швидкого прогресування й формування розвинутого фіброзу та цирозу печінки актуалізує необхідність ранньої діагностики НАЖХП, тривалого моніторингу, своєчасного терапевтичного втручання вже в дитячому віці. Рутинне ультразвукове дослідження в сірій шкалі на сьогодні вважається непридатним для скринінгового тестування дітей на НАЖХП у зв’язку з низьким рівнем чутливості й специфічності у виявленні початкових стадій стеатозу, зі значною суб’єктивністю візуальної оцінки, тому інноваційні методи візуалізації з можливістю кількісного оцінювання стеатозу та фіброзу печінки останнім часом виходять на провідні позиції. Мета дослідження: визначити діагностичну цінність сонографічних маркерів, отриманих шляхом 2D-зсувнохвильової еластографії і стеатометрії печінки, при НАЖХП у дітей порівняно з даними транзієнтної еластографії. Матеріали та методи. У дослідження увійшли 170 дітей віком від 6 до 17 років. Середній вік обстежених становив 12,15 ± 2,51 року. Наявність стеатозу печінки визначалась шляхом транзієнтної еластографії (Fibroscan®, Echosens, Франція) із вимірюванням контрольованого показника атенуації ультразвуку. За наявністю стеатозу, стеатогепатиту та ожиріння пацієнти були розподілені на 4 групи: 1-ша група — 37 дітей із НАСГ й ожирінням, 2-га — 53 дитини зі стеатогепатозом й ожирінням, 3-тя — 65 дітей з ожирінням без стеатозу, 4-ту групу (контрольну) становили 15 дітей із нормальною вагою без стеатозу. Жорсткість паренхіми печінки оцінювали методом багатовимірної зсувнохвильової еластографії (2D-SWE) із використанням ультразвукового сканера експертного класу Soneus P7 (Ultrasign, Україна, Швейцарія) у режимі реального часу. Стеатометрію печінки з визначенням коефіцієнта згасання ультразвуку (КЗУ) проводили за допомогою ультразвукового сканера Soneus P7 (Ultrasign, Україна, Швейцарія). Для оцінки діагностичної ефективності порогових значень показників використовували ROC-аналіз із визначенням площі під ROC-кривою (AUС). Результати. Середні значення КЗУ дітей 1-ї та 2-ї груп становили 2,19 [1,99; 2,33] дБ/см
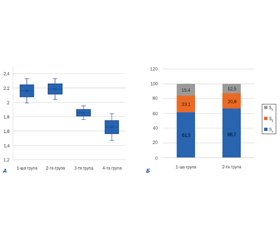
та 2,18 [2,04; 2,33] дБ/см відповідно, що вірогідно відрізняло їх від дітей 3-ї та 4-ї груп. Медіана жорсткості паренхіми печінки дітей із НАСГ становила 5,61 [5,14; 6,51] кПа, що вірогідно відрізняло цих хворих від дітей 2–4-ї груп (р < 0,05). Зіставлення показників стеатометрії та 2D-SWE печінки з даними транзієнтної еластографії за допомогою ROC-аналізу продемонструвало високу інформативність (AUC 0,789, р < 0,0001) порогового значення КЗУ 2,03 дБ/см для діагностики НАЖХП (чутливість — 83,3 %, специфічність — 62,9 %), найвищий рівень інформативності (AUC 0,907, р < 0,0001) порогового значення жорсткості паренхіми печінки 5,28 кПа для діагностики НАСГ (чутливість — 84,6 %, специфічність — 77,1 %). Висновки. Сучасні ультразвукасоційовані візуалізаційні методики — стеатометрія і багатовимірна зсувнохвильова еластографія — демонструють високі рівні чутливості, специфічності й інформативності в діагностиці стеатозу та фіброзу печінки, тому в рамках мультипараметричного ультразвукового дослідження можуть бути застосовані для скринінгової діагностики НАЖХП та диференціальної діагностики простого стеатозу та НАСГ.
Актуальность. Способность определенных форм неалкогольной жировой болезни печени (НАЖБП), а именно неалкогольного стеатогепатита (НАСГ), к быстрому прогрессированию и формированию развитого фиброза и цирроза печени актуализирует необходимость ранней диагностики НАЖБП, длительного мониторинга, своевременного терапевтического вмешательства уже в детском возрасте. Рутинное ультразвуковое исследование в серой шкале сегодня считают непригодным для скринингового тестирования детей с НАЖБП в связи с низким уровнем чувствительности и специфичности в выявлении начальных стадий стеатоза, значительной субъективностью визуальной оценки, поэтому инновационные методы визуализации с возможностью количественной оценки стеатоза и фиброза печени в последние годы выходят на ведущие позиции. Цель исследования: определить диагностическую ценность сонографических маркеров, полученных путем 2D-сдвиговолновой эластографии и стеатометрии печени, при НАЖБП у детей в сопоставлении с данными транзиентной эластографии. Материалы и методы. В исследование вошли 170 детей в возрасте от 6 до 17 лет. Средний возраст обследованных составил 12,15 ± 2,51 года. Наличие стеатоза печени определялось путем транзиентной эластографии (Fibroscan®, Echosens, Франция) с измерением контролируемого показателя атенуации ультразвука. По наличию стеатоза, стеатогепатита и ожирения пациенты были распределены на 4 группы: 1-я группа — 37 детей с НАСГ и ожирением, 2-я — 53 ребенка со стеатогепатозом и ожирением, 3-я — 65 детей с ожирением без стеатоза, 4-ю группу (контрольную) составили 15 детей с нормальным весом без стеатоза. Жесткость паренхимы печени оценивали методом многомерной сдвиговолновой эластографии (2D-SWE) с использованием ультразвукового сканера экспертного класса Soneus P7 (Ultrasign, Украина, Швейцария) в режиме реального времени. Стеатометрию печени с определением коэффициента затухания ультразвука (КЗУ) проводили с помощью ультразвукового сканера Soneus P7 (Ultrasign, Украина, Швейцария). Для оценки диагностической эффективности пороговых значений показателей использовали ROC-анализ с определением площади под ROC-кривой (AUС). Результаты. Средние значения КЗУ детей 1-й и 2-й групп составили 2,19 [1,99; 2,33] дБ/см и 2,18 [2,04; 2,33] дБ/см соответственно, что достоверно отличало их от детей 3-й и 4-й групп. Медиана жесткости паренхимы печени детей с НАСГ составила 5,61 [5,14; 6,51] кПа, что достоверно отличало этих больных от детей 2–4-й групп (р < 0,05). Сопоставление показателей стеатометрии и 2D-SWE печени с данными транзиентной эластографии с помощью ROC-анализа показало высокую информативность (AUC 0,789, р < 0,0001) порогового значения КЗУ 2,03 дБ/см для диагностики НАЖБП (чувствительность — 83,3 %, специфичность — 62,9 %), самый высокий уровень информативности (AUC 0,907, р < 0,0001) порогового значения жесткости паренхимы печени 5,28 кПа для диагностики НАСГ (чувствительность — 84,6 %, специфичность — 77,1 %). Выводы. Современные ультразвукассоциированные визуализационные методики — стеатометрия и многомерная сдвиговолновая эластография — демонстрируют высокие уровни чувствительности, специфичности и информативности в диагностике стеатоза и фиброза печени, поэтому в рамках мультипараметрического ультразвукового исследования могут быть использованы для скрининговой диагностики НАЖБП и дифференциальной диагностики простого стеатоза и НАСГ.
Background. The ability of certain forms of non-alcoholic fatty liver disease (NAFLD), namely non-alcoholic steatohepatitis (NASH), to rapid progression and the formation of advanced liver fibrosis and cirrhosis raises the need for early diagnosis of NAFLD, long-term monitoring, timely therapeutic intervention already in the childhood. Routine grey scale ultrasound is currently considered unsuitable for screening of children for NAFLD due to the low level of sensitivity and specificity in detecting the initial stages of steatosis, significant subjectivity of visual assessment, so innovative methods of visualization with the possibility of quantitative assessment of liver fibrosis and steatosis have taken the lead in recent years. The purpose of the study: to determine the diagnostic value of sonographic markers obtained by 2D shear wave elastography and hepatic steatometry in NAFLD in children compared to the data of transient elastography. Materials and methods. The study included 170 children aged 6 to 17 years. The mean age of the patients was 12.15 ± 2.51 years. The presence of hepatic steatosis was determined by transient elastography (Fibroscan®, Echosens, France) with the measurement of a controlled attenuation parameter. According to the presence of steatosis, steatohepatitis, and obesity, patients were divided into 4 groups: group 1 — 37 children with NASH and obesity, group 2 — 53 people with simple steatosis and obesity, group 3 — 65 children with obesity without steatosis, group 4 (control) consisted of 15 individuals with normal weight without steatosis. The liver parenchyma stiffness was assessed by multidimensional shear wave elastography (2D-SWE) using an ultrasound system Soneus P7 (Ultrasign, Ukraine-Switzerland) in real time. Liver steatometry with the determination of the ultrasound attenuation coefficient (UAC) was performed using an ultrasound scanner Soneus P7 (Ultrasign, Ukraine-Switzerland). To evaluate the diagnostic accuracy of the threshold values, receiver operating characteristic (ROC) analysis was conducted with the determination of the area under the ROC curve (AUC). Results. The average values of UAC in children of groups 1 and 2 were 2.19 [1.99; 2.33] and 2.18 [2.04; 2.33] dB/cm, respectively, which significantly distinguished them from patients of groups 3 and 4. The median value of the liver parenchyma stiffness in children with NASH was 5.61 [5.14; 6.51] kPa that significantly distinguished these patients from those of groups 2–4 (p < 0.05). Comparison of steatometry and 2D-SWE results with transient elastography data using ROC analysis showed high performance (AUC 0.789, p < 0.0001) of the threshold value of UAC 2.03 dB/cm for the diagnosis of NAFLD (sensitivity 83.3 %, specificity 62.9 %), the highest level of performance (AUC 0.907, p < 0.0001) of the threshold value of the liver parenchyma stiffness 5.28 kPa for the diagnosis of NASH (sensitivity 84.6 %, specificity 77.1 %). Conclusions. Modern ultrasound-associated imaging techniques — steatometry and multidimensional shear wave elastography — demonstrate high levels of sensitivity, specificity, and performance in the diagnosis of hepatic steatosis and fibrosis; therefore, within the framework of multiparametric ultrasound examination, they can be used for screening diagnosis of NAFLD and differential diagnosis of simple steatosis and NASH.
коефіцієнт згасання ультразвуку; зсувнохвильова еластографія; неалкогольна жирова хвороба печінки; діти
коэффициент затухания ультразвука; сдвиговолновая эластография; неалкогольная жировая болезнь печени; дети
ultrasound attenuation coefficient; shear wave elastography; non-alcoholic fatty liver disease; children
Вступ
Матеріали та методи
Результати
Обговорення
Cередні значення КЗУ в пацієнтів із простим стеатозом та стеатогепатитом, за даними нашого дослідження, практично не відрізнялись. Пороговий рівень КЗУ для діагностики будь-якого ступеня стеатозу становив 2,03 дБ/см. Більше ніж у третини пацієнтів із НАЖХП та НАСГ виявлені розвинуті стадії стеатозу (S2–S3). Отримані нами дані не суперечать результатам дослідження Nirav K. Desai та співавт. (2016), які визначили «точку відсікання» (cut off) за показником CAP на межі здорові/хворі зі стеатозом, що становила 2,25 дБ/см [18].
Висновки
- Mitra S., De A., Chowdhury A. Epidemiology of non-alcoholic and alcoholic fatty liver diseases. Transl. Gastroenterol. Hepatol. 2020. 5. 16. doi: 10.21037/tgh.2019.09.08.
- Eslam M., Newsome P.N., Sarin S.K. et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J. Hepatol. 2020. 73(1). 202-209. doi: 10.1016/j.jhep.2020.03.039.
- Müller P.C., Kabacam G., Vibert E., Germani G., Petrowsky H. Current status of liver transplantation in Europe Int. J. Surg. 2020. 1743-9191(20)30445-3. doi: 10.1016/j.ijsu.2020.05.062.
- Nobili V., Alisi A., Valenti L., Miele L., Feldstein A.E., Alkhouri N. NAFLD in children: new genes, new diagnostic modalities and new drugs. Nat. Rev. Gastroenterol. Hepatol. 2019. 16(9). 517-530. doi: 10.1038/s41575-019-0169-z
- Lin C.H., Kohli R. Emerging New Diagnostic Modalities and Therapies of Nonalcoholic Fatty Liver Disease. Curr. Gastroenterol. Rep. 2020. 22(10). 52. Published 2020, Aug 19. doi: 10.1007/s11894-020-00786-y.
- Pirmoazen A.M., Khurana A., El Kaffas A., Kamaya A. Quantitative ultrasound approaches for diagnosis and monitoring hepatic steatosis in nonalcoholic fatty liver disease. Theranostics. 2020. 10(9). 4277-4289. Published 2020, Mar 4. doi:10.7150/thno.40249.
- Paige J.S., Bernstein G.S., Heba E. et al. A Pilot Comparative Study of Quantitative Ultrasound, Conventional Ultrasound, and MRI for Predicting Histology-Determined Steatosis Grade in Adult Nonalcoholic Fatty Liver Disease. AJR Am. J. Roentgenol. 2017. 208(5). 168-177. doi:10.2214/AJR.16.16726.
- Ozturk A., Grajo J.R., Gee M.S. et al. Quantitative Hepatic Fat Quantification in Non-alcoholic Fatty Liver Disease Using Ultrasound-Based Techniques: A Review of Literature and Their Diagnostic Performance. Ultrasound Med. Biol. 2018. 44(12). 2461-2475. doi: 10.1016/j.ultrasmedbio.2018.07.019.
- Karlas T., Petroff D., Sasso M. et al. Individual patient data meta-analysis of controlled attenuation parameter (CAP) technology for assessing steatosis. J. Hepatol. 2017. 66(5). 1022-1030. doi:10.1016/j.jhep.2016.12.022.
- Shin J., Kim M.J., Shin H.J. et al. Quick assessment with controlled attenuation parameter for hepatic steatosis in children based on MRI-PDFF as the gold standard. BMC Pediatr. 2019. 19(1). 112. Published 2019, Apr 15. doi: 10.1186/s12887-019-1485-8.
- Nobili V., Vizzutti F., Arena U. et al. Accuracy and reproducibility of transient elastography for the diagnosis of fibrosis in pediatric nonalcoholic steatohepatitis. Hepatology. 2008. 48(2). 442-448. doi: 10.1002/hep.22376.
- Dietrich C.F., Bamber J., Berzigotti A. et al. EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography, Update 2017 (Long Version). Ultraschall Med. 2017. 38(4). 16-47. doi: 10.1055/s-0043-103952.
- Piscaglia F., Salvatore V., Mulazzani L., Cantisani V., Schiavone C. Ultrasound Shear Wave Elastography for Liver Disease. A Critical Appraisal of the Many Actors on the Stage. Ultraschall Med. 2016. 37(1). 1-5. doi: 10.1055/s-0035-1567037.
- Belei O., Sporea I., Gradinaru-Tascau O. et al. Comparison of three ultrasound based elastographic techniques in children and adolescents with chronic diffuse liver diseases. Med. Ultrason. 2016. 18(2). 145-150. doi: 10.11152/mu.2013.2066.182.bet.
- Galina P., Alexopoulou E., Zellos A. et al. Performance of two-dimensional ultrasound shear wave elastography: reference values of normal liver stiffness in children. Pediatr Radiol. 2019. 49(1). 91-98. doi: 10.1007/s00247-018-4244-3.
- Stepanov Y., Zavhorodnia N., Lukianenko O., Konenko I., Yahmur V. Assessment of the hepatic and pancreatic structure with shear wave elastography and steatometry in obese children. Georgian Med. News. 2019. (295). 51-56.
- de Lédinghen V., Vergniol J., Foucher J., Merrouche W., le Bail B. Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography. Liver Int. 2012. 32(6). 911-918. doi: 10.1111/j.1478-3231.2012.02820.x.
- Desai N.K., Harney S., Raza R. et al. Comparison of Controlled Attenuation Parameter and Liver Biopsy to Assess Hepatic Steatosis in Pediatric Patients. J. Pediatr. 2016. 173. 160-164.e1. doi: 10.1016/j.jpeds.2016.03.021.
- Vos M.B., Abrams S.H., Barlow S.E. et al. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). J. Pediatr. Gastroenterol. Nutr. 2017. 64(2). 319-334. doi: 10.1097/MPG.0000000000001482.
- Vajro P., Lenta S., Socha P. et al. Diagnosis of nonalcoholic fatty liver disease in children and adolescents: position paper of the ESPGHAN Hepatology Committee. J. Pediatr. Gastroenterol. Nutr. 2012. 54(5). 700-713. doi: 10.1097/MPG.0b013e318252a13f.
- World Health Organization: Growth reference 5-19 years. BMI-for-age (5–19 years). Режим доступу: http://www.who.int/growthref/who2007_bmi_for_age/en/
- Kleiner D.E., Brunt E.M., Van Natta M. et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005. 41(6). 1313-1321. doi: 10.1002/hep.20701.
- Tada T., Kumada T., Toyoda H., Kobayashi N., Sone Y., Oguri T. et al. Utility of Attenuation Coefficient Measurement Using an Ultrasound-Guided Attenuation Parameter for Evaluation of Hepatic Steatosis: Comparison With MRI-Determined Proton Density Fat Fraction. Am. J. Roentgenol. 2018. 212. 332-341.
- Paige J.S., Bernstein G.S., Heba E., Costa E.A.C., Fereirra M., Wolfson T. et al. A Pilot Comparative Study of Quantitative Ultrasound, Conventional Ultrasound, and MRI for Predicting Histology-Determined Steatosis Grade in Adult Nonalcoholic Fatty Liver Disease. AJR Am. J. Roentgenol. 2017. 208. 168-77.
- Erdem Toslak I., Lim-Dunham J.E., Joyce C., Marbella M.E. A Practical Approach to Quantitative Grayscale Ultrasound Analysis of Hepatic Steatosis in Pediatric Patients Using a Picture Archiving and Communication System-Based Tool. J. Ultrasound Med. 2018. 37(10). 2395-2403. doi: 10.1002/jum.14598.
- Di Martino M., Pacifico L., Bezzi M. et al. Comparison of magnetic resonance spectroscopy, proton density fat fraction and histological analysis in the quantification of liver steatosis in children and adolescents. World J. Gastroenterol. 2016. 22(39). 8812-8819. doi: 10.3748/wjg.v22.i39.8812.
- Middleton M.S., Van Natta M.L., Heba E.R. et al. Diagnostic accuracy of magnetic resonance imaging hepatic proton density fat fraction in pediatric nonalcoholic fatty liver disease. Hepatology. 2018. 67(3). 858-872. doi: 10.1002/hep.29596
- Draijer L., Benninga M., Koot B. Pediatric NAFLD: an overview and recent developments in diagnostics and treatment. Expert Rev Gastroenterol Hepatol. 2019. 13(5). 447-461. doi: 10.1080/17474124.2019.1595589.
- Awai H.I., Newton K.P., Sirlin C.B., Behling C., Schwimmer J.B. Evidence and recommendations for imaging liver fat in children, based on systematic review. Clin. Gastroenterol. Hepatol. 2014. 12(5). 765-773. doi: 10.1016/j.cgh.2013.09.050.
- Behairy E. Behairya, Hatem M. Husseinb, Elsayed I. Salamaa, Nermin M. Adawya and Ashraf A. Elmeerya Nonalcoholic fatty liver and steatohepatitis in obese children Egyptian Liver Journal. 2011. 1(2). 73-80. doi: 10.1097/01.ELX.0000397037.56165.75.
- Lee S.S., Park S.H., Kim H.J. et al. Non-invasive assessment of hepatic steatosis: prospective comparison of the accuracy of imaging examinations. J. Hepatol. 2010. 52(4). 579-585. doi: 10.1016/j.jhep.2010.01.008.
- Bae J.S., Lee D.H., Lee J.Y. et al. Assessment of hepatic steatosis by using attenuation imaging: a quantitative, easy-to-perform ultrasound technique. Eur. Radiol. 2019. 29(12). 6499-6507. doi: 10.1007/s00330-019-06272-y.
- Ferraioli G., Maiocchi L., Raciti M.V. et al. Detection of Liver Steatosis With a Novel Ultrasound-Based Technique: A Pilot Study Using MRI-Derived Proton Density Fat Fraction as the Gold Standard. Clin. Transl. Gastroenterol. 2019. 10(10). e00081. doi: 10.14309/ctg.0000000000000081.
- Garcovich M., Veraldi S., Di Stasio E. et al. Liver Stiffness in Pediatric Patients with Fatty Liver Disease: Diagnostic Accuracy and Reproducibility of Shear-Wave Elastography. Radiology. 2017. 283(3). 820-827. doi: 10.1148/radiol.2016161002.
- Tang A., Destrempes F., Kazemirad S., Garcia-Duitama J., Nguyen B.N., Cloutier G. Quantitative ultrasound and machine learning for assessment of steatohepatitis in a rat model. Eur. Radiol. 2019. 29(5). 2175-2184. doi: 10.1007/s00330-018-5915-z.

/19.jpg)
/21.jpg)
/21_2.jpg)
/22.jpg)
/23.jpg)
/24.jpg)