Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Обґрунтування шляхів корекції вітамін-D-дефіцитних станів у дітей з ювенільним ідіопатичним артритом
Авторы: Шевченко Н.С.(1, 2), Хаджинова Ю.В.(1, 2)
(1) — ДУ «Інститут охорони здоров’я дітей та підлітків НАМН», м. Харків, Україна
(2) — Харківський національний університет ім. В.Н. Каразіна, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
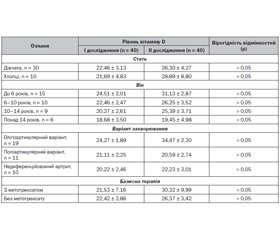
Актуальність. У сучасних публікаціях обговорюється роль вітаміну D як імунного та запального медіатора, що бере участь у патогенезі низки автоімунних захворювань, в тому числі хронічних артритів у дітей. Kальциферол здатний пригнічувати імунну відповідь, а його дефіцит пов’язується зі збільшенням синтезу протизапальних медіаторів і, відповідно, активності автоімунних захворювань. Мета: визначення статусу вітаміну D у дітей з ювенільним ідіопатичним артритом (ЮІА) залежно від віку пацієнтів, варіанта хвороби та терапії; аналіз динаміки статусу вітаміну D на тлі саплементації препаратами. Матеріали та методи. У дослідження увійшли 40 пацієнтів з ЮIA (30 дівчат, 10 хлопців). Хворі були поділені на групи залежно від віку, варіанта захворювання (оліго-, поліартикулярний варіант, недиференційований артрит) і терапії (наявності метотрексату або його відсутності). Дослідження проводилося двічі (перший раз — без додаткового прийому вітаміну D, другий — після 3-місячної саплементації 2000 МО). Рівень 25(OH)D у сироватці крові вимірювали методом хемілюмінесценції. Результати. Середній рівень вітаміну D становив 22,26 ± 2,53 нг/мл. Залежності від статі та варіанта захворювання при першому дослідженні виявлено не було. Діти віком до 6 років мали вищий статус вітаміну D порівняно з дітьми старшого віку (р < 0,05). При повторному дослідженні рівень вітаміну D у загальній групі хворих становив 27,61 ± 3,56 нг/мл, що свідчить про вірогідне його підвищення (р < 0,05). Пацієнти чоловічої статі мали більш виражену позитивну динаміку, ніж пацієнти жіночої статі (р < 0,05). Рівень вітаміну D у дітей молодшого віку очікувано зростав (р < 0,05). Встановлено позитивні зміни статусу вітаміну D у хворих з олігоартикулярним ЮІА (р < 0,05) на відміну від хворих з іншими варіантами захворювання. За умов наявності базисної терапії пацієнти краще відповідали на прийом вітаміну D, ніж діти, які не отримували лікування метотрексатом (р < 0,05). Також позитивну динаміку спостерігали в дітей із тривалістю лікування метотрексатом до 2 років (р < 0,05). Але оптимальний вміст вітаміну D було досягнуто тільки в пацієнтів, які отримували базисну терапію до 6 місяців. Особи, які отримували метотрексат у дозі до 10 мг/м2/тиждень, не мали динаміки на відміну від осіб, які отримували метотрексат у дозі 10–15 мг/м2/тиждень (р < 0,05). Висновки. Діти, старші від 6 років, з поліартритом і недиференційованим варіантом ЮІА, а також з тривалістю хвороби понад 2 роки й тривалістю терапії метотрексатом понад 6 місяців або в дозі нижче за 10 мг/м2/тиждень мають недостатню відповідь на саплементацію вітаміном D, що потребує перегляду як профілактичних, так і терапевтичних доз препаратів вітаміну D у дітей з ЮІА.
Актуальность. В современных публикациях обсуждается роль витамина D как иммунного и воспалительного медиатора, участвующего в патогенезе ряда аутоиммунных заболеваний, в том числе хронических артритов у детей. Кальциферол способен подавлять иммунный ответ, а его дефицит связан с увеличением синтеза противовоспалительных медиаторов и, соответственно, активности аутоиммунных заболеваний. Цель: определить статус витамина D у детей с ювенильным идиопатическим артритом (ЮИА) в зависимости от возраста пациентов, варианта заболевания и терапии; анализ динамики статуса витамина D на фоне сапплементации его препаратами. Материалы и методы. В исследование были включены 40 детей с ЮИА (30 девочек, 10 мальчиков). Пациенты были разделены на группы в зависимости от возраста, варианта заболевания (олиго-, полиартикулярный вариант, недифференцированный артрит) и терапии (наличия метотрексата или его отсутствия). Исследование проводилось дважды (первый раз — без дополнительного приема витамина D, второй — после 3-месячной сапплементации 2000 МЕ). Уровень 25(OH)D в сыворотке крови измерялся методом хемилюминесценции. Результаты. Средний уровень витамина D составил 22,26 ± 2,53 нг/мл. Зависимости от пола и варианта заболевания при первом исследовании обнаружено не было. Дети в возрасте до 6 лет имели более высокий статус витамина D по сравнению с детьми старшего возраста (р < 0,05). При повторном исследовании уровень витамина D в общей группе больных равнялся 27,61 ± 3,56 нг/мл, что свидетельствует о достоверном его повышении (р < 0,05). Пациенты мужского пола имели более выраженную позитивную динамику, чем пациенты женского пола (р < 0,05). Уровень витамина D у детей младшего возраста ожидаемо повышался (р < 0,05). Установлены положительные изменения в статусе витамина D у лиц с олигоартикулярным ЮИА в отличие от пациентов с другими вариантами заболевания. При наличии базисной терапии пациенты отвечали на прием витамина D лучше, чем дети, которые не получали лечение метотрексатом (р < 0,05). Также позитивную динамку наблюдали у детей с длительностью лечения до 2 лет (р < 0,05). Но оптимальная концентрация витамина D была достигнута только у пациентов, которые получали лечение до 6 месяцев. Лица, которые получали метотрексат в дозе до 10 мг/м2/неделю, не имели динамики в отличие от пациентов, которые получали метотрексат в дозе 10–15 мг/м2/неделю (р < 0,05). Выводы. Дети старше 6 лет с полиартритом и недифференцированным вариантом ЮИА, а также с длительностью заболевания более 2 лет и продолжительностью терапии метотрексатом более 6 месяцев или в дозе менее 10 мг/м2/неделю дают недостаточный ответ на сапплементацию витамином D, что требует пересмотра как профилактических, так и терапевтических доз препаратов витамина D у детей с ЮИА.
Background. Plenty of studies demonstrated the role of vitamin D in the pathogenesis of autoimmune diseases, including chronic childhood arthritis. Calciferol is able to suppress the immune response. Also, its deficiency is associated with increased activity of autoimmune diseases. The purpose of this study was: 1) to determinate vitamin D status in children with juvenile idiopathic arthritis (JIA) depending on the age of patients, variant of disease and therapy; 2) to analyze changes in the vitamin D status after its 3-month supplementation. Materials and methods. The study included 40 children with JIA (30 females, 10 males). Patients were divided into groups depending on the age, disease variant (oligo, -polyarticular variant, undifferentiated arthritis) and therapy (presence or absence of methotrexate, duration of therapy and doses). The research was conducted twice (the first — without additional intake of vitamin D, the second — after its 3-month supplementation of 2,000 IU). The serum level of vitamin D was measured through blood test by chemiluminescence method. Results. The average level of vitamin D was 22.26 ± 2.53 ng/ml. Dependence on gender and variant of the disease at the first stage of research was not found. Children under 6 years of age had a higher vitamin D status than older individuals (p < 0.05). At the second stage of research, the level of vitamin D in the general group of patients was 27.61 ± 3.56 ng/ml that proves a significant rise (p < 0.05). Male patients had a significant positive dynamics in comparison with female patients (p < 0.05). Vitamin D levels in little children increased to the optimal level. Positive changes in vitamin D status were found in patients with oligoarticular JIA (p < 0.05) in contrast to those with other variants of the disease. Patients who received methotrexate showed the better response to vitamin D intake than children who were not treated (p < 0.05). Positive dynamics was also observed in patients who were treated with methotrexate for no more than 2 years (p < 0.05). But the optimal status of vitamin D was achieved only in those who received basic therapy for no more than 6 months. The patients whose doses of methotrexate were less than 10 mg/m2/week have not showed the dynamics, in contrast to the subjects who received methotrexate at a dose of 10–15 mg/m2/week (p < 0.05). Conclusions. Children with JIA, who are older than 6 years; suffer from polyarthritis and undifferentiated JIA; whose duration of disease is more than 2 years; who receives methotrexate therapy over 6 months or at a dose below 10 mg/m2/week, have an insufficient response to vitamin D supplementation. Such patients require increasing the doses of vitamin D supplementation for both prophylactic and therapeutic purposes.
вітамін D; ювенільний ідіопатичний артрит; холекальциферол; статус вітаміну D; саплементація вітаміну D
витамин D; ювенильный идиопатический артрит; холекальциферол; статус витамина D; сапплементация витамина D
vitamin D; juvenile idiopathic arthritis; cholecalciferol; vitamin D status; vitamin D supplementation
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. Cutolo M., Pizzorni C., Sulli A. Vitamin D endocrine system involvement in autoimmune rheumatic diseases. Autoimmun Rev. 2011. Vol. 11. P. 84-87. https://doi.org/10.1016/j.autrev.2011.08.003. [PubMed] [Google Scholar].
2. De Luca H. Overview of general physiologic features and functions of vitamin D. Am. J. Clin. Nutr. 2004. Vol. 80. P. 1689S-1696S. https://doi.org/10.1093/ajcn/80.6.1689S. [PubMed] [Google Scholar].
3. Vojinovic J. Vitamin D, receptor agonists’ anti-inflammatory properties. Ann. N. Y. Acad. Sci. 2014. Vol. 1317. P. 47-56. https://doi.org/10.1111/nyas.12429. [PubMed] [Google Scholar].
4. Shevchenko N., Khadzhynova Y. Juvenile idiopathic arthritis and vitamin D status in Ukrainian patients. Georgian Med. News. 2019. Vol. 294. P. 88-91. [PubMed] [Google Scholar].
5. Haussler M.R, Haussler C.A., Whitfield G.K., Hsieh J.-Ch. et al. The nuclear vitamin D receptor controls the expression of genes encoding factors which feed the “Fountain of Youth” to mediate healthful aging. J. Steroid Biochem. Mo.l Biol. 2010. Vol. 121. P. 88-97. https://doi.org/10.1016/j.jsbmb.2010.03.019. [PMC free article] [PubMed] [Google Scholar].
6. Ross C.A., Taylor C.L., Yaktime A.L., Del Valle H.B., eds. Dietary Reference Intakes for calcium and vitamin. Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. Washington, DC: National Academies Press, 2010. https://pdfs.semanticscholar.org/fc6d/313979e1da4659fe4e8dfe9e664743b.pdf.
7. Armas L.A., Hollis B.W., Heaney R.P. Vitamin D2 is much less effective than vitamin D3 in humans. J. Clin. Endocrinol. Metab. 2004. 89(11). 5387-91. https://doi.org/10.1210/jc.2004-0360.
8. Holick M.F. Vitamin D status: measurement, interpretation and clinical application. Ann. Epidemiol. 2009. Vol. 19. № 2. P. 73-78. https://doi.org/10.1016/j.annepidem.2007.12.001.
9. Thacher T.D., Clarke B.L. Vitamin D Insufficiency. Mayo Clin. Proc. 2011. Vol. 86. № 1. P. 50-60. https://doi.org/10.4065/mcp.2010.0567.
10. Prietl B., Treiber G., Pieber T.R., Amrein K. Vitamin D and immune function. Nutrients. 2013. Vol. 5. № 7. Р. 2502-21. doi: 10.3390/nu5072502. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
11. Holick M.F. Vitamin D, deficiency. N. Engl. J. Med. 2007. 357. 266-81. https://doi.org/10.1056/NEJMra070553.
12. Ross C., Taylor Ch.L., Yaktine A.L., Del Valle H.B., eds. Dietary Reference Intakes for Calcium and Vitamin D. Committee to Review Dietary Reference Intakes for Calcium and Vitamin D. Washington DC: National Academies Press, 2011. 1132 p. https://doi.org/10.17226/13050. https://www.nap.edu/read/13050/chapter/1#ii.
13. Płudowski P., Karczmarewicz E., Bayer M. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynologia Polska. 2013. Vol. 64. № 4. P. 319-327. https://doi.org/10.5603/ep.2013.0012.
14. Gordon C.M., Williams A.L., Feldman H.A., May J., Sinclair L., Vasquez A. Treatment of Hypovitaminosis D in Infants and Toddlers. J. Clin. Endocrinol. Metab. 2008. 93(7). 2716-21. https://doi.org/10.1210/jc.2007-2790.
15. Holick M.F., Binkley C.N., Bischoff-Ferrari A.H., Gordon M.C. Evaluation, treatment, and prevention of vitamin D deficiency: an endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011. 96(7). 1911-30. https://doi.org/10.1210/jc.2011-0385.
16. Hypponen E., Laara E., Reunanen A., Jarvelin M.R., Virtanen S.M. Intake of vitamin D and risk of type 1diabetes: a birth-cohort study. Lancet. 2001. 358. 1500-3. https://doi.org/10.1016/S0140-6736(01)06580-1.
17. Ducharme F.M., Jensen M., Mailhot G., Alos N. et al. Impact of two oral doses of 100,000 IU of vitamin D(3) in preschoolers with viral-induced asthma: a pilot randomised controlled trial. Trials. 2019. Vol. 20. № 1. P. 138. https://doi.org doi: 10.1186/s13063-019-3184-z.
18. Barrueto F. Jr., Wang-Flores H.H., Howland M.A., Hoffman R.S. et al. Acute vitamin D intoxication in a child. Pediatrics. 2005. Vol. 116. P. e453-e456. https://doi.org/10.1542/peds.2004-2580.
19. Bereket A., Erdogan T. Oral bisphosphonate therapy for vitamin D intoxication of the infant. Pediatrics. 2003. Vol. 111. P. 899-901. https://doi.org/10.1542/peds.111.4.899.
20. Chambellan-Tison C., Horen B., Plat-Wilson G., Moulin P. et al. Severe hypercalcemia due to vitamin D intoxication. Arch. Pediatr. 2007. Vol. 14. P. 1328-1332. https://doi.org/10.1016/j.arcped.2007.08.005.
21. Chatterjee M., Speiser P.W. Pamidronate treatment of hypercalcemia caused by vitamin D toxicity. J. Pediatr. Endocrinol. Metab. 2007. Vol. 20. P. 1241-1248. https://doi.org/10.1515/jpem.2007.20.11.1241.
22. Rajakumar K., Reis E.C., Holick M.F. Dosing error with over-the-counter vitamin D supplement: a risk for vitamin D toxicity in infants. Clin. Pediatr. (Phila). 2013. Vol. 52. P. 82-85. https://doi.org/10.1177/0009922812439245.
23. Sezer R.G., Guran T., Paketçi C., Seren L.P. et al. Comparison of oral alendronate versus prednisolone in treatment of infants with vitamin D intoxication. Acta Paediatrica. 2012. Vol. 101. P. 122-125. https://doi.org/10.1111/j.1651-2227.2011.02497.x

/63.jpg)