Журнал «Почки» Том 9, №4, 2020
Вернуться к номеру
Частота, ступінь та предиктори ренальної дисфункції в пацієнтів із мозковим інсультом
Авторы: Фломін Ю.В.(1), Іванов Д.Д.(3), Червонописька О.М.(1), Гур’янов В.Г.(2), Соколова Л.І.(2)
(1) — Медичний центр «Універсальна клініка «Оберіг», м. Київ, Україна
(2) — Національний медичний університет ім. О.О. Богомольця МОЗ України, м. Київ, Україна
(3) — Національна медична академія післядипломної освіти ім. П.Л. Шупика МОЗ України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
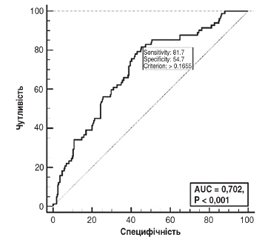
Мета — оцінка частоти та ступеня тяжкості ренальної дисфункції в пацієнтів із мозковим інсультом (МІ) та визначення предикторів помірного чи тяжкого зниження розрахункової швидкості клубочкової фільтрації (рШКФ). Матеріали та методи. Проведено аналіз даних 360 пацієнтів із верифікованим діагнозом МІ, які у 2010–2018 рр. були госпіталізовані в різні періоди МІ. У всіх учасників при надходженні на автоматичному аналізаторі DiaSys respons® 920 був визначений рівень креатиніну в крові, а потім за формулою CKD-EPI визначена рШКФ. Показники рШКФ від 89 до 60 мл/хв/1,73 м2 вважали легким, а < 60 мл/хв/1,73 м2 — помірним чи тяжким зниженням рШКФ. Якісні змінні відображені як число та проценти, кількісні змінні — за допомогою медіани та міжквартильного інтервалу (МКІ). Аналіз даних проводився з використанням пакета MedCalc® Statistical Software. Результати. У вибірці жінки становили 41,7 %, медіана віку становила 66 років (МКІ 58–75), у 301 (83,6 %) пацієнта діагностовано ішемічний інсульт (ІІ), медіана початкової оцінки за National Institutes of Health Stroke Scale (NIHSS) — 10 балів (МКІ 6–17). У учасників документовано високу частоту основних судинних факторів ризику: 82,2 % страждали від артеріальної гіпертензії (АГ), 36,4 % — від фібриляції передсердь, 28,6 % — від цукрового діабету, 30,6 % — від ожиріння, 14,7 % були курцями, 16,4 % зловживали алкоголем, а у 23,3 % осіб МІ був повторним. Показники рШКФ варіювали від 11,1 до 174,7 мл/хв/1,73 м2 (медіана 87,8, МКІ 62,5–98,5). У 55,0 % пацієнтів рШКФ була знижена, зокрема в 32,2 % спостерігалось легке, а у 22,8 % — помірне чи тяжке зниження. Значущих відмінностей за рШКФ при різних типах МІ не виявлено, але зниження рШКФ частіше спостерігалось при кардіоемболічних ІІ порівняно з атеротромботичними ІІ: 63,2 та 47,9 % відповідно (p < 0,05). Згідно з результатами багатофакторного аналізу, незалежними предикторами помірного чи тяжкого зниження рШКФ виявились вік пацієнта (відношення шансів (ВШ) 1,02; 95% довірчий інтервал (ДІ) 1,00–1,05, у середньому на кожен додатковий рік, р = 0,044), чоловіча стать (ВШ 5,2; 95% ДІ 2,7–9,9; р < 0,001) та наявність в анамнезі АГ (ВШ 2,7; 95% ДІ 1,2–6,4; р = 0,022). Модель, побудована на основі трьох виокремлених факторів, виявилася адекватною, але площа під кривою AUC = 0,70 (95% ДІ 0,65–0,75) свідчить про помірний зв’язок. Висновки. Ренальну дисфункцію мають більше половини пацієнтів із МІ, і майже в 1/4 випадків спостерігається помірне чи тяжке зниження рШКФ (хронічна хвороба нирок 3–5-ї стадій). Оскільки АГ є предиктором помірної чи тяжкої ренальної дисфункції в пацієнтів із МІ, кращий контроль АГ (передусім за допомогою інгібіторів ренін-ангіотензинової системи) може бути дієвим способом профілактики тяжкої хронічної хвороби нирок.
Цель — оценка частоты и степени тяжести почечной дисфункции у пациентов с мозговым инсультом (МИ) и определение предикторов умеренного или тяжелого снижения расчетной скорости клубочковой фильтрации (рСКФ). Материалы и методы. Проведен анализ данных 360 пациентов с верифицированным диагнозом МИ, которые в 2010–2018 гг. были госпитализированы в разные периоды МИ. У всех участников при поступлении на автоматическом анализаторе DiaSys respons® 920 был определен уровень креатинина в крови, а затем по формуле CKD-EPI определена рСКФ. Показатели рСКФ от 89 до 60 мл/мин/1,73 м2 считали легким, а < 60 мл/мин/1,73 м2 — умеренным или тяжелым снижением рСКФ. Качественные переменные отражены как число и проценты, количественные переменные — с помощью медианы и межквартильного интервала (МКИ). Анализ данных проводился с использованием пакета MedCalc® Statistical Software. Результаты. В выборке женщины составили 41,7 %, медиана возраста составила 66 лет (МКИ 58–75), у 301 (83,6 %) пациента диагностирован ишемический инсульт (ИИ), медиана исходной оценки по NIHSS — 10 баллов (МКИ 6–17). У участников документирована высокая частота основных сосудистых факторов риска: 82,2 % страдали артериальной гипертензией (АГ), 36,4 % — фибрилляцией предсердий, 28,6 % — сахарным диабетом, 30,6 % — ожирением, 14,7 % были курильщиками, 16,4 % злоупотребляли алкоголем, а у 23,3 % МИ был повторным. Показатели рСКФ варьировали от 11,1 до 174,7 мл/мин/1,73 м2 (медиана 87,8, МКИ 62,5–98,5). У 55,0 % пациентов рСКФ была снижена, в частности у 32,2 % наблюдалось легкое, а у 22,8 % — умеренное или тяжелое снижение рСКФ. Значимых различий по рСКФ при различных типах МИ не обнаружено, но снижение рСКФ чаще наблюдалось при кардиоэмболическом ИИ по сравнению с атеротромботическим ИИ: 63,2 и 47,9 % соответственно (p < 0,05). Согласно результатам многофакторного анализа, независимыми предикторами умеренного или тяжелого снижения рСКФ оказались возраст пациента (отношение шансов (ОШ) 1,02; 95% доверительный интервал (ДИ) 1,00–1,05, в среднем на каждый дополнительный год, р = 0,044), мужской пол (ОШ 5,2; 95% ДИ 2,7–9,9; р < 0,001) и наличие в анамнезе АГ (ОШ 2,7; 95% ДИ 1,2–6,4; р = 0,022). Модель, построенная на основе трех выделенных факторов, оказалась адекватной, но площадь под кривой AUC = 0,70 (95% ДИ 0,65–0,75) свидетельствует об умеренной связи. Выводы. Ренальную дисфункцию имеют больше половины пациентов с МИ, и почти в 1/4 случаев наблюдается умеренное или тяжелое снижение рСКФ (хроническая болезнь почек 3–5-й стадий). Поскольку АГ является предиктором умеренной или тяжелой ренальной дисфункции у пациентов с МИ, лучший контроль АГ (прежде всего с помощью ингибиторов ренин-ангиотензиновой системы) может быть действенным способом профилактики тяжелой хронической болезни почек.
Background. The purpose was to evaluate the frequency and severity of renal dysfunction in patients with cerebral stoke (CS) and to determine predictors of moderate or severe reduction in estimated glomerular filtration rate (eGFR). Material and methods. Data of 360 enrolled patients with a verified diagnosis of CS admitted in 2010–2018 at different CS phases were analyzed. Upon admission, blood creatinine levels were determined in all participants on the DiaSys respons®920 automatic analyzer, and their eGFR was calculated using the CKD-EPI formula. EGFR from 89 to 60 ml/min/1.73 m2 was considered mildly, and < 60 ml/min/1.73 m2 — moderately or severely decreased. Qualitative variables are shown as numbers and percentages, quantitative variables — using the median and interquartile range (IQR). Data analysis was performed using MedCalc® Statistical Software. Results. In the sample, 41.7 % of participants were women, the median age was 66 years (IQR 58–75), 301 (83.6 %) patients were diagnosed with ischemic stroke (IS), the median of the baseline National Institutes of Health Stroke Scale score was 10 (IQR 6–17). High frequency of major vascular risk factors was documented: 82.2 % of individuals had arterial hypertension (AH), 36.4 % — atrial fibrillation, 28.6 % — diabetes mellitus, 30.6 % were obese, 14.7 % were current smokers, 16.4 % had alcohol abuse, and 23.3 % had recurrent CS. Their eGFR varied from 11.1 to 174.7 ml/min/1.73 m2 (median 87.8, IQR 62.5–98.5). Reduced eGFR was found in 55.0 % of patients, including 32.2 % with mild and 22.8 % with moderate or severe reduction. There were no significant differences in eGFR in different types of CS, but eGFR reduction was more often observed in cardioembolic IS compared to atherothrombotic one: 63.2 and 47.9 %, respectively (p < 0.05). According to the results of multivariate analysis, the patient’s age (odds ratio (OR) 1.02; 95% confidence interval (CI) 1.00–1.05, on average for each additional year, p = 0.044), male sex (OR 5.2; 95% CI 2.7–9.9; p < 0.001) and a history of AH (OR 2.7; 95% CI 1.2–6.4; p = 0.022) were independent predictors of moderate or severe eGFR reduction. The model built on these three variables was adequate, but the area under the curve of 0.70 (95% CI 0.65–0.75) indicates a moderate correlation. Conclusions. More than half of CS patients have renal dysfunction, and in almost 1/4 of cases, there is a moderate or severe decrease in eGFR (stages 3–5 of chronic kidney disease). Since AH is a predictor of a moderate or severe renal dysfunction in patients with MI, better control of AH (primarily with renin-angiotensin system inhibitors) can be an effective strategy to prevent severe chronic kidney disease.
мозковий інсульт; ренальна дисфункція; хронічна хвороба нирок; швидкість клубочкової фільтрації; профілактика
мозговой инсульт; ренальная дисфункция; хроническая болезнь почек; скорость клубочковой фильтрации; профилактика
cerebral stroke; renal dysfunction; chronic kidney disease; glomerular filtration rate; prevention
Вступ
Матеріали та методи
Результати
/21.jpg)
Обговорення
Висновки
- Campbell B.C.V., Khatri P. Stroke. Lancet. 2020 Jul 11. 396(10244). 129-142. doi: 10.1016/S0140-6736(20)31179-X.
- Global Burden of Disease Study 2019 (GBD 2019). Seattle, WA: Institute for Health Metrics and Evaluation (IHME), University of Washington, 2020. Available from: http://ghdx.healthdata.org/gbd-results-tool. Accessed: November 28, 2020.
- Kim J., Thayabaranathan T., Donnan G.A., Howard G., Howard V.J., Rothwell P.M. et al. Global Stroke Statistics 2019. Int. J. Stroke. 2020 Oct. 15(8). 819-838. doi: 10.1177/1747493020909545.
- Langhorne P., O’Donnell M.J., Chin S.L., Zhang H., Xavier D., Avezum A. et al. Practice patterns and outcomes after stroke across countries at different economic levels (INTERSTROKE): an international observational study. Lancet. 2018, May 19. 391(10134). 2019-2027. doi: 10.1016/S0140-6736(18)30802-X.
- Pandian J.D., Kalkonde Y., Sebastian I.A., Felix C., Urimubenshi G., Bosch J. Stroke systems of care in low-income and middle-income countries: challenges and opportunities. Lancet. 2020, Oct 31. 396(10260). 1443-1451. doi: 10.1016/S0140-6736(20)31374-X.
- Hanna R.M., Ferrey A., Rhee C.M., Kalantar-Zadeh K. Renal-Cerebral Pathophysiology: The Interplay Between Chronic Kidney Disease and Cerebrovascular Disease. J. Stroke Cerebrovasc. Dis. 2020. doi: 10.1016/j.jstrokecerebrovasdis.2020.105461.
- Lau W.L., Nunes A.C.F., Vasilevko V., Floriolli D., Lertpanit L., Savoj J. et al. Chronic kidney disease increases cerebral microbleeds in mouse and man. Transl. Stroke Res. 2020 Feb. 11(1). 122-134. doi: 10.1007/s12975-019-00698-8.
- Kajitani N., Uchida H.A., Suminoe I., Kakio Y., Kitagawa M., Sato H., Wada J. Chronic kidney disease is associated with carotid atherosclerosis and symptomatic ischaemic stroke. J. Int. Med. Res. 2018 Sep. 46(9). 3873-3883. doi: 10.1177/0300060518781619.
- Grams M.E., Yang W., Rebholz C.M., Wang X., Porter A.C., Inker L.A. et al.; CRIC Study Investigators. Risks of adverse events in advanced CKD: The Chronic Renal Insufficiency Cohort (CRIC) Study. Am. J. Kidney Dis. 2017 Sep. 70(3). 337-346. doi: 10.1053/j.ajkd.2017.01.050.
- Tsagalis G., Akrivos T., Alevizaki M., Manios E., Stamatellopoulos K., Laggouranis A., Vemmos K.N. Renal dysfunction in acute stroke: an independent predictor of long-term all combined vascular events and overall mortality. Nephrol. Dial. Transplant. 2009 Jan. 24(1). 194-200. doi: 10.1093/ndt/gfn471.
- Toyoda K., Ninomiya T. Stroke and cerebrovascular diseases in patients with chronic kidney disease. Lancet Neurol. 2014 Aug. 13(8). 823-33. doi: 10.1016/S1474-4422(14)70026-2.
- Chelluboina B., Vemuganti R. Chronic kidney disease in the pathogenesis of acute ischemic stroke. J. Cereb. Blood Flow Metab. 2019 Oct. 39(10). 1893-1905. doi: 10.1177/0271678X19866733.
- Masson P., Webster A.C., Hong M., Turner R., Lindley R.I., Craig J.C. Chronic kidney disease and the risk of stroke: a systematic review and meta-analysis. Nephrol. Dial. Transplant. 2015 Jul. 30(7). 1162-1169. doi: 10.1093/ndt/gfv009.
- Pereg D., Rozenbaum Z., Vorobeichik D., Shlomo N., Gilad R., Bloch S. et al. Prevalence and Significance of Unrecognized Renal Dysfunction in Patients with Stroke. Am. J. Med. 2016 Oct. 129(10). 1074-1081. doi: 10.1016/j.amjmed.2016.05.003.
- Rozenbaum Z., Leader A., Neuman Y., Shlezinger M., Goldenberg I., Mosseri M., Pereg D. Prevalence and Significance of Unrecognized Renal Dysfunction in Patients with Acute Coronary Syndrome. Am. J. Med. 2016 Feb. 129(2). 187-194. doi: 10.1016/j.amjmed.2015.08.017.
- Ding W.Y., Lip G.Y.H. Does Renal Function Predict Short- And Medium-Term Mortality and Hospital Readmissions in Poststroke Patients? Stroke. 2018 Dec. 49(12). 2812-2813. doi: 10.1161/STROKEAHA.118.023723.
- Ketteler M., Block G.A., Evenepoel P., Fukagawa M., Herzog C.A., McCann L. et al. Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder: Synopsis of the Kidney Disease: Improving Global Outcomes 2017 Clinical Practice Guideline Update. Ann. Intern. Med. 2018, Mar 20. 168(6). 422-430. doi: 10.7326/M17-2640.
- Bernhardt J., Hayward K.S., Kwakkel G., Ward N.S., Wolf S.L., Borschmann K. et al. Agreed definitions and a shared vision for new standards in stroke recovery research: The Stroke Recovery and Rehabilitation Roundtable taskforce. Int. J. Stroke. 2017 Jul. 12(5). 444-450. doi: 10.1177/1747493017711816.
- El Husseini N., Fonarow G.C., Smith E.E., Ju C., Sheng S., Schwamm L.H. et al. Association of kidney function with 30-day and 1-year poststroke mortality and hospital readmission: Get with The Guidelines-Stroke. Stroke. 2018 Dec. 49(12). 2896-2903. doi: 10.1161/STROKEAHA.118.022011.
- Hayden D., McCarthy C., Akijian L., Callaly E., Ni Chroinin D., Horgan G. et al. Renal dysfunction and chronic kidney disease in ischemic stroke and transient ischemic attack: a population-based study. Int. J. Stroke. 2017 Oct. 12(7). 761-769. doi: 10.1177/1747493017701148.
- Hao Z., Wu B., Lin S., Kong F.-Y., Tao W.-D., Wang D.-R., Liu M. Association Between Renal Function and Clinical Outcome in Patients with Acute Stroke. Eur. Neurol. 2010. 63(4). 237-242. doi: 10.1159/000285165.
- Zorrilla-Vaca A., Ziai W., Connolly E.S. Jr, Geocadin R., Thompson R., Rivera-Lara L. Acute Kidney Injury Following Acute Ischemic Stroke and Intracerebral Hemorrhage: A Meta-Analysis of Prevalence Rate and Mortality Risk. Cerebrovasc. Dis. 2018. 45(1–2). 1-9. doi: 10.1159/000479338.
- Hill N.R., Fatoba S.T., Oke J.L., Hirst J.A., O’Callaghan C.A., Lasserson D.S., Hobbs F.D.R. Global Prevalence of Chronic Kidney Disease – A Systematic Review and Meta-Analysis. PLoS One. 2016. 11(7). e0158765. doi: 10.1371/journal.pone.0158765.
- Herrington W.G., Preiss D., Haynes R., von Eynatten M., Staplin N., Hauske S.J. et al. The potential for improving cardio-renal outcomes by sodium-glucose co-transporter-2 inhibition in people with chronic kidney disease: a rationale for the EMPA-KIDNEY study. Clin. Kidney J. 2018 Dec. 11(6). 749-761. doi: 10.1093/ckj/sfy090.
- Yahalom G., Schwartz R., Schwammenthal Y., Merzeliak O., Toashi M., Orion D. et al. Chronic kidney disease and clinical outcome in patients with acute stroke. Stroke. 2009 Apr. 40(4). 1296-1303. doi: 10.1161/STROKEAHA.108.520882.
- Khatri R., Afzal M.R., Qureshi M.A., Maud A., Huanyu D., Jose Rodriguez G. Pre-Existing Renal Failure Increases In-Hospital Mortality in Patients with Intracerebral Hemorrhage. J. Stroke Cerebrovasc. Dis. 2019 Feb. 28(2). 237-242. doi: 10.1016/j.jstrokecerebrovasdis.2018.07.036.

/19.jpg)
/20.jpg)