Международный эндокринологический журнал Том 16, №7, 2020
Вернуться к номеру
Рівні маркерів метаболізму кісткової тканини (N-термінального пропептиду проколагену I типу та β-термінального телопептиду колагену I типу) в жителів Українизалежно від статі та віку
Авторы: Поворознюк В.В.(1), Паньків І.В.(2), Заверуха Н.В.(1), Солоненко Т.Ю.(1), Мусієнко А.С.(1)
(1) — ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
(2) — ВДНЗУ «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Метою дослідження є визначення рівня N-термінального пропептиду проколагену I типу (PINP) і карбокситермінального телопептиду колагену I типу (β-CTX) та їх взаємозв’язку в сироватці крові в здорового населення України різного віку та статі. Матеріали та методи. У дослідження було включено 3850 осіб віком 20–89 років (3351 жінка (середній вік 59,05 ± 13,89 року) та 499 чоловіків (49,17 ± 15,8 року)). Усіх учасників розподілили за віком відповідно до геронтологічної класифікації на 4 групи: молодий вік — 20–44 роки, середній — 45–59 років, літній — 60–74 роки та старечий вік — 75–89 років, а також на 7 груп за десятиріччями: від 20 до 89 років. Концентрацію β-CTX та PINP у сироватці крові визначали методом електрохемілюмінесцентного імуноаналізу ECLIA на аналізаторі cobas e 411. Результати. Виявлено вірогідний вплив віку на варіабельність β-CTX та PINP у чоловіків (F = 6,64, р < 0,001, та F = 4,93, р < 0,001) і жінок (F = 16,17, р < 0,001, та F = 10,46, р < 0,001). У жінок за критерієм Шеффе виявили вірогідно вищий рівень β-CTX у групі 80–89 років порівняно із групами 20–29 років (р = 0,01), 30–39 років (р < 0,001), 40–49 років (р < 0,001), 50–59 років (0,52 ± 0,27, р = 0,002), 60–69 років (р = 0,001) та 70–79 років (р = 0,04). Показники PINP у групі 80–89 років також були вірогідно вищими порівняно із групами 30–39 років (р < 0,001), 40–49 років (р < 0,001), 50–59 років (р = 0,009), 60–69 років (р = 0,002) та 70–79 років (р = 0,02). У чоловіків виявили вірогідне зниження концентрації β-CTX у групах: 30–39 років (р = 0,02), 40–49 років (р < 0,001), 50–59 років (р = 0,01) та 60–69 років (р = 0,001) порівняно із групою 20–29 років. Рівень PINP був вірогідно нижчим у групах 40–49 років (р < 0,001) та 50–59 років (р = 0,03) порівняно із групою 20–29 років. За результатами дослідження, коефіцієнт кореляції між показниками концентрації PINP та β-CTX змінюється залежно від віку та статі. Найвищі коефіцієнти кореляції серед обох статей спостерігалися у вікових групах 40–49 (жінки: r = 0,74; чоловіки: r = 0,64) та 50–59 (жінки: r = 0,74; чоловіки: r = 0,66) років; найнижчі коефіцієнти кореляції в жінок спостерігалися у віковій групі 20–29 (r = 0,63) та 70–79 (r = 0,65) років; у чоловіків (r = 0,53) віком 20–29 та 70–79 років. Висновки. Виявлено вірогідний вплив віку на варіабельність β-CTX та PINP у сироватці крові в чоловіків і жінок. Найвищий зв’язок між концентраціями β-CTX та PINP за коефіцієнтом кореляції спостерігався в групах 40–49 та 50–59 років серед обох статей. Отримані результати можуть бути використані в практично здорових чоловіків і жінок України як референтні, а в майбутньому будуть необхідними для вивчення метаболізму кісткової тканини при вторинному остеопорозі та його ускладненнях.
Целью исследования является определение уровня N-терминального пропептида проколлагена I типа (PINP) и карбокситерминального телопептида коллагена I типа (β-CTX) и их взаимосвязи в сыворотке крови у здорового населения Украины разного возраста и пола. Материалы и методы. В исследование было включено 3850 человек в возрасте 20–89 лет (3351 женщина (средний возраст 59,05 ± 13,89 года) и 499 мужчин (49,17 ± 15,8 года)). Всех участников распределили по возрасту в соответствии с геронтологической классификацией на 4 группы: молодой возраст — 20–44 года, средний — 45–59 лет, пожилой — 60–74 года и старческий возраст — 75–89 лет, а также на 7 групп по десятилетиям: от 20 до 89 лет. Концентрацию β-CTX и PINP в сыворотке крови определяли методом электрохемилюминесцентного иммуноанализа ECLIA на анализаторе cobas e 411. Результаты. Выявлено достоверное влияние возраста на вариабельность β-CTX и PINP у мужчин (F = 6,64, р < 0,001, и F = 4,93, р < 0,001) и женщин (F = 16,17, р < 0,001, и F = 10,46, р < 0,001). У женщин по критерию Шеффе обнаружили достоверно более высокий уровень β-CTX в группе 80–89 лет по сравнению с группами 20–29 лет (р = 0,01), 30–39 лет (р < 0,001), 40–49 лет (р < 0,001), 50–59 лет (0,52 ± 0,27, р = 0,002), 60–69 лет (р = 0,001) и 70–79 лет (р = 0,04). Показатели PINP в группе 80–89 лет также были достоверно выше в сравнении с группами 30–39 лет (р < 0,001), 40–49 лет (р < 0,001), 50–59 лет (р = 0,009), 60–69 лет (р = 0,002) и 70–79 лет (р = 0,02). У мужчин обнаружили достоверное снижение концентрации β-CTX в группах: 30–39 лет (р = 0,02), 40–49 лет (р < 0,001), 50–59 лет (р = 0,01) и 60–69 лет (р = 0,001) в сравнении с группой 20–29 лет. Уровень PINP был достоверно ниже в группах 40–49 лет (р < 0,001) и 50–59 лет (р = 0,03) в сравнении с группой 20–29 лет. По результатам исследования, коэффициент корреляции между показателями концентрации PINP и β-CTX изменяется в зависимости от возраста и пола. Самые высокие коэффициенты корреляции среди обоих полов наблюдались в возрастных группах 40–49 (женщины: r = 0,74; мужчины: r = 0,64) и 50–59 (женщины: r = 0,74; мужчины: r = 0,66) лет; низкие коэффициенты корреляции у женщин наблюдались в возрастной группе 20–29 (r = 0,63) и 70–79 (r = 0,65) лет; у мужчин (r = 0,53) в возрасте 20–29 и 70–79 лет. Выводы. Выявлено достоверное влияние возраста на вариабельность β-CTX и PINP в сыворотке крови у мужчин и женщин. Наиболее высокая корреляционная связь между концентрациями β-CTX и PINP наблюдалась в группах 40–49 и 50–59 лет среди обоих полов. Полученные результаты могут быть использованы у практически здоровых мужчин и женщин Украины как референтные, а в будущем будут необходимыми для изучения метаболизма костной ткани при вторичном остеопорозе и его осложнениях.
Background. The purpose was to determine the level of N-terminal of type I procollagen (PINP) and carboxy-terminal telopeptide of type I collagen (β-CTX) and their relationship in the serum of a healthy Ukrainian population of varying age and gender. Materials and methods. The study included 3,850 people aged 20–89 years (3,351 women (mean age 59.05 ± 13.89 years) and 499 men (49.17 ± 15.8 years). All participants were divided by age based on the gerontological age classification: young age 20–44 yrs, middle age 45–59 yrs, elderly 60–74 yrs, and old 75–89 yrs, and between 7 groups by decades: from 20 to 89. β-CTX and serum PINP concentrations were determined by electrochemiluminescence immunoassay ECLIA on a Cobas E411 analyzer. Results. We have detected a significant effect of age on serum β-CTX and PINP variability in men (F = 6.64, p < 0.001 and F = 4.93, p < 0.001) and women (F = 16.17, p < 0.001 and F = 10.46, p < 0.001, respectively). By Scheffe test detected a significantly higher level of β-CTX in the group of in women of 80–89 years compared with the groups of 20–29 years (p = 0.01), 30–39 years (p < 0.001), 40–49 years (p < 0.001), 50–59 years (0.52 ± 0.27, p = 0.002), 60–69 years (p = 0.001), and 70–79 years (p = 0.04). PINP rates in the group of 80–89 years were also significantly higher compared with the groups of 30–39 years (p < 0.001), 40–49 years (p < 0.001), 50–59 years (p = 0.009), 60–69 years (p = 0.002), and 70–79 years (p = 0.02). In men, a significant decrease in the concentration of β-CTX was revealed in the groups of: 30–39 years (p = 0.02), 40–49 years (p < 0.001), 50–59 years (p = 0.01), and 60–69 years (p = 0.001) compared with the group of 20–29 years. The level of PINP was significantly lower in the groups of 40–49 years (p < 0.001) and 50–59 years (p = 0.03) compared with the group of 20–29 years. According to the results of the study, the correlation coefficient between the concentration of PINP and β-CTX varies depending on age and sex. The highest correlation coefficients among both sexes were observed in the age groups of 40–49 years (women: r = 0.74; men: r = 0.64) and 50–59 (women: r = 0.74; men: r = 0.66); the lowest correlation coefficients were observed in women in the age group of 20–29 years (r = 0.63) and 70–79 (r = 0.65); in men (r = 0.53) aged 20–29 and 70–79 years. Conclusions. It was detected a significant effect of age on serum variability of β-CTX and PINP in men and women. The highest dependence of β-CTX concentration on PINP by the coefficient of determination was observed in the groups of 40–49 and 50–59 years among both genders. The results can be used as a reference in almost healthy men and women, which in the future will be used for the research of bone metabolism in secondary osteoporosis and its complications.
маркери метаболізму кісткової тканини; карбокситермінальний телопептид колагену I типу (β-CTX); N-термінальний пропептид проколагену I типу (PINP); вік; стать
маркеры метаболизма костной ткани; карбокситерминальный телопептид коллагена I типа (β-CTX) N-терминальный пропептид проколлагена I типа (PINP); возраст; пол
bone turnover markers; N-terminal propeptide of type I procollagen; carboxy-terminal telopeptide of type I collagen; age; gender
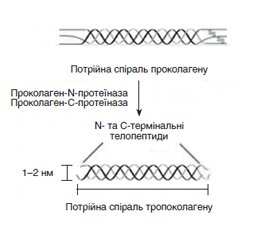
Вступ
Матеріали та методи
Результати
Обговорення
/19.jpg)
/19_2.jpg)
Висновки
- Williams C., Sapra A. Osteoporosis Markers [Updated 2020 Jun 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK559306/. StatPearls 2020.
- Kuo T.R., Chen C.H. Bone biomarker for the clinical assessment of osteoporosis: Recent developments and future perspectives. Biomark. Res. 2017. 5. 5-13. https://doi.org/10.1186/S40364-017-0097-4.
- Povorozniuk V.V., Zaverukha N.V., Solonenko T.Yu. Serum level of N-terminal propeptide of type I procollagen in people of various ages and gender. PAIN. JOINTS. SPINE. 2020. 10(1). doi: http://dx.doi.org/10.22141/2224-1507.10.1.2020.199719 (in Ukrainian).
- Cabral H.W., Andolphi B.F., Ferreira B.V., Alves D.C., Morelato R.L., Chambo A. Filho, Borges L.S. The use of biomarkers in clinical osteoporosis. Rev. Assoc. Med. Bras. (1992). 2016 Jul. 62(4). 368-76. doi: 10.1590/1806-9282.62.04.368.
- Bhattoa H.P. Laboratory aspects and clinical utility of bone turnover markers. EJIFCC. 2018. 29. 117-28.
- Burch J., Rice S., Yang H., Neilson A., Stirk L., Francis R. et al. Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: The secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technol. Assess. (Rockv.). 2014. 18. 1-180. https://doi.org/10.3310/hta18110.
- What causes osteoporosis ? Osteoporotic fractures Prevention, diagnosis and treatment. Publ. Int. Osteoporos Found n.d. https://www.iofbonehealth.org/what-is-osteoporosis.
- Szulc P., Naylor K., Hoyle N.R., Eastell R., Leary E.T. Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Osteoporos. Int. 2017. 28. 2541-56. https://doi.org/10.1007/s00198-017-4082-4.
- Tian A., Ma J., Feng K., Liu Z., Chen L., Jia H. et al. Reference markers of bone turnover for prediction of fracture: A meta-analysis. J. Orthop. Surg. Res. 2019. 14. 4-13. https://doi.org/10.1186/s13018-019-1100-6.
- Eastell R., Pigott T., Gossiel F., Naylor K.E., Walsh J.S., APeel N.F. Bone turnover markers: Are they clinically useful? Eur. J. Endocrinol. 2018. 178. R19-31. https://doi.org/10.1530/EJE-17-0585.
- Coates P. Bone turnover markers. Aust. Fam. Physician. 2013. 42. 285-7.
- Kraus V.B., Blanco F.J., Englund M. et al. OARSI clinical trials recommendations: soluble biomarker assessments in clinical trials in osteoarthritis. Osteoarthr. Cartil. 2015. 23(5). 686-697. doi: 10.1016/j.joca.2015.03.002.
- Micheel C.M., Ball J.R. Evaluation of biomarkers and surrogate endpoints in chronic disease. 2010. doi: 10.17226/12869.
- Abril D.W. Mechanical behavior of individual type I collagen fibrils. Rev. Bras. Ergon. 2016. 9. 10.
- Burch J., Rice S., Yang H. et al. Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: the secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technol. Assess. (Rockv.). 2014. 18(11). 1-180. doi: 10.3310/hta18110.
- Shoulders M.D., Raines R.T. Collagen structure and stability. Annu. Rev. Biochem. 2009. 78. 929-58. https://doi.org/10.1146/annurev.biochem.77.032207.120833.
- Sonia A., Talwar M. Bone markers in osteoporosis. Medscape. 2020. 7. 84-90. https://doi.org/10.1007/s11914-009-0014-3.
- Shetty S., Kapoor N., Bondu J., Thomas N., Paul T. Bone turnover markers: Emerging tool in the management of osteoporosis. Indian J. Endocrinol. Metab. 2016. 20. 846-52. https://doi.org/10.4103/2230-8210.192914.
- Vasikaran S., Eastell R., Bruyère O., Foldes A.J., Garnero P., Griesmacher A. et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: A need for international reference standards. Osteoporos. Int. 2011. 22. 391-420. https://doi.org/10.1007/s00198-010-1501-1.
- Chubb S.A.P. Measurement of C-terminal telopeptide of type I collagen (CTX) in serum. Clin. Biochem. 2012. 45. 928-35. https://doi.org/10.1016/j.clinbiochem.2012.03.035.
- Camacho P.M., Petak S.M., Binkley N., Diab D.L., Eldeiry L.S., Farooki A. et al. American association of clinical endocrinologists/American college of endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis-2020 update. Endocr. Pract. 2020. 26. 1-46. https://doi.org/10.4158/GL-2020-0524SUPPL.
- Kanis J.A., Cooper C., Rizzoli R., Reginster J.Y. Correction to: European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos. Int. 2020. 31. 209. https://doi.org/10.1007/s00198-019-05184-3.
- Chapurlat R.D. Bone turnover markers in clinical practice. World Congr. Osteoporosis, Osteoarthr. Musculoskelet Dis. Virtual Congr. August WCO IOF ESCEO. 2020. 20-22.
- Kanis J.A., Johansson H., Harvey N.C., McCloskey E.V. A brief history of FRAX. Arch. Osteoporos. 2018. 13. 118. https://doi.org/10.1007/s11657-018-0510-0.
- National institute for health and care excellence (NICE). National institute for health and care excellence Health and social care directorate Quality standards and indicators Briefing paper. 2017. 1-45.
- Eastell R., Black D.M., Lui L., Chines A., Marin F., Khosla S. et al. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Antiresorptive Drugs: Proportion of Treatment Effect Explained. J. Bone Miner. Res. 2020. 44. https://doi.org/10.1002/jbmr.4178.
- Bauer D.C., Black D.M., Bouxsein M.L., Lui L.Y., Cauley J.A., de Papp A.E. et al. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Anti-Resorptive Drugs: A Meta-Regression. J. Bone Miner. Res. 2018. 33. 634-42. https://doi.org/10.1002/jbmr.3355.
- Crandall C.J., Vasan S., LaCroix A., LeBoff M.S., Cauley J.A., Robbins J.A. et al. Bone Turnover Markers Are Not Associated With Hip Fracture Risk: A Case-Control Study in the Women’s Health Initiative. J. Bone Miner. Res. 2018. 33. 1199-208. https://doi.org/10.1002/jbmr.3471.
- Diez-Perez A., Naylor K.E., Abrahamsen B., Agnusdei D., Brandi M.L., Cooper C. et al. International Osteoporosis Foundation and European Calcified Tissue Society Working Group. Recommendations for the screening of adherence to oral bisphosphonates. Osteoporos. Int. 2017. 28. 767-74. https://doi.org/10.1007/s00198-017-3906-6.
- Gutierrez-Buey G., Restituto P., Botella S., Monreal I., Colina I., Rodríguez-Fraile M. et al. Trabecular bone score and bone remodelling markers identify perimenopausal women at high risk of bone loss. Clin. Endocrinol. (Oxf.). 2019. 91. 391-9. https://doi.org/10.1111/cen.14042.
- Verroken C., Zmierczak H., Goemaere S., Kaufman J., Lapauw B. Bone Turnover in Young Adult Men : Cross-Sectional Determinants and Associations With Prospectively. J. Bone Miner. Res. 2017. 33. 261-8. https://doi.org/10.1002/jbmr.3303.
- Lorentzon M., Branco J., Brandi M.L., Bruyère O., Chapurlat R., Cooper C. et al. Algorithm for the Use of Biochemical Markers of Bone Turnover in the Diagnosis, Assessment and Follow-Up of Treatment for Osteoporosis. Adv. Ther. 2019. 36. 2811-24. https://doi.org/10.1007/s12325-019-01063-9.
- Cooper C., Ferrari S. IOF Compendium of Osteoporosis. Int. Osteoporos. Found. 2019. 2nd Editio. 1-76.
- Chapurlat R.D. Bone turnover markers in clinical practice. WCO-IOF-ESCEO 2020. Plenary Lect. 1, Thursday, 20 August 2020. Channel 1. 2020.

/14.jpg)
/15.jpg)
/16.jpg)
/16_2.jpg)
/17.jpg)
/18.jpg)