Международный эндокринологический журнал Том 16, №7, 2020
Вернуться к номеру
Лейкоцитарный состав и индекс соотношения нейтрофилов и лимфоцитов в крови у больных с впервые выявленным сахарным диабетом 2-го типа в зависимости от величины избыточной массы тела/ожирения
Авторы: Фурманова О.В., Зак К.П., Попова В.В., Тронько Н.Д.
ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
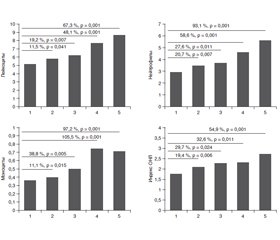
Актуальність. Згідно з сучасними уявленнями, цукровий діабет 2-го типу (ЦД-2) є хронічним низькоградієнтним запаленням. Майже у 80 % хворих ЦД-2 супроводжується ожирінням. Однак такі важливі біомаркери запалення, як лейкоцитарний склад крові й індекс запалення ВНЛ (відношення абсолютного числа нейтрофілів до абсолютного числа лімфоцитів у периферичній крові), у хворих із вперше виявленим ЦД-2 з різним ступенем ожиріння залишаються маловивченими. Мета — вивчення лейкоцитарного складу периферичної крові та індексу запалення ВНЛ у негематологічних хворих із вперше виявленим ЦД-2 залежно від різної маси тіла. Матеріали та методи. Обстежено 108 хворих із вперше діагностованим ЦД-2 віком 40–70 років і 50 нормоглікемічних осіб із різним індексом маси тіла (ІМТ). Загальну кількість лейкоцитів, лейкоцитарний склад крові визначали за допомогою гематологічних аналізаторів і підрахунку в мазках крові на 200 лейкоцитів. Індекс запалення ВНЛ обчислювався шляхом ділення абсолютної кількості нейтрофілів на кількість лімфоцитів. Результати. Для хворих на ЦД-2 характерне невелике, але вірогідне збільшення загальної кількості лейкоцитів, абсолютної кількості нейтрофілів і моноцитів та індексу ВНЛ. При розподілі всієї групи хворих на ЦД і здорових осіб на чотири підгрупи залежно від величини маси тіла було виявлено, що лейкоцитоз, нейтрофільоз, моноцитоз і індекс ВНЛ у хворих на ЦД корелювали з величиною ІМТ. При ІМТ ≤ 25,5 кг/м2 кількість лейкоцитів у хворих на ЦД порівняно з показником здорових осіб була підвищена на 11,5 %, нейтрофілів — на 20,7 %, моноцитів — на 11,1 % й індекс ВНЛ — на 19,4 %. При ІМТ 25,9–29,9 кг/м2 кількість лейкоцитів була підвищена на 19,2 %, нейтрофілів — на 27,6 %, моноцитів — на 38,8 % та індекс ВНЛ — на 29,7 %. При ІМТ 30,0–34,9 кг/м2 кількість лейкоцитів була вірогідно підвищена на 48,1 %, нейтрофілів — на 58,6 %, моноцитів — на 105 % та індекс ВНЛ — на 32,6 %, а при ІМТ > 35 кг/м2 лейкоцити збільшилися на 67,3 %, нейтрофіли — на 93 %, моноцити — на 97 % та індекс ВНЛ — на 54,9 %. У здорових осіб спостерігали подібні зміни залежно від лейкоцитарного складу і величини ІМТ, але менш виражені. Висновки. Рівень лейкоцитозу, нейтрофільозу, моноцитозу й індексу ВНЛ у хворих на ЦД-2 багато в чому залежить також і від величини їхньої маси тіла, особливо при ожирінні. При ожирінні відбувається посилення запального процесу шляхом підсумовування чинників, специфічних для патогенезу ЦД-2 і надлишкової маси тіла, що необхідно враховувати при виборі терапії у хворих на ЦД-2, ускладнений ожирінням.
Актуальность. Согласно современным представлениям, сахарный диабет 2-го типа (СД-2) является хроническим низкоградиентным воспалением. Почти у 80 % больных СД-2 сопровождается ожирением. Однако такие важные биомаркеры воспаления, как лейкоцитарный состав крови и индекс воспаления ОНЛ (отношение абсолютного числа нейтрофилов к абсолютному числу лимфоцитов в периферической крови), у первичных больных СД-2 с различной степенью ожирения остаются малоизученными. Цель — исследование лейкоцитарного состава периферической крови и индекса воспаления ОНЛ у нелеченых больных с впервые выявленным СД-2 в зависимости от величины массы тела. Материалы и методы. Обследовано 108 больных с впервые диагностированным СД-2 и 50 нормогликемических лиц с различным индексом массы тела (ИМТ). Общее количество лейкоцитов, лейкоцитарный состав крови определялись с помощью гематологических анализаторов и подсчета в мазках крови на 200 лейкоцитов. Индекс воспаления ОНЛ вычислялся путем деления абсолютного количества нейтрофилов на количество лимфоцитов. Результаты. Для больных СД-2 характерно небольшое, но достоверное увеличение общего количества лейкоцитов, абсолютных количеств нейтрофилов и моноцитов и индекса ОНЛ. При разделении общей группы больных СД-2 на четыре подгруппы в зависимости от величины ИМТ было обнаружено, что лейкоцитоз, нейтрофилез, моноцитоз и индекс ОНЛ у больных СД-2 коррелировали с величиной ИМТ. При ИМТ ≤ 25,5 кг/м2 количество лейкоцитов у больных СД-2 по сравнению со здоровыми было достоверно повышено на 11,5 %, нейтрофилов — на 20,7 %, моноцитов — на 11,1 % и индекс ОНЛ — на 19,4 %. При ИМТ 25,9–29,9 кг/м2 количество лейкоцитов было повышенным на 19,2 %, нейтрофилов — на 27,6 %, моноцитов — на 38,8 % и индекс ОНЛ — на 29,7 %. При ИМТ 30,0–34,9 кг/м2 количество лейкоцитов было повышенным на 48,1 %, нейтрофилов — на 58,6 %, моноцитов — на 105 % и индекс ОНЛ — на 32,6 %, а при ИМТ > 35 кг/м2 лейкоциты увеличились на 67,3 %, нейтрофилы — на 93 %, моноциты — на 97 % и индекс ОНЛ — на 54,9 %. У здоровых лиц наблюдали подобные изменения зависимости лейкоцитарного состава от величины ИМТ, но менее выраженные. Выводы. Уровень лейкоцитоза, нейтрофилеза, моноцитоза и индекса ОНЛ у больных СД-2 во многом зависит от величины их массы тела, особенно от ожирения. При ожирении происходит усиление воспалительного процесса путем суммирования факторов, специфичных для патогенеза СД-2 и избыточной массы тела, что необходимо учитывать при выборе терапии у больных СД-2, осложненным ожирением.
Background. According to the current hypothesis, type 2 diabetes mellitus (T2DM) is chronic low-gradient inflammation. Almost 80 % of patients with type 2 diabetes are obese. However, such important biomarkers of inflammation as the leukocyte composition of the blood and the neutrophil-to-lymphocyte ratio (NLR) in patients with newly diagnosed type T2DM and varying degrees of obesity remain poorly understood. The purpose was to study the leukocyte composition and the index of inflammation NLR in non-hematological patients with newly diagnosed type 2 diabetes, depending on different body weights. Materials and methods. The study involved 108 patients with newly diagnosed T2DM aged 40–70 years and 50 normoglycemic individuals with different body mass index (BMI). The total number of blood leukocytes was determined using a hematological analyzer, and the leukocyte composition was determined both with an analyzer and in blood smears stained according to the Pappenheim staining method using a cacodylate buffer (Ph 6.85) per 200 identified cells. The index of inflammation NLR was calculated by dividing the absolute neutrophil count by the lymphocyte count. Results. Compared to healthy people, T2DM patients are characterized by a small but significant (p < 0.05) increase in the total number of leukocytes, the absolute number of neutrophils and monocytes, and the index of inflammation NLR. When dividing the entire group of T2DM patients and healthy individuals into four subgroups, depending on the body weight, it was found that leukocytosis, neutrophilia, monocytosis, and the NLR index in patients with T2DM correlated with the BMI value. At BMI ≤ 25.5 kg/m2, the number of leukocytes in T2DM patients compared with those in healthy individuals was increased by 11.5 %, neutrophils by 20.7 % (p = 0.007), monocytes by 11.1 %, and the NLR index by 19.4 %. With a BMI of 25.9–29.9 kg/m2, the number of leukocytes was increased by 19.2 %, neutrophils by 27.6 %, monocytes by 38.8 %, and the NLR index by 29.7 %. With a BMI of 30.0–34.9 kg/m2, the number of leukocytes was significantly increased by 48.1 %, neutrophils by 58.6 %, monocytes by 105 %, and the index NLR by 32.6 %; and with BMI > 35 kg/m2, leukocytes were increased by 67.3 %, neutrophils by 93 %, monocytes by 97 %, and the index of inflammation NLR by 54.9 %. In healthy individuals, similar changes were observed depending on the leukocyte composition and BMI but less pronounced. Conclusions. The level of leukocytosis, neutrophilia, monocytosis, and the index of inflammation NLR in T2DM patients also largely depends on their body weight, especially obesity. In obesity, the inflammatory process is intensified by summing factors specific to the pathogenesis of T2DM and overweight, this must be taken into account when choosing therapy in patients with type 2 diabetes mellitus, complicated by obesity.
цукровий діабет 2-го типу; імунітет; запалення; лейкоцитарний склад крові
сахарный диабет 2-го типа; иммунитет; воспаление; лейкоцитарный состав крови
type 2 diabetes mellitus; immunity; inflammation; blood leukocyte composition
Введение
Материалы и методы
Результаты и обсуждение
Выводы
- IDF Diabetes Atlas, 8th edition. 2017. http://www.diabetesatlas.org/
- Standards of Medical Care in Diabetes — 2020. American Diabetes Association. Clinical Diabetes. 2020. 38 (1). 10-38. https://doi.org/10.2337/cd20-as01.
- Tron’ko N.D., Zak K.P. Modern advances in clinical pathophysiology in the study of the pathogenesis of type 1 and 2 diabetes mellitus in humans. Mìžnarodnij endokrinologìčnij žurnal. 2019. 15 (6). 422-34. DOI: https://doi.org/10.22141/2224-0721.15.6.2019.185403 (in Russian).
- Donath M.Y. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes. Diabetologia. 2016. 59 (4). 679-82. https://doi.org/10.1007/s00125-016-3873-z.
- Netea M.G., Balkwill F., Chonchol M., Cominelli F., Donath M.Y., Giamarellos-Bourboulis E.J. et al. A guiding map for inflammation. Nat. Immunol. 2017. 18 (8). 826-31. doi: 10.1038/ni.3790.
- Pearson E.R. Type 2 diabetes: a multifaceted disease. Diabetologia. 2019. 62 (7). 1107-12. doi: 10.1007/s00125-019-4909-y.
- Pollack R.M., Donath M.Y., LeRoith D., Leibowitz G. Anti-inflammatory agents in the treatment of diabetes and its vascular complications. Diabetes Care. 2016. 39 (Suppl 2). Р. 244-52. doi: 10.2337/dcS15-3015.
- Jiang G., Luk A.O., Tam C.H.T., Lau E.S., Ozaki R. et al. Obesity, clinical, and genetic predictors for glycemic progression in Chinese patients with type 2 diabetes: A cohort study using the Hong Kong Diabetes Register and Hong Kong Diabetes Biobank. PLOS Medicine. 2020. 17 (7). e1003209. https://doi.org/10.1371/journal.pmed.1003209
- Di Angelantonio E., Bhupathiraju Sh.N., Wormser D., Gao P., Kaptoge S. et al.; Global BMI Mortality Collaboration. Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents. Lancet. 2016. 388 (10046). 776-86. doi: 10.1016/S0140-6736 (16)30175-1.
- Nolan J.J., Færch K. Estimating insulin sensitivity and beta cell function: perspectives from the modern pandemics of obesity and type 2 diabetes. Diabetologia. 2012. 55 (11). 2863-7. doi: 10.1007/s00125-012-2684-0.
- Ford E.S. Leukocyte count, erythrocyte sedimentation rate, and diabetes incidence in a national sample of US adults. Am. J. Epidemiol. 2002. 155 (1). 57-64. doi: 10.1093/aje/155.1.57.
- Shitole S.G., Biggs M.L., Reiner A.P., Mukamal K.J., Djousse L., Ix J.H. et al., Soluble CD14 and CD14 variants, other inflammatory markers and glucose dysregulation in older adults: The Cardiovascular Health Study. Diabetes Care. 2019. 42 (11). 2075-2082. DOI: 10.2337/dc19-0723
- Wannamethee S.G., Papacosta O., Lawlor D.A., Whincup P.H., Lowe G.D., Ebrahim S., Sattar N. Do women exhibit greater differences in established and novel risk factors between diabetes and non-diabetes than men? The British Regional Heart Study and British Women’s Heart Health Study. Diabetologia. 2012. 55 (1). 80-7. doi: 10.1007/s00125-011-2284-4.
- Muntner P., Shimbo D., Carey R.M., Charleston J.B., Gaillard T., Misra S. et al. Measurement of Blood Pressure in Humans: A Scientific Statement from the American Heart Association. Hypertension. 2019. 73 (5). e35-e66. doi: 10.1161/HYP.0000000000000087.
- Saenko Ya.A., Zak K.P., Popova V.V., Semionova T.A. Leukocyte composition and immunophenotype of blood lymphocytes in women with type 2 diabetes mellitus with obesity. Mìžnarodnij endokrinologìčnij žurnal. 2016. 5 (77). 13-9 (in Russian). DOI: https://doi.org/10.22141/2224-0721.5.77.2016.78748
- Scherer P.E. The multifaceted roles of adipose tissue — therapeutic targets for diabetes and beyond: The 2015 Banting Lecture. Diabetes. 2016. 65 (6). 1452-61. doi: 10.2337/db16-0339.
- Zhao S., Kusminski C.M., Elmquist J.K., Scherer P.E. Leptin: Less is more. Diabetes. 2020. 69 (5). 823-9. doi: 10.2337/dbi19-0018.
- Cariou B., Hadjadj S., Wargny M., Pichelin M., Al-Salameh A., Allix I. et al. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study. Diabetologia. 2020. 63 (8). 1500-15. doi: 10.1007/s00125-020-05180-x.
- Mauvais-Jarvis F. Aging, male sex, obesity, and metabolic inflammation create the perfect storm for COVID-19. Diabetes. 2020. 69 (9). 1857-63. DOI: 10.2337/dbi19-0023.
- Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020. 395 (10223). 497-506. doi: 10.1016/S0140-6736 (20)30183-5.
- McGonagle D., Sharif K., O'Regan A., Bridgewood C. The role of cytokines including interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease. Autoimmun Rev. 2020. 19 (6). 102537. doi: 10.1016/j.autrev.2020.102537.
- Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J. HLH Across Specialty Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020. 395 (10229). 1033-4. doi. 10.1016/S0140-6736 (20)30628-0.

/26.jpg)
/27.jpg)
/28.jpg)
/28_2.jpg)