Журнал «Здоровье ребенка» Том 15, №7, 2020
Вернуться к номеру
Прогностическое значение ренальной оксигенации в первые сутки жизни у недоношенных детей с гемодинамически значимым открытым артериальным протоком в ранней диагностике острого повреждения почек
Авторы: Борисова Т.П., Оболонская О.Ю.
ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»,
г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Гемодинамічно значуща відкрита артеріальна протока (ГЗВАП) призводить до феномену «обкрадання» великого кола кровообігу та гіпоперфузії нирок, що може сприяти розвитку гострого пошкодження нирок (ГПН) у недоношених новонароджених. Вивчення ренальної оксигенації в першу добу життя методом спектроскопії в ближній інфрачервоній ділянці може виявитися корисним для визначення групи ризику щодо розвитку ГПН у даних пацієнтів. Мета дослідження: оцінити прогностичну значущість ренальної оксигенації в першу добу життя у недоношених дітей з ГЗВАП у ранній діагностиці ГПН. Матеріали та методи. Обстежено 74 недоношені дитини (гестаційний вік 29–36 тижнів), що знаходились на лікуванні у відділенні анестезіології та інтенсивної терапії новонароджених із першої доби життя. Пацієнти були розподілені на три групи залежно від наявності відкритої артеріальної протоки (ВАП) та її гемодинамічної значущості: І група — 40 дітей із ГЗВАП, ІІ група — 17 дітей із ВАП без гемодинамічних розладів, ІІІ група — 17 дітей з закритою артеріальною протокою (ЗАП). У кожній групі виділені підгрупи з наявністю або відсутністю ГПН. Клінічне обстеження та лікування недоношених новонароджених здійснювались за загальноприйнятою методикою. Ехокардіографія з допплерометрією виконувалася на 5–11-й годині життя. Діагностика та стратифікація ступеня тяжкості ГПН проводились за критеріями неонатальної модифікації KDIGO, для чого вивчались концентрація сироваткового креатиніну та рівень діурезу. Регіональну оксигенацію в нирках (RrSO2) контролювали за допомогою спектроскопії в ближньому інфрачервоному діапазоні протягом доби. Результати. ГПН на третю добу життя було діагностовано у 52,5 % дітей із ГЗВАП, що в 2,2 раза частіше, ніж у дітей з ВАП без гемодинамічної значущості (р < 0,05), і в 4,4 раза частіше, ніж із ЗАП (р < 0,007). На п’яту добу життя ГПН виявлено ще у двох дітей із ГЗВАП, і загальна кількість збільшилася до 57,5 %. У групах дітей із ВАП без гемодинамічних розладів і ЗАП на третій і п’ятий день життя було лише ГПН І ступеня, тоді як у дітей із ГЗВАП спостерігалися ІІ–ІІІ ступені ГПН. Ренальна оксигенація в першу добу життя була нижчою за 68 % в основному в дітей із ГЗВАП + ГПН. У дітей зі ГЗВАП, у яких розвинулося ГПН на третю добу життя, показник RrSO2 в першу добу життя становив 56,1 ± 4,5 % проти 63,90 ± 9,72 % у дітей без ГПН (p < 0,01). Встановлена обернена кореляційна залежність між показником RrSO2 в перший день життя і концентрацією креатиніну крові на третій день життя (ρ = –0,434; р < 0,02). Висновки. Низька ренальна оксигенація при ближній інфрачервоній спектроскопії в першу добу життя пов’язана з розвитком гострого пошкодження нирок на третю добу життя у недоношених дітей із ГЗВАП.
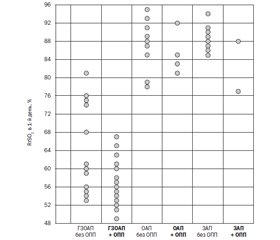
Актуальность. Гемодинамически значимый открытый артериальный проток (ГЗОАП) приводит к феномену «обкрадывания» большого круга кровообращения и гипоперфузии почек, что может способствовать развитию острого повреждения почек (ОПП) у недоношенных новорожденных. Изучение ренальной оксигенации в первый день жизни методом спектроскопии в ближней инфракрасной области может оказаться полезным для определения группы риска по развитию ОПП у этих пациентов. Цель исследования: оценить прогностическую значимость ренальной оксигенации в первые сутки жизни у недоношенных детей с ГЗОАП для ранней диагностики ОПП. Материалы и методы. Обследовано 74 недоношенных ребенка (гестационный возраст 29–36 недель), которые находились на лечении в отделении анестезиологии и интенсивной терапии новорожденных. Пациенты были разделены на три группы в зависимости от наличия открытого артериального протока (ОАП) и его гемодинамической значимости: I группа — 40 детей с ГЗОАП, II группа — 17 детей с ОАП без гемодинамических расстройств, III группа — 17 детей с закрытым артериальным протоком (ЗАП). В каждой из групп выделены подгруппы с наличием или отсутствием ОПП. Клиническое обследование и лечение недоношенных новорожденных осуществлялось по общепринятой методике. Диагностика и стратификация степени тяжести ОПП проводились по критериям неонатальной модификации KDIGO, для чего изучались концентрация сывороточного креатинина и уровень диуреза. Эхокардиография с допплерометрией выполнялась в 5–11 часов жизни. Региональную оксигенацию в почках (RrSO2) контролировали с помощью спектроскопии в ближнем инфракрасном диапазоне. Результаты. ОПП на третьи сутки жизни было диагностировано у 52,5 % детей с ГЗОАП, что в 2,2 раза чаще, чем у детей с ОАП без гемодинамической значимости (р < 0,05), и в 4,4 раза чаще, чем с ЗАП (р < 0,007). На пятые сутки жизни ОПП выявлено еще у двух детей с ГЗОАП, и общее количество увеличилось до 57,5 %. В группах детей с ОАП без гемодинамических расстройств и ЗАП на третий и пятый дни жизни имела место только ОПП І степени, в то время как у детей с ГЗОАП наблюдалась ІІ–ІІІ степень ОПП. Ренальная оксигенация в первые сутки жизни была ниже 68 % в основном у детей с ГЗОАП + ОПП. Крайне низкие уровни RrSO2 в первые сутки, ассоциированные с развитием ОПП на третьи сутки, в выборке ГЗОАП + ОПП составили 49–52 %. У детей с ГЗОАП с развившимся к третьим суткам жизни ОПП показатель RrSO2 в первые сутки жизни составил 56,1 ± 4,5 % против 63,90 ± 9,72 % у детей без ОПП (p < 0,01). Установлена обратная корреляционная зависимость между показателем RrSO2 в первый день жизни и концентрацией креатинина крови на третий день жизни (ρ = –0,434; р < 0,02). Выводы. Низкая ренальная оксигенация при ближней инфракрасной спектроскопии в первые сутки жизни связана с развитием острого повреждения почек на третьи сутки жизни у недоношенных детей с ГЗОАП.
Background. Hemodynamically significant patent ductus arteriosus (HSPDA) leads to the phenomenon of “stealing” the systemic circulation and renal hypoperfusion, which can contribute to the development of acute kidney injury (AKI) in premature infants. Near-infrared spectroscopy (NIRS) method of renal oxygenation measurement on the first day of life may be useful in identifying the risk group for AKI in these patients. The study aimed to assess the prognostic value of renal oxygenation in the first day of life in premature infants with HSPDA in the early diagnosis of AKI. Materials and methods. We examined 74 premature babies (gestational age 29–36 weeks) who were treated in the Department of Anesthesiology and Intensive Care of Newborns. The patients were divided into three groups depending on the presence of a patent ductus arteriosus (PDA) and its hemodynamic significance: group I — 40 children with HSPDA, group II — 17 children with PDA without hemodynamic disorders, group III — 17 children with a closed arterial duct (CAD). In each of the groups, subgroups were identified: with the presence or absence of AKI. Clinical examination and treatment of premature infants were carried out according to the generally accepted routine. Diagnosis and stratification of AKI severity were carried out according to the criteria of neonatal modification KDIGO, for which the concentration of serum creatinine and the level of urine output were studied. Doppler echocardiography was performed at 5–11 hours of life. Regional renal oxygenation (RrSO2) was monitored using spectroscopy in the near-infrared range. Results. AKI on the third day of life was diagnosed in 52.5 % of children with HSPDA, which is 2.2 times more often than in children with PDA without hemodynamic significance (p < 0.05) and 4.4 times more often than in individuals with CAD (p < 0.007). On the fifth day of life, AKI was detected in two more children with HSPDA, and the total number increased to 57.5 %. In the groups of children with PDA without hemodynamic disorders and CAD, on the third and fifth days of life, only I grade AKI was registered. Whereas, children with HSPDA had II–III grade AKI. Renal oxygenation on the first day of life was below 68 %, mainly in children with HSPDA + AKI. Extremely low levels of RrSO2 on the first day, associated with the development of AKI on the third day, in the group of HSPDA + AKI were registered in 49–52 %. In children with HSPDA who developed AKI by the third day of life, the RrSO2 index on the first day of life was 56.1 ± 4.5 % versus 63.9 ± 9.72 % in children without AKI (p < 0.01). An inverse correlation was established between the RrSO2 indicator on the first day of life and the blood creatinine concentration on the third day of life (ρ = –0.434, p < 0.02). Conclusions. Low renal oxygenation on near-infrared spectroscopy on the first day of life is associated with the development of acute kidney injury on the third day of life in premature infants with HSPDA.
недоношені діти; гемодинамічно значуща відкрита артеріальна протока; гостре пошкодження нирок; ренальна оксигенація
недоношенные дети; гемодинамически значимый открытый артериальный проток; острое повреждение почек; ренальная оксигенация
premature infants; hemodynamically significant patent ductus arteriosus; acute kidney injury; renal oxygenation
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
- Jetton J.G., Boohaker L.J., Sethi S.K., Wazir S., Rohatgi S., Soranno D.E., et al. Incidence and outcomes of neonatal acute kidney injury (AWAKEN): a multicentre, multinational, observational cohort study. Lancet Child Adolesc. Health. 2017 Nov. 1 (3). 184-194. doi: 10.1016/S2352-4642 (17)30069-X.
- Majed B., Bateman D.A., Uy N., Lin F. Patent ductus arteriosus is associated with acute kidney injury in the preterm infant. Pediatr. Nephrol. 2019 Jun. 34 (6). 1129-1139. doi: 10.1007/s00467-019-4194-5.
- Velazquez D.M., Reidy K.J., Sharma M., Kim M., Vega M., Havranek T. The effect of hemodynamically significant patent ductus arteriosus on acute kidney injury and systemic hypertension in extremely low gestational age newborns. J. Matern. Fetal. Neonatal. Med. 2019 Oct. 32 (19). 3209-3214. doi: 10.1080/14767058.2018.1460349.
- Seo E.S., Sung S.I., Ahn S.Y., Chang Y.S., Park W.S. Changes in Serum Creatinine Levels and Natural Evolution of Acute Kidney Injury with Conservative Management of Hemodynamically Significant Patent Ductus Arteriosus in Extremely Preterm Infants at 23–26 Weeks of Gestation. J. Clin. Med. 2020 Mar. 4. 9 (3). 699. doi: 10.3390/jcm9030699.
- Stojanovic V., Barisic N., Milanovic B., Doronjski A. Acute kidney injury in preterm infants admitted to a neonatal intensive care unit. Pediatr. Nephrol. 2014. 29. 2213-2220. doi: 10.1007/s00467-014-2837-0.
- Coffman Z., Steflik D., Chowdhury S.M., Twombley K., Buckley J. Echocardiographic predictors of acute kidney injury in neonates with a patent ductus arteriosus. J. Perinatol. 2020 Mar. 40 (3). 510-514. doi: 10.1038/s41372-019-0560-1.
- Rios D.R., Bhattacharya S., Levy P.T., McNamara P.J. Circulatory Insufficiency and Hypotension Related to the Ductus Arteriosus in Neonates. Front. Pediatr. 2018. 6. 62. doi. 10.3389/fped.2018.00062.
- Clyman R.I., Couto J., Murphy G.M. Patent ductus arteriosus: are current neonatal treatment options better or worse than no treatment at all? Semin. Perinatol. 2012. 36 (2). 123-129. doi. 10.1053/j.semperi.2011.09.022.
- El Hajjar M., Vaksmann G., Rakza T., Kongolo G., Storme L. Severity of the ductal shunt: a comparison of different markers. Arch. Dis. Child Fetal. Neonatal. Ed. 2005. 90 (5). F419-422. doi: 10.1136/adc.2003.027698.
- Slaughter J.L., Cua C.L., Notestine J.L. et al. Early prediction of spontaneous Patent Ductus Arteriosus.(PDA) closure and PDA-associated outcomes: a prospective cohort investigation. BMC Pediatr. 2019. 19 (1). 333. doi: 10.1186/s12887-019-1708-z.
- Selewski D.T., Charlton J.R., Jetton J.G., Guillet R., Mhanna M.J., Askenazi D.J., et al. Neonatal Acute Kidney Injury. Pediatrics. 2015 Aug. 136 (2). e463-473. doi: 10.1542/peds.2014-3819.
- Годованець Ю.Д., Бабінцева А.Г., Нікорич С.І. Гостре пошкодження нирок новонароджених: невирішені питання діагностики та стратифікації ступеня тяжкості патології. Неонатологія, хірургія та перинатальна медицина. 2014. ІV. № 3 (13). 89-94. doi.org/10.24061/2413-4260.IV.3.13.2014.16.
- Яблонь О.С., Саврун Т.І., Берцун К.Т., Сергета Д.П., Шовкопляс Н.А. Сучасні проблеми неонатальної нефрології. Неонатологія, хірургія та перинатальна медицина. 2014. ІV. № 3 (13). 45-49. doi.org/10.24061/2413-4260.IV.3.13.2014.8.
- Dempsey E.M., El-Khuffash A.F. Objective cardiovascular assessment in the neonatal intensive care unit. Arch. Dis. Child Fetal. Neonatal. Ed. 2018. 103 (1). F72-F77. doi: 10.1136/archdischild-2017-313837.
- Sood B.G., McLaughlin K., Cortez J. Near-infrared spectroscopy: applications in neonates. Semin. Fetal. Neonatal. Med. 2015. 20 (3). 164-172. doi: 10.1016/j.siny.2015.03.008.
- Hazle M.A., Gajarski R.J., Aiyagari R. et al. Urinary biomarkers and renal near-infrared spectroscopy predict intensive care unit outcomes after cardiac surgery in infants younger than 6 months of age. J. Thorac. Cardiovasc. Surg. 2013. 146 (4). 861-867.e1. doi: 10.1016/j.jtcvs.2012.12.012.
- Ruf B., Bonelli V., Balling G., et al. Intraoperative renal near-infrared spectroscopy indicates developing acute kidney injury in infants undergoing cardiac surgery with cardiopulmonary bypass: a case-control study. Crit. Care. 2015. 19 (1). 27. doi: 10.1186/s13054-015-0760-9.
- McNeill S., Gatenby J.C., McElroy S., Engelhardt B. Normal cerebral, renal and abdominal regional oxygen saturations using near-infrared spectroscopy in preterm infants. J. Perinatol. 2011. 31. 51-57. doi: 10.1038/jp.2010.71.
- Marin T., Williams B.L. Renal Oxygenation Measured by Near-Infrared Spectroscopy in Neonates. Adv. Neonatal. Care. 2020 Aug 5. doi: 10.1097/ANC.0000000000000779.
- Наказ МОЗ України про затвердження «Протоколу медичного догляду за новонародженою дитиною з малою масою тіла при народженні» № 584 від 29.08.2006. http://zakon.rada.gov.ua/rada/show/v0584282-06#Text.
- Оновлений уніфікований клінічний протокол «Респіраторний дистрес-синдром у передчасно народжених дітей». 2018. https://neonatology.org.ua/news/docs/2018/04/75-onovleniy-unifikovaniy-klinichniy-protokol-respiratorniy-distres-sindrom-u-peredchasno-narodzhenikh-ditey.
- Vanhaesebrouck S., Zonnenberg I., Vandervoort P., Bruneel E., Van Hoestenberghe M.R., Theyskens C. Conservative treatment for patent ductus arteriosus in the preterm. Arch. Dis. Child Fetal. Neonatal. Ed. 2007 Jul. 92 (4). F244-47. doi: 10.1136/adc.2006.104596.
- Shepherd J.L., Noori S. What is a hemodynamically significant PDA in preterm infants? Congenit. Heart Dis. 2019 Jan. 14 (1). 21-26. doi: 10.1111/chd.12727.
- Bonsante F., Ramful D., Binquet C., et al. Low Renal Oxygen Saturation at Near-Infrared Spectroscopy on the First Day of Life Is Associated with Developing Acute Kidney Injury in Very Preterm Infants. Neonatology. 2019. 115 (3). 198-204. doi: 10.1159/000494462.
- Altit G., Bhombal S., Tacy T.A., Chock V.Y. End-organ saturation differences in early neonatal transition for left- versus right-sided congenital heart disease. Neonatology. 2018. 114. 53-61. doi: 10.1159/000487472.
- Kellum J.A., Lameire N.; KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit. Care. 2013 Feb. 4. 17 (1). 204. doi: 10.1186/cc11454.
- Harer M.W., Chock V.Y. Renal Tissue Oxygenation Monitoring-An Opportunity to Improve Kidney Outcomes in the Vulnerable Neonatal Population. Front. Pediatr. 2020 May 14. 8. 241. doi: 10.3389/fped.2020.00241.

/31.jpg)
/32_2.jpg)
/32.jpg)
/33.jpg)