Резюме
Актуальність. Завдяки прямому контакту синовії з хрящем, поверхнею кістки і синовіоцитами дослідження суглобового ліквору при ревматоїдному артриті (РА) має велике діагностичне значення, причому зміни показників чітко корелюють із даними морфологічного дослідження уражених суглобових тканин. У синовії хворих на РА накопичуються білкові речовини різної молекулярної маси і ферменти, що беруть участь у процесах деструкції хряща, сухожиль та зв’язок. Разом із тим надійних диференціально-діагностичних біомаркерів синовіальної рідини при патології суглобів поки не існує. Мета і задачі дослідження: встановити клініко-патогенетичну значущість середньомолекулярних сполук різних фракцій у суглобовій рідині хворих на РА, їх зв’язок із порушеннями фізико-хімічного характеру синовії і зі складом у ній поверхнево-активних речовин (сурфактанти). Матеріали та методи. Синовіальну рідину, отриману з колінних, ліктьових і плечових суглобів, вивчали у 21 хворого на РА (середній вік становив 50 років, співвідношення чоловіків і жінок — 1 : 2), серед яких помірний та високий ступінь активності захворювання встановлено у всіх випадках, III і IV стадії патологічного процесу — у 61,9 %, позасуглобова форма хвороби — у 61,9 %, системний остеопороз — у 95,2 %, серопозитивність за ревматоїдним фактором (RF) — у 90,5 %, за антитілами до циклічного цитрулінового пептиду (aCCP) — у 95,2 %. Для визначення молекул середньої маси в синовіальному лікворі та сироватці крові застосовували скринінговий метод з осадженням білків трихлороцтовою кислотою та визначенням спектрів поглинання світла кислоторозчинною фракцією. Білкові і небілкові азотисті сурфактанти вивчали за допомогою біоаналізатора Olympus AU640 (Японія), а міжфазну тензіометрію з підрахунком співвідношення поверхневого натягу при нескінченому часі життя поверхні для високомолекулярних речовин і при часі, що дорівнює 0,01 с, для низькомолекулярних сполук (ST∞/0,01 %) здійснювали з використанням комп’ютерного апарата ADSA-Toronto (Німеччина, Канада). Результати. Інтегральний склад середньомолекулярних сполук у синовії залежить від сироваткових рівнів RF і aCCP, а з темпами прогресування артикулярного синдрому пов’язані показники нуклеотидної (NF) та хроматофорної фракцій (CF) молекул середньої маси, які разом з амінопептидною (AF) й пептидною фракціями (PF) визначають високу активність захворювання, кістково-деструктивні зміни суглобів (AF), мінеральну щільність кістки (AF, PF, CF), формування остеоузур (AF) і внутрішньосуглобових хондромних тіл (NF, CF), прямо корелюють із вмістом у суглобовому лікворі імуноглобуліну G (NF, CF), причому CF прямо співвідноситься з наявністю артрокальцинатів і тіл Гоффа. Висновки. При РА молекули середньої маси різних фракцій у синовіальній рідини беруть участь у патогенетичних побудовах захворювання, залежать від клінічних, рентгенологічних і сонографічних ознак захворювання, можуть бути використані для прогнозування перебігу патологічного процесу.
Актуальность. Благодаря прямому контакту синовии с хрящом, поверхностью кости и синовиоцитами исследование суставного ликвора при ревматоидном артрите (РА) имеет большое диагностическое значение, причем изменения показателей четко коррелируют с данными морфологического исследования пораженных суставных тканей. В синовии больных РА накапливаются белковые вещества разной молекулярной массы и ферменты, участвующие в процессах деструкции хряща, сухожилий и связок. Вместе с тем надежных дифференциально-диагностических биомаркеров синовиальной жидкости при патологии суставов пока не существует. Цель и задачи исследования: установить клинико-патогенетическую значимость среднемолекулярных соединений разных фракций в суставной жидкости больных РА, их связь с нарушениями физико-химического характера синовии и составом в ней поверхностно-активных веществ (сурфактанты). Материалы и методы. Синовиальную жидкость, полученную из коленных, локтевых и плечевых суставов, изучали у 21 больного РА (средний возраст составил 50 лет, соотношение мужчин и женщин — 1 : 2), среди которых умеренная и высокая степень активности заболевания установлена во всех случаях, III и IV стадии патологического процесса — в 61,9 %, внесуставная форма болезни — в 61,9 %, системный остеопороз — в 95,2 %, серопозитивность по ревматоидному фактору (RF) — в 90,5 %, по антителам к циклическому цитруллиновому пептиду (aCCP) — в 95,2 %. Для определения молекул средней массы в синовиальном ликворе и сыворотке крови применяли скрининговый метод с осаждением белков трихлоруксусной кислотой и определением спектров поглощения света кислоторастворимой фракции. Белковые и небелковые азотистые сурфактанты изучали с помощью биоанализатора Olympus AU640 (Япония), а межфазную тензиометрию с подсчетом соотношения поверхностного натяжения при бесконечном времени жизни поверхности для высокомолекулярных веществ и при времени, равном 0,01 с, для низкомолекулярных соединений (ST∞/0,01 %) осуществляли с использованием компьютерного аппарата ADSA-Toronto (Германия, Канада). Результаты. Интегральный состав среднемолекулярных соединений в синовии и крови зависит от сывороточных уровней RF и aCCP, а с темпами прогрессирования артикулярного синдрома связаны показатели нуклеотидной (NF) и хроматофорной фракций (CF) молекул средней массы, которые наряду с аминопептидной (AF) и пептидной фракциями (PF) определяют высокую активность заболевания, костно-деструктивные изменения суставов (AF), минеральную плотность кости (AF, PF, CF), формирование остеоузур (AF) и внутрисуставных хондромных тел (NF, CF), прямо коррелируют с содержанием в суставном ликворе иммуноглобулина G (NF, CF), причем CF прямо соотносится с наличием артрокальцинатов и тел Гоффа. Выводы. При РА молекулы средней массы разных фракций в синовиальной жидкости участвуют в патогенетических построениях заболевания, зависят от клинических, рентгенологических и сонографических признаков заболевания, могут быть использованы для прогнозирования течения патологического процесса.
Background. Due to direct contact with cartilage, bone surface and synoviocytes, the study of synovial fluid in rheumatoid arthritis has a great diagnostic value, and changes in its indicators clearly correlate with the data of the morphological study of the affected articular tissues. In the synovial fluid of rheumatoid arthritis patients, protein substances of diffe-rent molecular mass and enzymes involved in the destruction of cartilage, tendons and ligaments are accumulated. At the same time, there are no reliable differential diagnostic biomarkers of synovial fluid in joint pathology. The purpose and objectives of the study: to establish the clinical and pathogenetic significance of medium molecular weight compounds of different fractions in the synovial fluid of patients with rheumatoid arthritis, the relationship with physicochemical disorders in the synovial fluid and the composition of surfactants in it. Materials and methods. The synovial fluid obtained from the knee, elbow and shoulder joints was studied in 21 patients with rheumatoid arthritis (mean age 50 years, male to female ratio of 1 : 2), among whom mo-derate and high degree of disease activity was established in all cases, III and IV stages of pathological process — in 61.9 %, extra-articular form of the disease — in 61.9 %, systemic osteoporosis — in 95.2 %, seropositivity for rheumatoid factor (RF) — in 90.5 %, for cyclic citrulline peptide antibodies (CCPA) — in 95.2 % of patients. To determine the middle mass molecules in the synovial fluid and blood serum, a screening method was used with trichloroacetic acid precipitation of proteins and determination of the light absorption spectra by the acid-soluble fraction. Protein and non-protein nitrogenous surfactants were studied using an Olympus-AU640 bioanalyzer (Japan), and interfacial tensiometry with calculating the surface tension ratio at an infinite surface lifetime for high molecular weight substances and at a time of 0.01 s for low-molecular weight compounds (ST∞/0,01 %) was carried out using a computer apparatus ADSA-Toronto (Germany-Canada). Results. The integral composition of medium molecular weight compounds in synovial fluid and blood depends on serum levels of RF and CCPA, and the rates of progression of articular syndrome are associated with indicators of nucleotide (NF) and chromatophore fractions (CF) of middle mass molecules, which, along with aminopeptide (AF) and peptide fractions (PF), determine the high activity of the dise-ase, bone-destructive changes in the joints (AF), bone mineral density (AF, PF, CF), the formation of bone erosions (AF) and intra-articular chondromic bodies (NF, CF), directly correlate with the content of immunoglobulin G in the synovial fluid (NF, CF), and CF is directly correlated with the presence of arthrocalcifications and Hoffa’s fat pads. Conclusions. In rheumatoid arthritis, middle mass molecules of different fractions in the synovial fluid are involved in the disease pathogenesis, depend on clinical, radiological and sonographic signs of the disease, can be used to predict the course of the pathological process.
Вступ
Синовія — це багата білком різної молекулярної маси рідина, що продукується в артикулярну порожнину клітинами суглобової мембрани [1, 2], а завдяки прямому контакту рідини з хрящем, поверхнями кістки й синовіоцитами дослідження цього ліквору при ревматоїдному артриті (РА) має велике діагностичне значення [3–5]. Зміни показників суглобової рідини чітко корелюють із даними морфологічного дослідження уражених суглобових тканин [6, 7] і зі ступенем апоптозу інтраартикулярних клітин [8]. Разом із тим надійних диференціально-діагностичних біомаркерів синовії при патології суглобів поки не існує [9–11].
Біомаркерами артритів є рівні в синовіальній рідині понад 300 метаболітів амінокислотного, білкового, ліпідного й вуглеводного походження, у тому числі середньомолекулярних сполук [12–14], але останні вивчено зовсім недостатньо, а дані суперечливі [15].
Мета і задачі дослідження: встановити клініко-патогенетичну значущість молекул середньої маси (МСМ) різних фракцій у суглобовій рідині хворих на РА, їх зв’язок із порушеннями фізико-хімічного характеру синовії і зі складом у неї поверхнево-активних речовин (сурфактанти).
Матеріали та методи
Обстежено 21 хворого на РА віком 22–65 років (у середньому — 50,10 ± 2,13 року), серед яких співвідношення чоловіків і жінок становило 1 : 2. Тривалість від першої маніфестації захворювання становила 2–25 років (у середньому —8,50 ± 1,48 року). Серопозитивність РА за ревматоїдним фактором (RF) установлена в 90,5 % від числа хворих, а за антитілами до циклічного цитрулінового пептиду (аССР) — у 95,2 %; І–ІІІ ступені загальної активності РА (AAG) констатовані відповідно у 23,8; 33,3 і 42,9 % випадків, а III та IV стадії патологічного процесу (ARS) встановлені в 61,9 % хворих. Системний остеопороз діагностований у 95,2 % спостережень.
Індекс активності артриту (DAS) становив 5,50 ± 0,25 відн.од., індекс прогресування суглобового синдрому (PAI) — 2,90 ± 0,82 відн.од., індекс Лансбурі (IL) — 179,90 ± 20,51 бала, індекс тяжкості перебігу РА (SAI) — 104,40 ± 5,52 відн.од., остеопорозний рентгенологічний індекс Барнетта — Нордіна (BNI) — 39,20 ± 0,84 × 102 відн.од., мінеральна щільність кістки (BMD) — 1,80 ± 0,19 –SD, показник RF у крові — 16,20 ± 2,73 мМО/мл, аССР — 31,60 ± 3,19 О/мл, С-реактивного протеїну (CRP) — 20,60 ± 1,35 мг/л, фібриногену (FG) — 10,10 ± 0,87 г/л.
При рентгеносонографічному дослідженні суглобів епіфізарний остеопороз відмічався в 90,5 % спостережень, остеокістоз — у 81,0 %, зміни менісків — у 71,4 %, субхондральний склероз — у 61,9 %, остеоузури — у 52,4 %, лігаментоз — у 47,6 %, артрокальцинати та кісти Бейкера — відповідно в 42,9 %, інтраартикулярні хондромні тіла — у 33,3 %, внутрішньосуглобові тіла Гоффа — у 14,3 %, тіла Штайді — у 9,5 %, асептичний остеонекроз — у 4,8 %. Тендовагініти відзначено в 61,9 % від числа обстежених хворих, ентезопатії — у 42,9 %, ураження периферичної нервової системи (полінейропатія, синдром Гієна — Барре) — у 38,1 %, дигітальний артеріїт — у 14,3 %.
Усім хворим виконували рентгенологічне дослідження периферичних суглобів, крижово-клубових і хребцевих зчленувань (апарат Multix-Compact-Siеmens, Німеччина), ультразвукове обстеження (Envisor-Philips, Нідерланди), двохенергетичну рентгенівську остеоденситометрію проксимального відділу стегнової кістки (QDR-4500-Delphi-Hologic, США). Показник DAS визначали за формулою:
де RI — індекс Річі, J — число болісних суглобів, Q — швидкість осідання еритроцитів. Параметр SAI вираховували за формулою:
а PAI визначали за формулою:
де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
У синовії та сироватці крові спектрофотометрично («СФ-46», Росія) досліджували вміст окремих фракцій МСМ при довжині хвилі 238 нм (амінопептидна фракція — AF), 254 нм (пептидна — PF), 260 нм (нуклеотидна — NF) і 280 нм (хроматофорна — CF). Підраховували показник усередненої фракції МСМ (IF) Застосовували скринінговий метод, заснований на осадженні білків 10% розчином трихлороцтової кислоти з подальшим центрифугуванням і визначенням спектрів поглинання світла кислоторозчинною фракцією. За допомогою біоаналізатора Olympus AU640 (Японія) визначали в сироватці крові показники RF, CRP і FG, а в синовіальному лікворі — рівні CRP, загального білка, імуноглобулінів (Ig) G та М, β2-мікроглобуліну, β2-макроглобуліну й сечової кислоти. З використанням комп’ютерного тензіометра PAT2-Sinterface (Німеччина) у суглобовому лікворі досліджували параметри поверхневого натягу (ST) при часі життя поверхні, що дорівнює 1 с (ST1) і 100 с (ST100), які відображають показники МСМ. Імуноферментним методом визначали вміст у сироватці крові аССР (ридер PR2100-Sanofi diagnostic pasteur, Франція). Підраховували індекс інтегрального ступеня тяжкості накопичення в суглобах МСМ (II) за формулою:
/28_4.jpg)
Статистичну обробку отриманих результатів досліджень проведено за допомогою комп’ютерного варіаційного, непараметричного, кореляційного, одно- (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (програми Microsoft Excel і Statistica StatSoft, США). Оцінювали середні значення (M), їх стандартні похибки (SE) та відхилення (SD), коефіцієнти параметричної кореляції Пірсона (r) і непараметричної Кендалла (τ), критерії дисперсії (D), однорідності дисперсії Брауна — Форсайта (BF), Вілкоксона — Рао (WR) і відмінностей Стьюдента (t), а також вірогідність статистичних показників (р). Підраховували ступінь прогнозування пропонованого результату моделі (PPV).
Результати
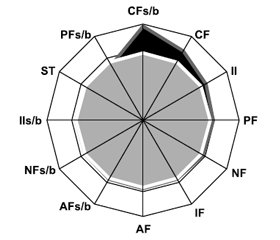
У хворих на РА показник AF у синовіальній рідині становив 406,00 ± 4,39 Од/л, PF — 101,20 ± 3,05 Од/л, NF — 38,80 ± 1,32 Од/л, CF — 13,9 ± 1,2 Од/л, IF — 139,90 ± 2,23 Од/л, AFs/b — 47,2 ± 1,6 %, PFs/b — 12,90 ± 1,28 %, NFs/b — 14,60 ± 1,21 %, SFs/b — 4,00 ± 0,47 %, ST — 86,20 ± 1,61 %, II — 76,00 ± 10,53 відн.од., IIs/b — 30,90 ± 1,46 %. Як видно з рис. 1, статевий диморфізм проявлявся більшим (на 55,9 %) показником СFs/b у чоловіків (t = 2,13, p = 0,047). За даними багатофакторного аналізу Вілкоксона — Рао, на інтегральний рівень МСМ у синовії хворих на РА впливають серопозитивність захворювання за RF (WR = 4,14, p = 0,002) й aCCP (WR = 6,29, p < 0,001).
/29.jpg)
Як свідчить однофакторний дисперсійний аналіз, темпи прогресування суглобового синдрому впливають на параметри NF (D = 13,39, p = 0,011), CF (D = 4,54, p = 0,020), PFs/b (D = 8,72, p = 0,001), NFs/b (D = 3,43, p = 0,029) і IIs/b (D = 19,69, p < 0,001). Зі свого боку, показники AFs/b та IIs/b визначають ступінь тяжкості кістково-деструктивних змін суглобів (відповідно D = 4,05, p = 0,024 і D = 3,64, p = 0,034), рівні CF, PFs/b та CFs/b — тяжкість перебігу артриту (D = 13,45, p = 0,011; D = 7,41, p = 0,033; D = 8,17, p = 0,028), AFs/b — мінеральну щільність кістки (D = 3,87, p = 0,049).
Існує прямий кореляційний зв’язок показника Пірсона PFs/b з вмістом у крові RF (r = +0,518, p = 0,016), тоді як вірогідні обернені співвідношення PF і CF стосуються CRP (відповідно r = –0,513, p = 0,021 і r = –0,471 , p = 0,037), а NF — рівня сироваткового FG (r = –0,535, p = 0,012).
Обговорення
У суглобовому лікворі концентрація загального білка становила 31,50 ± 1,68 г/л, СRP — 11,70 ± ± 0,93 мг/л, IgG — 17,40 ± 0,26 ммоль/л, IgM — 3,00 ± 0,18 ммоль/л, β2-мікроглобуліну — 3,8 ± 0,2 нг/мл, α2-макроглобуліну — 1,10 ± 0,06 г/л, сечової кислоти — 27,30 ± 0,98 мкмоль/л. У хворих на РА вміст у синовії МСМ усіх фракцій прямо корелює з рівнем у цій біологічній рідині високомолекулярного IgG (молекулярна маса становить ~150 кД), що відображено на рис. 2. Наведене вище стосується AF (r = +0,451, p = 0,040), PF (r = +0,518, p = 0,016), NF (r = +0,435, p = 0,049), CF (r = +0,501, p = 0,021), IF (r = +0,521, p = 0,015), NFs/b (r = +0,516, p = 0,017), CFs/b (r = +0,525, p = 0,015), IIs/b (r = +0,532, p = 0,013).
/29_2.jpg)
У синовіальній рідині хворих на РА накопичуються білкові речовини різної молекулярної маси, які беруть участь у процесах деструкції хряща, сухожиль і зв’язок [16, 17]. Насамперед у формуванні суглобової патології значення надається або високо-, або низькомолекулярним сполукам, вміст яких у синовії корелює з рівнями в сироватці крові [18]. На моделях захворювань суглобів в експериментальних тварин продемонстровано значущість виключно інтраартикулярних сполук із високою молекулярною масою [19]. Гіалуронова кислота (НА) із високою молекулярною масою більшою мірою пригнічує локальний синтез прозапальних ферментів, низькомолекулярна НА активує регуляцію антикатаболічних ферментів (тканинні інгібітори металопротеїназ 1 і 2) та пригноблює активність катаболічної матриксної металопротеїнази 3, тоді як дія НА середньої маси залишається невивченою [20].
Дисперсійний аналіз продемонстрував вплив на показники в синовіальній рідині NF (D = 2,89, p = 0,047), CF (D = 2,99, p = 0,043), IF (D = 2,86, p = 0,048), NFs/b (D = 3,24, p = 0,035), CFs/b (D = 3,73, p = 0,021) та IIs/b (D = 4,30, p = 0,013). З урахуванням виконаного варіаційного, дисперсійного і кореляційного аналізу зроблено висновок, що має практичну спрямованість: рівень у синовіальному лікворі хворих на РА IgG > 17 ммоль/л (> M + SD хворих) свідчить про накопичення в цій біологічної рідини МСМ різних фракцій (PPV = 88,2 %).
Ми виділили ті показники МСМ у синовії, які одночасно мали вірогідні дисперсійні зв’язки Брауна — Форсайта й кореляційні Кендалла з рентгеносонографічними ознаками суглобового синдрому. Виявилося, що наявність у хворих на РА артрокальцинатів безпосередньо впливає на показник CF (BF = 3,97, p = 0,046; τ = +0,316, p = 0,045), а жирових тіл Гоффа — на рівень IF (BF = 4,39, p = 0,049; τ = +0,379, p = 0,016). Зі свого боку, від рівнів в артикулярній рідині AFs/b та IIs/b залежить формування остеоузур (відповідно BF = 9,02, p = 0,007; τ = +0,340, p = 0,031 і BF = 5,52, p = 0,030; τ = +0,311, p = 0,047), а від NFs/b та DFs/b — внутрішньосуглобових хондромних тіл (BF = 8,45, p = 0,009; τ = +0,382, p = 0,014 і BF = 5,84, p = 0,026; τ = +0,433, p = 0,008).
Висновки
Інтегральний склад середньомолекулярних сполук у синовії залежить від сироваткових рівнів RF та aCCP, а з темпами прогресування артикулярного синдрому пов’язані показники NF і CF МСМ, які разом із AF та PF визначають високу активність захворювання, кістково-деструктивні зміни суглобів, мінеральну щільність кістки, формування остеоузур й внутрішньосуглобових хондромних тіл, прямо корелюють із вмістом у суглобовому лікворі IgG, причому CF прямо співвідноситься з наявністю артрокальцинатів і тіл Гоффа.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Dotsenko T.G., Shlikova G.I., Teplyakova O.V. The analysis of synovial fluid: clinical significance of derived results. Klin. Lab. Diagn. 2016. 61(8). 478-484. PMID: 30601639.
2. Oliviero F., Galozzi P., Ramonda R., de Oliveira F.L., Schiavon F., Scanu A. et al. Unusual findings in synovial fluid analysis: a review. Ann. Clin. Lab. Sci. 2017. 47(3). 253-259. PMID: 28667024.
3. Awisat A., Slobodin G., Jiries N., Rozenbaum M., Rimar D., Boulman N. et al. Pseudoseptic Arthritis with low synovial fluid glucose in familial mediterranean fever. Isr. Med. Assoc. J. 2017. 19(7). 461-462. PMID: 28786265.
4. Mahendran S.M., Oikonomopoulou K., Diamandis E.P., Chandran V. Synovial fluid proteomics in the pursuit of arthritis mediators: An evolving field of novel biomarker disco-very. Crit. Rev. Clin. Lab. Sci. 2017. 54(7–8). 495-505. doi: 10.1080/10408363.2017.1408561.
5. Baillet A., Trocme C., Romand X., Nguyen C.M.V., Courtier A., Toussaint B. et al. Calprotectin discriminates septic arthritis from pseudogout and rheumatoid arthritis. Rheumatology. 2019. 58(9). 1644-1648. doi: 10.1093/rheumatology/kez098.
6. Coiffier G., Ferreyra M., Albert J.D., Stock N., Jolivet-Gougeon A., Perdriger A. et al. Ultrasound-guided synovial biopsy improves diagnosis of septic arthritis in acute arthritis without enough analyzable synovial fluid: a retrospective analysis of 176 arthritis from a French rheumatology department. Clin. Rheumatol. 2018. 37(8). 2241-2249. doi: 10.1007/s10067-018-4160-9.
7. Manzo A., Bugatti S., Caporali R., Montecucco C. Histopathology of the synovial tissue: perspectives for biomarker development in chronic inflammatory arthritides. Reumatismo. 2018. 70(3). 121-132. doi: 10.4081/reumatismo.2018.1057.
8. Raza K., Scheel-Toellner D., Lee C.Y., Pilling D., Cur-now S.J., Falciani F. et al. Synovial fluid leukocyte apoptosis is inhibited in patients with very early rheumatoid arthritis. Arthritis Res. Ther. 2016. 8(4). 120. doi: 10.1186/ar2009.
9. Hügle T., Kovacs H., Heijnen I.A., Daikeler T., Baisch U., Hicks J.M. et al. Synovial fluid metabolomics in different forms of arthritis assessed by nuclear magnetic resonance spectro-scopy. Clin. Exp. Rheumatol. 2012. 30(2). 240-245. PMID: 22410098.
10. Zamani B., Jamali R., Ehteram H. Synovial fluid adenosine deaminase and high-sensitivity C-reactive protein activity in differentiating monoarthritis. Rheumatol. Int. 2012. 32(1). 183-188. doi: 10.1007/s00296-010-1602-3.
11. Peffers M.J., Smagul A., Anderson J.R. Proteomic analysis of synovial fluid: current and potential uses to improve clinical outcomes. Expert Rev. Proteomics. 2019. 16(4). 287-302. doi: 10.1080/14789450.2019.1578214.
12. Talabot-Ayer D., McKee T., Gindre P., Bas S., Baeten D.L., Gabay C. et al. Distinct serum and synovial fluid interleukin (IL)-33 levels in rheumatoid arthritis, psoriatic arthritis and osteoarthritis. Joint Bone Spine. 2012. 79(1). 32-37. doi: 10.1016/j.jbspin.2011.02.011.
13. Adams S.B., Nettles D.L., Jones L.C., Miller S.D., Guyton G.P., Schon L.C. Inflammatory cytokines and cellular metabolites as synovial fluid biomarkers of posttraumatic ankle arthritis. Foot Ankle Int. 2014. 35(12). 1241-1249. doi: 10.1177/1071100714550652.
14. Altobelli E., Angeletti P.M., Piccolo D., De Angelis R. Synovial Fluid and serum concentrations of inflammatory markers in rheumatoid arthritis, psoriatic arthritis and osteoarthitis: a systematic review. Curr. Rheumatol. Rev. 2017. 13(3). 170-179. doi: 10.2174/1573397113666170427125918.
15. Hampel U., Sesselmann S., Iserovich P., Sel S., Paulsen F., Sack R. Chemokine and cytokine levels in osteoarthritis and rheumatoid arthritis synovial fluid. J. Immunol. Methods. 2018. 396(1–2). 134-139. doi: 10.1016/j.jim.2013.08.007.
16. Dickinson S.C., Vankemmelbeke M.N., Buttle D.J., Rosenberg K., Heinegard D., Hollander A.P. Cleavage of cartilage oligomeric matrix protein (thrombospondin-5) by matrix metalloproteinases and a disintegrin and metalloproteinase with thrombospondin motifs. Matrix Biol. 2013. 22(3). 267-278. doi: 10.1016/s0945-053x(03)00034-9.
17. Sheridan C. Low-molecular-weight albumin drug touted for severe osteoarthritis. Nat. Biotechnol. 2018. 36(4). 293. doi: 10.1038/nbt0418-293.
18. Xu H., Geddes R., Roberts-Thomson P.J. Low molecular weight IgM and CD5 B lymphocytes in rheumatoid arthritis. Ann. Rheum. Dis. 2004. 53(6). 383-390. doi: 10.1136/ard.53.6.383.
19. Meo Burt P., Xiao L., Hurley M.M. FGF23 Regulates Wnt/β-catenin signaling-mediated osteoarthritis in mice overexpressing high-molecular-weight FGF2. Endocrinology. 2018. 159(6). 2386-2396. doi: 10.1210/en.2018-00184.
20. Huang T.L., Hsu H.C., Yang K.C., Yao C.H., Lin F.H. Effect of different molecular weight hyaluronans on osteoarthritis-related protein production in fibroblast-like synoviocytes from patients with tibia plateau fracture. J. Trauma. 2019. 68(1). 146-152. doi: 10.1097/TA.0b013e3181a92cf8.
/28.jpg)
/28_2.jpg)
/28_3.jpg)
/28_4.jpg)
/29.jpg)

/29_2.jpg)