Журнал «Медицина неотложных состояний» Том 16, №7, 2020
Вернуться к номеру
Післяопераційний делірій і когнітивні порушення при застосуванні регіонарних технік післяопераційного знеболювання
Авторы: Демитер І.М., Воротинцев С.І., Доля О.С.
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
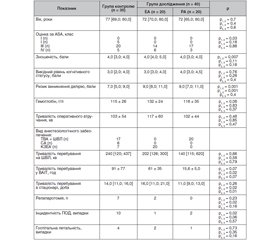
Актуальність. Післяопераційний делірій (ПОД) — одне з найпоширеніших ускладнень після оперативних втручань у пацієнтів похилого віку. Мета роботи: оцінити вплив різних технік регіонарної аналгезії на інцидентність післяопераційного делірію та рівень когнітивних порушень у пацієнтів похилого віку. Матеріали та методи. В одноцентрове проспективне дослідження були послідовно включені 70 пацієнтів похилого віку, яким виконувалися оперативні втручання на органах черевної порожнини в ургентному порядку. Залежно від методу періопераційного знеболювання всі хворі були розподілені на 2 основні групи: контрольну (n = 30) та дослідницьку (n = 40), у якій періопераційно застосовували одну з технік регіонарної аналгезії — блокаду передньої черевної стінки (підгрупа РА, n = 20) або епідуральну аналгезію (підгрупа ЕА, n = 20). Результати. Вихідний когнітивний статус пацієнтів підгрупи ЕА вірогідно не відрізнявся від аналогічного показника в групі контролю і становив 3,0 [3,0; 4,0] бала. У подальшому він поступово покращувався, досягнувши 4,0 [3,0; 5,0] бала (р = 0,04) на п’ятий післяопераційний день. Когнітивний статус пацієнтів підгрупи РА перед операцією був трохи кращий (4,0 [3,0; 4,5] бала), проте теж вірогідно не відрізнявся від аналогічного показника ні в групі контролю, ні в підгрупі ЕА. Як виявилось, у пацієнтів обох підгруп когнітивні здібності на 5-ту добу були навіть кращими, ніж перед операцією (p < 0,05). Таке поліпшення передусім пов’язано з припиненням дії важливого фактора впливу на когнітивний статус — болю. Висновки. У пацієнтів похилого віку після ургентних оперативних втручань при застосуванні епідуральної аналгезії інцидентність ПОД становить 5 % та при застосуванні блокад передньої черевної стінки — 10 %. Когнітивна функція пацієнтів при застосуванні регіонарних технік післяопераційного знеболювання відновлюється на третю добу після операції та поліпшується на п’яту післяопераційну добу (p < 0,05).
Актуальность. Послеоперационный делирий (ПОД) — одно из самых распространенных осложнений после оперативных вмешательств у пациентов пожилого возраста. Цель работы: оценить влияние различных техник регионарной аналгезии на инцидентность послеоперационного делирия и уровень когнитивных нарушений у пациентов пожилого возраста. Материалы и методы. В одноцентровое проспективное исследование были последовательно включены 70 пациентов пожилого возраста, которым выполнялись оперативные вмешательства на органах брюшной полости в ургентном порядке. В зависимости от метода периоперационной аналгезии все больные были разделены на 2 основные группы: контрольную (n = 30) и исследовательскую (n = 40), в которой периоперационно применяли одну из техник регионарной аналгезии — блокаду передней брюшной стенки (подгруппа РА, n = 20) или эпидуральную аналгезию (подгруппа ЭА, n = 20). Результаты. Исходный когнитивный статус пациентов подгруппы ЭА достоверно не отличался от аналогичного показателя в группе контроля и составил 3,0 [3,0; 4,0] балла. В дальнейшем он постепенно улучшался, достигнув 4,0 [3,0; 5,0] балла (р = 0,04) на пятый послеоперационный день. Когнитивный статус пациентов подгруппы РА перед операцией был получше (4,0 [3,0; 4,5] балла), однако тоже достоверно не отличался от аналогичного показателя ни в группе контроля, ни в подгруппе ЭА. Как оказалось, у пациентов обеих подгрупп когнитивные способности на 5-е сутки были даже лучше, чем перед операцией (p ˂ 0,05). Такое улучшение прежде всего связано с прекращением действия важного фактора влияния на когнитивный статус — боли. Выводы. У пациентов пожилого возраста после ургентных оперативных вмешательств при применении эпидуральной аналгезии инцидентность ПОД составляет 5 % и при применении блокад передней брюшной стенки — 10 %. Когнитивная функция пациентов при применении регионарных техник послеоперационного обезболивания восстанавливается на третьи сутки после операции и улучшается на пятые послеоперационные сутки (p < 0,05).
Background. Postoperative delirium is one of the most common complications after surgery in elderly patients. The aim of the study was to evaluate the impact of different techniques of regional analgesia on the incidence of postoperative delirium and the level of cognitive impairment in elderly patients. Materials and methods. A single-center prospective study consistently included 70 elderly patients who underwent emergency abdominal surgery. Depending on the method of perioperative anesthesia, all patients were divided into two basic groups: control (n = 30) and research (n = 40), where one of the perioperative techniques of regional analgesia was used — blockade of the anterior abdominal wall (subgroup AA, n = 20) or epidural analgesia (subgroup EA, n = 20). Results. The initial cognitive status of patients in subgroup EA did not differ significantly from the same indicator in the control group and amounted to 3.0 [3.0; 4.0] points. Subsequently, it gradually improved, reaching 4.0 [3.0; 5.0] (p = 0.04) points on the fifth postoperative day. The cognitive status of patients in the AA subgroup before surgery was slightly better (4.0 [3.0; 4.5] points), but also did not differ significantly from that either in the control group or the EA subgroup. As it turned out, the patients of both subgroups had even better cognitive functioning on the 5th day than before surgery (p ˂ 0.05). This improvement is mostly due to the cessation of an important factor influencing cognitive status — pain. Conclusions. In elderly patients after emergency surgery with epidural analgesia, the incidence of postoperative delirium is 5 %, and when using the anterior abdominal wall blockade — 10 %. The cognitive function of patients received regional postoperative analgesia is restored on the third day after surgery and improves on the fifth postoperative day (p < 0.05).
післяопераційний делірій; пацієнти похилого віку; абдомінальна хірургія
послеоперационный делирий; пациенты пожилого возраста; абдоминальная хирургия
postoperative delirium; elderly patients; abdominal surgery
Вступ
Матеріали та методи
Результати
/92.jpg)
Обговорення
Висновки
- Dasgupta M., Dumbrell A.C. Preoperative risk assessment for delirium after noncardiac surgery: A systematic review. J. Am. Geriatr. Soc. 2006. 54. 1578-89. doi: 10.1111/j.1532-5415.2006.00893.x.
- Yildizeli B., Ozyurtkan M.O., Batirel H.F., Kuscu K., Bekiroglu N., Yüksel M. Factors associated with postoperative delirium after thoracic surgery. Ann. Thorac. Surg. 2005. 79. 1004-9. doi: 10.1016/j.athoracsur.2004.06.022.
- Scholz A.F., Oldroyd C., McCarthy K., Quinn T.J., Hewitt J. Systematic review and meta-analysis of risk factors for postoperative delirium among older patients undergoing gastrointestinal surgery. Br. J. Surg. 2016. 103. Е21-28. doi: 10.1002/bjs.10062.
- Ely E.W., Gautam S., Margolin R., Francis J., May L., Speroff T. et al. The impact of delirium in the intensive care unit on hospital length of stay. Intensive Care Med. 2001. 27. 1892-900. doi: 10.1007 / s00134-001-1132-2.
- McNicoll L., Pisani M.A., Zhang Y., Ely E.W., Siegel M.D., Inouye S.K. Delirium in the Intensive Care Unit: Occurrence and Clinical Course in Older Patients. Journal of the American Geriatrics Society. 01 May 2003. 51(5). 591-598. doi: 10.1034/j.1600-0579.2003.00201.x.
- Wacker P., Nunes P.V., Cabrita H. et al. Postoperative delirium is associated with poor cognitive outcome and dementia. Dement. Geriatr. Cogn. Disord. 2006. 21. 221-227. doi: 10.1159/000091022.
- Marcantonio E.R. Postoperative delirium: a 76-year-old woman with delirium following surgery. JAMA. 2012. 308. 73-81. doi: 10.1001/jama.2012.6857.
- Segal-Gidan Freddi P.A. Postoperative confusion in older adults. Journal of the American Academy of Pas. 2017. 30(4). 12-6. doi: 10.1097/01.JAA.0000513345.29384.39.
- Robinson T.N., Raeburn C.D., Tran Z.V., Angles E.M., Brenner L.A., Moss M. Postoperative delirium in the elderly: risk factors and outcomes. Ann. Surg. 2009 Jan. 249(1). 173-8. doi: 10.1097/SLA.0b013e31818e4776.
- Morrison R.S., Magaziner J., Gilbert M., Koval K.J., McLaughlin M.A., Orosz G., Strauss E., Siu A.L. Relationship Between Pain and Opioid Analgesics on the Development of Delirium Following Hip Fracture. The Journals of Gerontology. Jan 2003. Series A. 58(1). M76-M81. https://doi.org/10.1093/gerona/58.1.M76.
- Zywiel M.D., Prabhu А., Anthony V. Perruccio, Rajiv Gandhi. The Influence of Anesthesia and Pain Management on Cognitive Dysfunction After Joint Arthroplasty MG. Clin. Orthop. Relat. Res. 2014. 472. 1453-1466. doi: 10.1007/s11999-013-3363-2.
- Hubbard R.E., Peel N.M., Samanta M., Gray L.C., Mitnitski A., Rockwood K. Frailty status at admission to hospital predicts multiplace adverse outcomes. Age Ageing. 2017. 22. 1-6. doi: 10.1093/ageing/afx081.
- Kim M.Y., Park U.J., Kim H.T., Cho W.H. Delirium Prediction based on Hospital Information (Delphi) in general surgery patients. Medicine (Baltimore). 2016 Mar. 95(12). Е3072. doi: 10.1097/MD.0000000000003072.
- Solovyova A.P., Goryachev D.V., Arkhipov V.V. Criteria for Assessment of Cognitive Impairment in Clinical Trials. The Bulletin of Scientific Centre for Expert Evaluation of Medicinal Products. 2018. 8. 4. https://doi.org/10.30895/1991-2919-2018-8-4-218-230.
- Annachiara Marra, E. Wesley Ely, Pratik P. Pandharipande, and Mayur B. Patel. The ABCDEF Bundle in Critical Care. Crit. Care Clin. 2017 Apr. 33(2). 225-243. doi: 10.1016/j.ccc.2016.12.005.
- Ely E.W., Margolin R., Francis J., May L., Truman B., Dittus R. et al. Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit. Care Med. 2001. 29. 1370-1379. doi: 10.1097/00003246-200107000-00012.
- Rowbotham M.C., Twilling L., Davies P.S., Reisner L., Taylor K., Mohr D. Oral opioid therapy for chronic peripheral and central neuropathic pain. N. Engl. J. Med. 2003. 348. 1223-32. doi: 10.1056/NEJMoa021420.
- Han J.H., Zimmerman E.E., Cutler N., Schnelle J., Morandi A., Dittus R.S. et al. Delirium in older emergency department patients: recognition, risk factors, and psychomotor subtypes. Acad. Emerg. Med. 2009. 16(3). 193-200. doi: 10.1111/j.1553-2712.2008.00339.x.
- Ritter S.R.F., Cardoso A.F., Lins M.M.P., Zoccoli T.L.V., Freitas M.P.D., Camargos E.F. Underdiagnosis of delirium in the elderly in acute care hospital settings: lessons not learned. Psychogeriatrics. 2018. 18(4). 268-75. doi: 10.1111/psyg.12324.
- Bellelli G., Nobili A., Annoni G., Morandi A., Djade C.D., Meag-her D.J. et al. Under-detection of delirium and impact of neurocognitive deficits on inhospital mortality among acute geriatric and medical wards. Eur. J. Intern. Med. 2015. 26(9). 696-704. doi: 10.1016/j.ejim.2015.08.006.
- Safavynia S.A., Arora S., Pryor K.O., García P.S. An update on postoperative delirium: clinical features, neuropathogenesis, and perioperative management. Curr. Anesthesiol. Rep. 2018. 8(3). 252-62. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6290904/.
- Weiss B., Spies C.D. et al. European Society of Anaesthe-siology evidence-based and consensus-based guideline on postoperative delirium. Eur. J. Anaesthesiol. 2017. 34. 192-214. doi: 10.1097/EJA.0000000000000594.
- Saczynski J.S., Marcantonio E.R., Quach L., Fong T.G., Gross A., Inouye S.K., Jones R.N. Cognitive trajectories after postoperative delirium. N. Engl. J. Med. 2012 Jul 5. 367(1). 30-9. doi: 10.1056/NEJMoa1112923.
- Van Rompaey B., Elseviers M.M., Schuurmans M.J., Shortridge-Baggett L.M., Truijen S., Bossaert L. Risk factors for delirium in intensive care patients: a prospective cohort study. Crit. Care. 2009. 13(3). R77. doi: 10.1186/cc7892.
- Pisani M.A., Murphy T.E., Araujo K.L., Slattum P., Van Ness P.H., Inouye S.K. Benzodiazepine and opioid use and the duration of intensite care unit delirium in an older population. Crit. Care Med. 2009. 37(1). 177-183. doi: 10.1097/CCM.0b013e318192fcf9.
- Jacqueline M. Leung, Laura P. Sands, Sudeshna Paul, Tim Joseph, Sakura Kinjo et al. Does Postoperative Delirium Limit the Use of Patient-controlled Analgesia in Older Surgical Patients? Anesthesiology. 2009. 111. 625-631. doi: https://doi.org/10.1097/ALN.0b013e3181acf7e6.
- Li Y.-W., Li H.J. et al. Effects of two different anesthesia-analgesia methods on incidence of postoperative delirium in elderly patients undergoing major thoracic and abdominal surgery: study rationale and protocol for a multicenter randomized controlled trial. BMC Anesthesiol. 2015. 15. 144. PMID: 26459347. PMCID: PMC4603291. doi: 10.1186/s12871-015-0118-5.
- Pandharipande P.P., Pun B.T., Herr D.L., Maze M., Gi-rard T.D., Miller R.R., Shintani A.K., Thompson J.L., Jackson J.C., Deppen S.A., Stiles R.A., Dittus R.S., Ely E.W. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients: the MENDS randomized controlled trial. JAMA. 2007. 298(22). 2644-53. doi: 10.1001/jama.298.22.2644.
- Jakob S.M., Ruokonen E., Grounds R.M., Sarapohja T., Garratt C., Pocock S.J., Bratty J.R., Takala J. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation: two randomized controlled trials. JAMA. 2012. 307(11). 1151-1160. doi: 10.1001/jama.2012.304.

/91.jpg)
/93.jpg)