Международный эндокринологический журнал Том 16, №8, 2020
Вернуться к номеру
Оцінка клінічної ефективності замісної терапії препаратом Декап у пацієнтів із цукровим діабетом типу 2 і супутньою неалкогольною жировою хворобою печінки за умови дефіциту вітаміну D
Авторы: Алудван М.Б.(1), Кобиляк Н.М.(1), Павленко Г.П.(2), Комісаренко Ю.І.(1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — КНП «Київський міський клінічний ендокринологічний центр», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
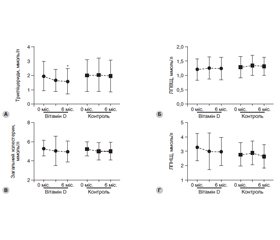
Актуальність. Останнім часом дефіцит вітаміну D вважається одним з факторів розвитку цукрового діабету 2-го типу (ЦД типу 2) і неалкогольної жирової хвороби печінки (НАЖХП). Мета: встановити ефективність препарату Декап (холекальциферол) у пацієнтів з його дефіцитом, хворих на ЦД типу 2 з НАЖХП. Матеріали та методи. Проліковані 52 пацієнти з НАЖХП і ЦД типу 2 на тлі встановленого D-дефіциту, які рівномірно були розподілені на дві групи. Хворі групи порівняння (n = 26) отримували виключно традиційну антидіабетичну терапію, а хворі основної групи (n = 26) додатково отримували препарат вітаміну D Декап, який призначали в дозі 4000 МО/добу строком на 6 місяців. Результати. Використання вітаміну D було асоційоване зі статистично значущим зниженням глікемії натще через 6 місяців лікування на 4,2 % (p = 0,041). Рівень глікованого гемоглобіну (HbA1c) в основній групі пацієнтів у середньому знизився на 0,38 % (р = 0,121) через 3 місяці і залишився практично на такому ж рівні й через 6 місяців — на 0,44 % (р = 0,088). Паралельно з покращанням параметрів глікемічного контролю в пацієнтів основної групи спостерігалась тенденція до зниження індексу HOMA-2-IR на 0,28 (–0,11; 0,86; р = 0,152) і покращання чутливості до інсуліну на 1,39 (–10,04; 6,01; р = 0,621) порівняно з вихідними показниками. Використання препарату вітаміну D (Декап) асоційоване зі зниженням індексів стеатозу: FLI і TyG. Базове значення для FLI становило 74,11 ± 18,71, для TyG — 5,21 ± 0,29, а після шестимісячного курсу лікування вітаміном D знизилось відповідно на 4,4 % (р = 0,029) і 2,68 % (р = 0,031) порівняно з вихідними показниками. Висновки. Встановлено, що використання препарату Декап у пацієнтів з дефіцитом вітаміну D, хворих на ЦД типу 2 з НАЖХП, у дозі 4000 МО/добу на курс не менше від шести місяців призводить до покращання параметрів глікемічного контролю й метаболічного профілю.
Актуальность. В последнее время дефицит витамина D считается одним из факторов развития сахарного диабета 2-го типа (СД типа 2) и неалкогольной жировой болезни печени (НАЖБП). Цель: установить эффективность препарата Декап (холекальциферол) у пациентов с его дефицитом, больных СД типа 2 с НАЖБП. Материалы и методы. Пролечены 52 пациента с НАЖБП и СД типа 2 на фоне установленного D-дефицита, которые были равномерно распределены на две группы. Больные группы сравнения (n = 26) получали исключительно традиционную антидиабетическую терапию, а больные основной группы (n = 26) дополнительно получали препарат витамина D Декап, который назначали в дозе 4000 МЕ/сут сроком на 6 месяцев. Результаты. Использование витамина D было ассоциировано со статистически значимым снижением гликемии натощак через 6 месяцев лечения на 4,2 % (p = 0,041). Уровень гликированного гемоглобина (HbA1c) в основной группе пациентов в среднем снизился на 0,38 % (р = 0,121) через 3 месяца и остался практически на том же уровне и через 6 месяцев — на 0,44 % (р = 0,088). Параллельно с улучшением параметров гликемического контроля у пациентов основной группы наблюдалась тенденция к снижению индекса HOMA-2-IR на 0,28 (–0,11; 0,86; р = 0,152) и улучшение чувствительности к инсулину на 1,39 (–10,04; 6,01; р = 0,621) по сравнению с исходным уровнем. Использование препарата витамина D (Декап) ассоциировано со снижением индексов стеатоза: FLI и TyG. Базовое значение для FLI составило 74,11 ± 18,71, для TyG — 5,21 ± 0,29, а после шестимесячного курса лечения витамином D снизилось соответственно на 4,4 % (р = 0,029) и 2,68 % (р = 0,031) по сравнению с исходными показателями. Выводы. Установлено, что использование препарата Декап у пациентов с дефицитом витамина D, больных СД типа 2 с НАЖХП, в дозе 4000 МЕ/сут на курс не менее шести месяцев приводит к улучшению параметров гликемического контроля и метаболического профиля.
Background. Recently, vitamin D deficiency has been considered one of the factors in the development of type 2 diabetes mellitus (DM) and nonalcoholic fatty liver disease (NAFLD). The purpose was to establish the effectiveness of Decap (cholecalciferol) in patients with its deficiency who suffered from type 2 DM and NAFLD. Materials and methods. Fifty-two people with NAFLD and type 2 DM on the background of established D-deficiency were treated, they were evenly divided into two groups. Patients in the comparison group (n = 26) received only traditional antidiabetic therapy, and the main group (n = 26) additionally took vitamin D — Decap, which was prescribed at a dose of 4,000 IU/day for 6 months. Results. Vitamin D use was associated with a statistically significant reduction in fasting blood glucose after 6 months of treatment — by 4.2 % (p = 0.041). The level of glycated hemoglobin in the main group of patients decreased on average by 0.38 % (p = 0.121) after 3 months, and remained almost at the same level after 6 months — by 0.44 % (p = 0.088). In parallel with the improvement of glycemic control parameters in the main group, there was a tendency to a decrease in the HOMA-2-IR by 0.28 (–0.11; 0.86; p = 0.152) and to a better insulin sensitivity by 1.39 (–10.04; 6.01; p = 0.621) compared to the baseline. The use of vitamin D (Decap) is associated with a decrease in steatosis indices FLI and TyG. The baseline values for FLI was 74.11 ± 18.71 and for TyG — 5.21 ± 0.29, and after a six-month course of vitamin D treatment, they decreased by 4.4 % (p = 0.029) and 2.68 % (p = 0.031), respectively, compared to baseline. Conclusions. It was found that the use of Decap in patients with vitamin D deficiency at a dose of 4,000 IU/day for a course of at least six months improved glycemic control and metabolic profile in those with type 2 DM and NAFLD.
Декап; дефіцит вітаміну D; цукровий діабет типу 2; неалкогольна жирова хвороба печінки; інсулінорезистентність; ожиріння
Декап; дефицит витамина D; сахарный диабет типа 2, неалкогольная жировая болезнь печени; инсулинорезистентность; ожирение
Decap; vitamin D deficiency; type 2 diabetes mellitus; nonalcoholic fatty liver disease; insulin resistance; obesity
Вступ
Матеріали та методи
/19.jpg)
Результати
/20.jpg)
/22_2.jpg)
Обговорення
/23.jpg)
/23_2.jpg)
Висновки
- Kharroubi A.T., Darwish H.M. Diabetes mellitus: The epidemic of the century. World J. Diabetes. 2015. 6(6). 850-67. doi: 10.4239/wjd.v6.i6.850.
- Khan M.A.B., Hashim M.J., King J.K., Govender R.D., Mustafa H., Al Kaabi J. Epidemiology of Type 2 Diabetes — Global Burden of Disease and Forecasted Trends. J. Epidemiol. Glob. Health. 2020. 10(1). 107-111. doi: 10.2991/jegh.k.191028.001.
- Eslami M., Bahar A., Hemati M., Rasouli Nejad Z., Mehranfar F., Karami S. et al. Dietary pattern, colonic microbiota and immunometabolism interaction: new frontiers for diabetes mellitus and related disorders. Diabetic Medicine. 2020. e14415. https://doi.org/10.1111/dme.14415.
- Zimmet P.Z., Magliano D.J., Herman W.H., Shaw J.E. Diabetes: A 21st century challenge. The Lancet Diabetes and Endocrinology. 2014. 2. 56-64. https://doi.org/10.1016/S2213-8587(13)70112-8.
- Zimmet P., Alberti K.G., Magliano D.J., Bennett P.H. Diabetes mellitus statistics on prevalence and mortality: Facts and fallacies. Nature Reviews Endocrinology. 2016. 12. 616-22. https://doi.org/10.1038/nrendo.2016.105.
- Bommer C., Heesemann E., Sagalova V., Manne-Goehler J., Atun R., Bärnighausen T. et al. The global economic burden of diabetes in adults aged 20–79 years: a cost-of-illness study. The Lancet Diabetes and Endocrinology. 2017. 5. 423-30. https://doi.org/10.1016/S2213-8587(17)30097-9.
- Rafiq S., Jeppesen P. Is Hypovitaminosis D Related to Incidence of Type 2 Diabetes and High Fasting Glucose Level in Healthy Subjects: A Systematic Review and Meta-Analysis of Observational Studies. Nutrients. 2018. 10. 59. https://doi.org/10.3390/nu10010059.
- Panda D.K., Miao D., Tremblay M.L., Sirois J., Farookhi R., Hendy G.N. et al. Targeted ablation of the 25-hydroxyvitamin D 1α-hydroxylase enzyme: Evidence for skeletal, reproductive, and immune dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 2001. 98. 7498-503. https://doi.org/10.1073/pnas.131029498.
- Aludwan M., Kobyliak N., Abenavoli L., Kononenko L., Shuliarenko L., Kyriienko D. et al. Hepatic steatosis indices as predictors of vitamin D 3 deficiency in patients with NAFLD associated with type 2 diabetes. Clinical Diabetology. 2020. 9. https://doi.org/10.5603/DK.2020.0036.
- Rojas-Rivera J., De La Piedra C., Ramos A., Ortiz A., Egido J. The expanding spectrum of biological actions of vitamin D. Nephrology Dialysis Transplantation. 2010. 25. 2850-65. https://doi.org/10.1093/ndt/gfq313.
- Hossein-Nezhad A., Holick M.F. Vitamin D for health: A global perspective. Mayo Clinic Proceedings. 2013. Vol. 88. Р. 720-55. https://doi.org/10.1016/j.mayocp.2013.05.011.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P. et al. Evaluation, treatment, and prevention of vitamin D deficiency: An endocrine society clinical practice guideline. Journal of Clinical Endocrinology and Metabolism. 2011. 96. 1911-30. https://doi.org/10.1210/jc.2011-0385.
- Classification and diagnosis of diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020. 43. S14-31. https://doi.org/10.2337/dc20-S002.
- Chalasani N., Younossi Z., Lavine J.E., Diehl A.M., Brunt E.M., Cusi K. et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012. 55. 2005-23. https://doi.org/10.1002/hep.25762.
- Abdel-Wareth L., Haq A., Turner A., Khan S., Salem A., Mustafa F. et al. Total vitamin D assay comparison of the roche diagnostics “vitamin D total” electrochemiluminescence protein binding assay with the chromsystems HPLC method in a population with both D2 and D3 forms of vitamin D. Nutrients. 2013. 5. 971-80. https://doi.org/10.3390/nu5030971.
- Matthews D.R., Hosker J.P., Rudenski A.S., Naylor B.A., Treacher D.F., Turner R.C. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985. 28. 412-9. https://doi.org/10.1007/BF00280883.
- Wallace T.M., Levy J.C., Matthews D.R. Use and abuse of HOMA modeling. Diabetes Care. 2004. 27. 1487-95. https://doi.org/10.2337/diacare.27.6.1487.
- Salazar J., Bermúdez V., Calvo M., Olivar L.C., Luzardo E., Navarro C. et al. Optimal cutoff for the evaluation of insulin resistance through triglyceride-glucose index: A cross-sectional study in a Venezuelan population. F1000Research. 2018. 6. 1337. https://doi.org/10.12688/f1000research.12170.3.
- Bedogni G., Bellentani S., Miglioli L., Masutti F., Passalacqua M., Castiglione A. et al. The fatty liver index: A simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterology. 2006. 6. 33. https://doi.org/10.1186/1471-230X-6-33.
- Lee J.H., Kim D., Kim H.J., Lee C.H., Yang J.I., Kim W. et al. Hepatic steatosis index: A simple screening tool reflecting nonalcoholic fatty liver disease. Digestive and Liver Disease. 2010. 42. 503-8. https://doi.org/10.1016/j.dld.2009.08.002.
- Angellotti E., D’Alessio D., Dawson-Hughes B., Nelson J., Cohen R.M., Gastaldelli A. et al. Vitamin D supplementation in patients with type 2 diabetes: The vitamin D for established type 2 diabetes (DDM2) study. Journal of the Endocrine Society. 2018. 2. 310-21. https://doi.org/10.1210/JS.2018-00015.
- Gagnon C., Daly R.M., Carpentier A., Lu Z.X., Shore-Lorenti C., Sikaris K. et al. Effects of combined calcium and vitamin D supplementation on insulin secretion, insulin sensitivity and β-cell function in multi-ethnic vitamin D-deficient adults at risk for type 2 diabetes: A pilot randomized, placebo-controlled trial. PLoS ONE. 2014. 9. e109607. https://doi.org/10.1371/journal.pone.0109607.
- Dabbaghmanesh M.H., Danafar F., Eshraghian A., Omrani G.R. Vitamin D supplementation for the treatment of non-alcoholic fatty liver disease: A randomized double blind placebo controlled trial. Diabetes and Metabolic Syndrome: Clinical Research and Reviews. 2018. 12. 513-7. https://doi.org/10.1016/j.dsx.2018.03.006.
- Mansour-Ghanaei F., Pourmasoumi M., Hadi A., Ramezani-Jolfaie N., Joukar F. The Efficacy of Vitamin D Supplementation against Nonalcoholic Fatty Liver Disease: A Meta-Analysis. Journal of Dietary Supplements. 2020. 17. 467-85. https://doi.org/10.1080/19390211.2019.1624671.
- Barchetta I., Del Ben M., Angelico F., Di Martino M., Fraioli A., La Torre G. et al. No effects of oral vitamin D supplementation on non-alcoholic fatty liver disease in patients with type 2 diabetes: A randomized, double-blind, placebo-controlled trial. BMC Medicine. 2016. 14. https://doi.org/10.1186/s12916-016-0638-y.

/19_2.jpg)
/21.jpg)
/22.jpg)