Резюме
Метою дослідження було з’ясування ймовірного впливу комплексу засобів — метформіну, розувастатину, есенціальних фосфоліпідів та кверцетину на клінічний перебіг неалкогольного стеатогепатиту (НАСГ), діабетичної хвороби нирок, цукрового діабету (ЦД) типу 2, а також на стан ліпідного спектра крові, параметри компенсації вуглеводного обміну, ступінь інсулінорезистентності, які є чинниками прогресування НАСГ та діабетичної хвороби нирок. Матеріали та методи: Проведені дослідження в динаміці лікування у 60 хворих на НАСГ із ЦД типу 2 та діабетичною хворобою нирок І–ІІІ стадії, серед яких у 48 пацієнтів було встановлено НАСГ слабкої активності, а у 12 — помірної активності. Коморбідним захворюванням у всіх хворих на НАСГ був ЦД типу 2 середнього ступеня тяжкості, у 15 осіб він був у стані компенсації, у 45 — субкомпенсований. Стан вуглеводного обміну встановлювали за рівнем глікемії натще та через 2 години після їди глюкозооксидазним методом, за вмістом у крові інсуліну натще (DRG System) методом імуноферментного аналізу, вмістом у крові глікованого гемоглобіну за допомогою стандартних наборів реактивів «Simko Ltd» (Львів). Результати. Через місяць від початку терапії астеновегетативний синдром значно меншої інтенсивності зберігався лише в однієї особи (3,13 %) другої групи, тоді як у першій групі він залишався у 9 хворих (32,1 %) (р < 0,05). У той же час у більшості хворих другої групи зникли відчуття тяжкості та біль у правій підреберній ділянці (відповідно у 31 (96,9 %) проти 16 (57,1 %) у першй групі (р < 0,05), а також практично не турбували диспептичні явища (24 хворі другої групи (75,0 %) проти 11 осіб (39,3 %) у першій групі). Через місяць від початку лікування не було зареєстровано клінічних проявів синдрому холестазу в 20 (62,5 %) хворих другої групи та лише у 10 хворих (35,7 %) у першій групі (р < 0,05). Відзначається позитивний вплив додаткового до комплексної терапії призначення кверцетину на регресію гепатомегалії, яка після лікування упродовж одного місяця залишалася лише у 5 осіб другої групи (15,6 %), у той час як у першій групі її мали 19 осіб (67,9 %) (р < 0,05). Висновок. Комплексна терапія есенціальними фосфоліпідами, розувастатином, метформіном у комбінації із кверцетином в осіб із коморбідними НАСГ, ЦД типу 2 та діабетичною хворобою нирок сприяє усуненню основних клініко-лабораторних симптомів загострення НАСГ, вірогідному зниженню інтенсивності запального процесу в печінці, зворотному розвитку явищ стеатозу печінки, сприяє нормалізації глікемії. Комплексна терапія з додаванням кверцетину вірогідно сприяла підвищенню ефективності лікування діабетичної хвороби нирок на тлі ЦД типу 2, зменшенню частоти виявлення протеїнурії, підвищенню швидкості клубочкової фільтрації, зниженню ступеня гіперкреатинінемії.
Цель исследования — установление возможного влияния комплекса средств — метформина, розувастатина, эссенциальных фосфолипидов и кверцетина на клиническое течение неалкогольного стеатогепатита (НАСГ), диабетической болезни почек, сахарного диабета (СД) типа 2, а также на состояние липидного спектра крови, параметры компенсации углеводного обмена, степень инсулинорезистентности, которые являются факторами прогрессирования НАСГ и диабетической болезни почек. Материалы и методы. Проведенные исследования в динамике лечения у 60 больных НАСГ с СД типа 2 и диабетической болезнью почек I–III стадии, среди которых у 48 пациентов был установлен НАСГ легкой активности, а у 12 — умеренной активности. Коморбидным заболеванием у всех пациентов с НАСГ был СД типа 2 средней степени тяжести, у 15 человек он был в состоянии компенсации, у 45 — субкомпенсированный. Состояние углеводного обмена устанавливали по уровню гликемии натощак и через 2 часа после еды глюкозооксидазным методом, по содержанию в крови инсулина натощак (DRG System) методом иммуноферментного анализа, содержанию в крови гликированного гемоглобина с помощью стандартных наборов реактивов «Simko Ltd» (Львов). Результаты. Через месяц от начала терапии астеновегетативный синдром значительно меньшей интенсивности сохранялся лишь у одного человека (3,13 %) второй группы, тогда как в первой группе он оставался у 9 больных (32,1 %). В то же время у большинства больных второй группы исчезли ощущение тяжести и боль в правой подреберной области (соответственно у 31 (96,9 %) против 16 (57,1 %) в первой группе (р < 0,05), а также практически не беспокоили диспептические явления (24 больных второй группы (75,0 %) против 11 человек (39,3 %) в первой группе). Через месяц от начала лечения не было зарегистрировано клинических проявлений синдрома холестаза у 20 (62,5 %) больных второй группы и только у 10 больных (35,7 %) в первой группе (р < 0,05). Отмечено положительное влияние дополнительного к комплексной терапии назначения кверцетина на регрессию гепатомегалии, которая после лечения в течение одного месяца оставалась лишь у 5 лиц второй группы (15,6 %). Выводы. Комплексная терапия эссенциальными фосфолипидами, розувастатином, метформином в сочетании с кверцетином у лиц с коморбидными НАСГ, СД типа 2 и диабетической болезнью почек способствует устранению основных клинико-лабораторных симптомов обострения НАСГ, снижению интенсивности воспалительного процесса в печени, обратному развитию явлений стеатоза печени, способствует нормализации гликемии. Комплексная терапия с добавлением кверцетина достоверно способствовала повышению эффективности лечения диабетической болезни почек на фоне СД типа 2, уменьшению частоты выявления протеинурии, повышению скорости клубочковой фильтрации, снижению степени гиперкреатининемии.
Background. The purpose of the study was to determine the probable effect of a complex of metformin, rosuvastatin, essential phospholipids, and quercetin on the clinical course of non-alcoholic steatohepatitis, diabetic kidney disease, type 2 diabetes mellitus, as well as on the state of blood lipid spectrum, parameters of carbohydrate metabolism compensation which are the factors of the progression of non-alcoholic steatohepatitis and diabetic kidney disease. Materials and methods. The dynamic of treatment was studied in 60 patients with non-alcoholic steatohepatitis with type 2 diabetes mellitus and stage I–III diabetic kidney disease, among whom 48 patients were diagnosed with mild non-alcoholic steatohepatitis and 12 with moderate activity. The comorbid disease in all patients with non-alcoholic steatohepatitis was type 2 diabetes mellitus of moderate severity, among which 15 people were at the stage of compensation, 45 were subcompensated. The state of carbohydrate metabolism was determined by fasting blood glucose and 2 hours after a meal by glucose oxidase method, fasting insulin content (DRG System) by enzyme-linked immunosorbent assay, blood glycosylated hemoglobin content using standard sets of reagents “Simko Ltd”. Results. One month after the start of therapy, asthenic syndrome of much lower intensity persisted only in 1 person (3.13 %) of the second group, while in the first group, it remained in 9 patients (32.1 %). At the same time in the majority of patients of the second group, the feeling of heaviness and pain in the right hypochondrium disappeared (in 31 (96.9 %) against 16 (57.1 %) in the first group (p < 0.05), respectively, and almost no dyspeptic symptoms disturbed (in 24 patients of group 2 (75.0 %) against 11 people (39.3 %) in group 1). A month after the start of treatment, no clinical manifestations of cholestasis were registered in 20 (62.5 %) patients of group 2 and only in 10 patients (35.7 %) in group 1 (p < 0.05). Quercetin in a complex treatment was found to have a positive effect on hepatomegaly regression, which remained in 5 patients (15.6 %) in group 2. Conclusions. The complex therapy with essential phospholipids, rosuvastatin, metformin in combination with quercetin in patients with comorbid non-alcoholic steatohepatitis, type 2 diabetes mellitus, and diabetic renal disease helps to eliminate the main clinical and laboratory symptoms of exacerbation of non-alcoholic steatohepatitis, helps to normalize blood glucose. The complex therapy with the addition of quercetin probably helped to increase the effectiveness of treatment of diabetic kidney disease against the background of type 2 diabetes mellitus, reduced the incidence of proteinuria, increased glomerular filtration rate, reduced hypercreatininemia.
Вступ
Актуальність пошуку оптимальних способів лікування пацієнтів із коморбідним перебігом неалкогольного стеатогепатиту (НАСГ), що розвинувся на тлі цукрового діабету типу 2 (ЦД2), зумовлена тим, що зазначені захворювання мають низку спільних причинно-наслідкових механізмів, а за умов розвитку діабетичної хвороби нирок (ДХН) — ще і низку механізмів взаємообтяження [1–4]. Велика кількість досліджень, присвячених вивченню даної коморбідності, свідчить про значну актуальність цієї проблеми в Україні та у світі і низку не вирішених на сьогодні питань, які стосуються особливостей клінічного перебігу цих захворювань, не відомих досі механізмів їх прогресування і, найголовніше, нагальної потреби в розробці методів лікування шляхом усунення якомога більшої кількості ланок патогенезу їх взаємообтяження.
Чільне місце в механізмах прогресування НАСГ та ДХН у хворих на ЦД2 займає ендотеліальна дисфункція (ЕД), найважливішими чинниками якої є гіперглікемія, дис- та гіперліпідемія, діабетична мікро- та макроангіопатія, атеросклеротичне ураження судин [1, 3, 5–7]. Упродовж останніх років проведена низка досліджень, які доводять патогенетичну роль корекції ЕД, гіперліпідемії та гіперглікемії у комплексному лікуванні гострих та хронічних форм ішемічної хвороби серця, серцевої недостатності, гострих порушень мозкового кровообігу (ішемічний інсульт), макроангіопатій при ЦД2 за допомогою кверцетину [8–10].
Кверцетин — флавоноїд рослинного походження, модулює активність ферментів фосфоліпаз, ліпопротеїнліпази, фосфогеназ, які беруть участь у деградації фосфоліпідів, проатерогенних ліпопротеїдів; чинить власну гіполіпідемічну дію [11, 12]. Препарат справляє потужну протизапальну дію, гальмуючи 5-ліпоксигеназу, циклооксигенази, гіалуронідазу, низку протеїназ, кальційзалежну АТФазу, синтез лейкотрієнів LTC4 і LTВ4, має імуномодулюючі властивості, нормалізує субпопуляційний склад лімфоцитів і знижує рівень їх активації, гальмує продукцію прозапальних цитокінів ІЛ-1β, ІЛ-8 [13, 14]. Існує низка повідомлень про гіпохолестеринемічні, жовчогінні, антихолестатичні, гепатопротекторні властивості кверцетину, встановлені в експерименті у щурів із ожирінням та НАСГ [15–19]. Водночас ймовірний вплив кверцетину на функціональний стан печінки та нирок, маркери їх пошкодження за умов ураження запальним, дисметаболічним процесом (НАСГ) та дисциркуляторних змін нирок (ДХН) у хворих на ЦД2, вплив на ланки їх патогенезу та механізми прогресування досі вивчалися на обмежених контингентах пацієнтів або лише в експерименті.
Метою дослідження було з’ясування ймовірного впливу комплексу засобів — метформіну, розувастатину, есенціальних фосфоліпідів (ЕФЛ) та кверцетину на клінічний перебіг неалкогольного стеатогепатиту, діабетичної хвороби нирок, цукрового діабету типу 2, а також на стан ліпідного спектра крові, параметри компенсації вуглеводного обміну, ступінь інсулінорезистентності, які є чинниками прогресування НАСГ та ДХН.
Матеріали та методи
Проведені дослідження в динаміці лікування у 60 хворих на НАСГ із ЦД2 та ДХН І–ІІІ стадії, серед яких у 48 пацієнтів (80,0 %) було встановлено НАСГ слабкої активності, а у 12 (20,0 %) — НАСГ помірної активності. Коморбідним захворюванням у 100 % хворих на НАСГ був ЦД2 середнього ступеня тяжкості, у 15 осіб (25,0 %) він був у стані компенсації, у 45 (75,0 %) — субкомпенсований. Усі хворі на НАСГ та ЦД2 мали коморбідну ДХН, зокрема 21 пацієнт із ДХН І–ІІ стадії (35,0 %), 20 осіб із ДХН ІІІ стадії (33,3 %), 19 осіб із ДХН IV стадії (31,7 %). У 15 (25,0 %) обстежених осіб було встановлено вторинну артеріальну гіпертензію (АГ) ниркового генезу І–ІІ ступеня, у 11 осіб (18,3 %) було встановлено есенціальну АГ І–ІІ стадії, І–ІІ ступеня. Крім ЦД2 та ДХН із АГ, у хворих на НАСГ на момент включення в дослідження не було встановлено іншої хронічної загальносоматичної патології в активній фазі або у стані декомпенсації (серця, судин, нирок, системи травлення, крові та кровотворення, неврологічних, психіатричних, онкологічних, ендокринних, ревматологічних захворювань, жирової хвороби печінки алкогольної етіології), гострих захворювань, вагітності, лактації.
Залежно від призначеного лікування за випадковою ознакою обстежені хворі були поділені на дві групи. Хворі першої групи (контрольна, 28 осіб) отримували гіпокалорійну дієту з урахуванням обмежень дієти № 9, есенціальні фосфоліпіди 1800 мг/добу, 30 днів з метою лікування активного НАСГ; із приводу супутнього ЦД2 та гіперліпідемії призначали метформіну гідрохлорид 1000 мг/добу, розувастатин 5 мг/добу упродовж одного місяця.
Другу групу становили пацієнти (32 особи), які, окрім аналогічних дієтичних рекомендацій, ЕФЛ, антигіперглікемізуючої та гіполіпідемічної терапії упродовж місяця додатково отримували кверцетин по 500 мг внутрішньовенно у 100 мл ізотонічного розчину натрію хлориду упродовж 10 днів. Середній вік пацієнтів становив 53,8 ± 3,52 року. Групу порівняння для презентації середніх референтних значень показників гомеостазу становили 30 здорових осіб (ЗО) відповідного віку.
Діагноз НАСГ встановлювали згідно з уніфікованим клінічним протоколом, затвердженим наказом МОЗ України № 826 від 06.11.2014 р., за наявності критеріїв виключення хронічних дифузних захворювань печінки вірусного, спадкового, автоімунного чи медикаментозного генезу як причини цитолітичного, холестатичного, мезенхімально-запального синдромів, а також результатів ультрасонографії (УСГ) на ультразвуковому сканері Ultima PA («Радмир» ДП АТ НДІРВ, Харків, Україна) із зсувнохвильовою еластографією для визначення стадії фіброзу печінки, обчисленням гепаторенального індексу та біохімічного розширеного стеатотесту («SteatoTest», «ASH» та «NASH-Test» (BioPredictive, Франція)) — для встановлення ступеня стеатозу печінки та його природи (алкогольної чи неалкогольної).
Діагностику ЦД2 здійснювали згідно з уніфікованим клінічним протоколом, затвердженим наказом МОЗ України № 1118 від 21.12.2012 р. Діагностику та лікування хронічної хвороби нирок здійснювали за рекомендаціями клінічних настанов ДУ «Інститут нефрології НАМН України» (2012). Обчислення показника швидкості клубочкової фільтрації (ШКФ) здійснювали за допомогою калькулятора ШКФ ДУ «Інститут нефрології НАМН України» за середньою величиною трьох обчислених показників: кліренсу креатиніну за формулою Кокрофта — Голта, МDRD та CKD EPI. Визначення стадій ДХН здійснювали за класифікацією C.E. Mogensen (1983).
Досліджували в динаміці лікування: клінічні симптоми захворювань, УСГ-картину печінки та нирок, маркери пошкодження та функціональні проби печінки, ліпідний спектр крові, показники компенсації вуглеводного обміну, ступінь ІР. Стан вуглеводного обміну встановлювали за рівнем глікемії натще та через 2 години після їди глюкозооксидазним методом, за вмістом у крові інсуліну натще (DRG System) методом імуноферментного аналізу, вмістом у крові глікованого гемоглобіну (HbA1c) за допомогою стандартних наборів реактивів «Simko Ltd» (Львів). Ступінь ІР встановлювали за величиною індексу HOMA-IR (D.R. Matthews et al.), який обчислювали із використанням програми HOMA2 Calculator Version 2.2 Diabetes Trials Unit University of Oxford (Велика Британія). Ліпідний спектр крові вивчали за вмістом в крові загальних ліпідів, загального холестерину (ХС), тріацилгліцеролів (ТГ), ХС ліпопротеїнів низької щільності (ЛПНЩ) та високої щільності (ЛПВЩ) за допомогою діагностичних наборів фірми «Simko Ltd» (Львів).
Дослідження виконані з дотриманням основних положень GСР (1996 р.), Конвенції Ради Європи про права людини та біомедицину (від 04.04.1997 р.), Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення наукових медичних досліджень за участю людини (1964–2013 рр.), наказу МОЗ України № 690 від 23.09.2009 р., № 616 від 03.08.2012 р.
Дослідження схвалене до виконання комісією з питань біомедичної етики ВДНЗ України «Буковинський державний медичний університет» (протокол № 2 від 17.10.2019 р.).
Перед перевіркою статистичних гіпотез проведено аналіз нормальності розподілу величин у рандомізованих вибірках через визначення коефіцієнтів асиметрії та ексцесу за допомогою критерію Хана — Шапіро — Уїлка. Вірогідність різниці середнього арифметичного та його похибки між групами дослідження визначали за допомогою двостороннього непарного t-критерію Стьюдента. Різницю вважали вірогідною при рівні значущості р < 0,05. Т-критерій Стьюдента застосовували лише в разі нормального розподілу за рівності генеральних дисперсій вибірок, що порівнювалися, яку перевіряли за допомогою F-критерію Фішера. В інших випадках для порівняння отриманих результатів використовували непараметричний ранговий критерій Манна — Уїтні. Вірогідність змін варіацій у динаміці лікування в разі нормального розподілу у вибірках визначали за парним критерієм Стьюдента, в інших випадках — за непараметричним парним Т-критерієм Вілкоксона. Для виявлення ефективності застосування лікувальних програм використовували методику розрахунку показника відношення шансів — Odds Radio (OR) та визначення його 95% довірчого інтервалу за допомогою програмного забезпечення Past3. Для проведення статистичного аналізу отриманих результатів використовували програмні пакети Statistica for Windows версії 8.0 (Stat Soft Inc., США), Microsoft Excel 2007 (Microsoft, США).
Результати
Динаміка клінічних синдромів у хворих на НАСГ та коморбідні ДХН та ЦД2 до та після лікування наведена у табл. 1. Під впливом отримуваної терапії пацієнти другої групи відмічали покращення самопочуття, зменшення симптомів астеновегетативного, інтоксикаційного синдрому, диспептичних проявів на 6–7-й день від початку лікування, тоді як хворі першої групи — лише з 12–13-го дня. Через місяць від початку терапії астеновегетативний синдром значно меншої інтенсивності зберігався лише в однієї особи (3,13 %) другої групи, тоді як у першій групі він залишався у 9 хворих (32,1 %) (р < 0,05). У той же термін у більшості хворих другої групи зникло відчуття тяжкості та біль у правій підреберній ділянці (відповідно у 31 (96,9 %) проти 16 (57,1 %) у першій групі (р < 0,05)), а також практично не турбували диспептичні явища (у 24 хворих другої групи (75,0 %) проти 11 осіб (39,3 %) у першій групі). Через місяць від початку лікування не було зареєстровано клінічних проявів синдрому холестазу в 20 (62,5 %) хворих другої групи та лише у 10 хворих (35,7 %) у першій групі (р < 0,05) (табл. 1). Відзначається позитивний вплив додаткового до комплексної терапії призначення кверцетину на регресію гепатомегалії, яка після лікування упродовж одного місяця залишалася лише у 5 осіб другої групи (15,6 %), у той час як у першій групі гепатомегалія спостерігалася у 19 осіб (67,9 %) (р < 0,05). Після проведеного лікування спленомегалія реєструвалася лише в одного хворого другої групи (3,13 %), у той час як у першій групі збільшення селезінки встановлено у 8 осіб (28,6 %) (р < 0,05).
/35.jpg)
Ефективність проведеної терапії щодо усунення стеатозу гепатоцитів була вищою у хворих другої групи, оскільки, згідно з результатом біохімічного стеатотесту, стеатоз гепатоцитів мінімального ступеня залишався в 11 осіб другої групи (34,4 %) проти 24 осіб першої групи (85,7 %) із наявністю вірогідної різниці між групами (р < 0,05). Патогенетичним підґрунтям отриманих даних є вірогідна гіполіпідемічна дія кверцетину із потенціюванням дії статинів: так, після лікування у другій групі було зареєстровано лише 10 осіб із загальною гіперліпідемією за рахунок ХС ЛПНЩ (31,3 %), у той час як у першій групі гіперліпідемію реєстрували після лікування у 23 осіб (82,1 %), тобто ефективність терапії кверцетином перевищує традиційну у 2,63 раза, із наявністю вірогідної різниці між групами (р < 0,05).
Проаналізовані результати дослідження біохімічних маркерів ДХН після лікування також вказують на вищу ефективність терапії у хворих другої групи у 3,2 раза порівняно з першою групою за показником підвищення ШКФ (р < 0,05), у 3,1 раза щодо зменшення частоти виявлення протеїнурії (р < 0,05), у 4,3 раза щодо усунення гіперкреатинінемії (р < 0,05) із наявністю вірогідної різниці між групами (р < 0,05).
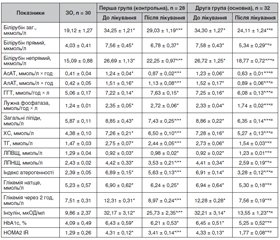
Аналіз показників біохімічного аналізу крові, які вказують на динаміку біохімічних синдромів НАСГ, глікемії та ліпідограми, свідчить про вищу ефективність додаткового призначення кверцетину до терапії, передбаченої протоколом, у хворих на ЦД2 із ДХП. Так, підвищений до лікування вміст у крові загального білірубіну (у 1,8 раза, p < 0,05) в обох групах вірогідно зменшився — у другій групі у 1,4 раза (p < 0,05) за рахунок як його некон’югованої фракції, що зменшилась у 1,4 раза із нормалізацією показника, так і кон’югованої фракції — у 1,4 раза (p < 0,05) (табл. 2). У першій групі вміст загального білірубіну знизився в 1,2 раза (p < 0,05) за рахунок зниження лише некон’югованої фракції у 1,2 раза (p < 0,05), прямий білірубін мав лише тенденцію до зниження на 10,3 % (p > 0,05).
/36.jpg)
Нами встановлено істотний вплив лише терапії із додаванням кверцетину на маркери холестазу: так, підвищені до лікування активність лужної фосфатази (ЛФ) у 1,9 раза (p < 0,05) та гаммаглутамілтранспептидаза (ГГТ) в 1,4 раза (p < 0,05) знизились лише у другій групі — у 1,2 раза (p < 0,05) без нормалізації показників, а у хворих першої групи показники активності ЛФ та ГГТ навіть мали тенденцію до підвищення. Як демонструють результати дослідження (табл. 2), уміст загальних ліпідів крові, підвищений до лікування у 1,5 раза (p < 0,05), під впливом лікування у другій групі знизився в 1,4 раза (р < 0,05), у той час як у першій групі зниження становило 1,2 раза (р < 0,05), із наявністю вірогідної різниці між показниками після лікування в групах (p < 0,05). Уміст загального ХС крові, підвищений до лікування в 1,7 раза (p < 0,05), після лікування у другій групі знизився на 27,6 % (р < 0,05), а у першій групі — на 10,5 % (р < 0,05) від показника до лікування, із наявністю вірогідної різниці між показниками після лікування в групах (p < 0,05). Найбільш істотним показником гіперліпідемії у хворих на НАСГ та тлі ЦД2 із ДХН є зростання вмісту у крові ТГ у 1,9 раза, що становить патоморфологічну основу стеатозу печінки. Максимальне зниження вмісту ТГ після лікування серед показників ліпідного спектра крові встановлено у хворих другої групи — на 43,6 % із нормалізацією показника проти зниження на 11,3 % у хворих першої групи (р < 0,05). Позитивний вплив кверцетину відзначений нами і щодо підвищеного в 1,8 раза (р < 0,05) до лікування вмісту в крові ХС ЛПНЩ: зниження після лікування в другій групі у 1,7 раза (р < 0,05) порівняно з хворими першої групи — у 1,3 раза (р < 0,05) (табл. 2).
Проведений аналіз показників глікемії натще та постпрандіальної глікемії у групах порівняння показав більш суттєве зниження і оптимізацію вмісту глюкози в крові у другій групі хворих: відповідно в 1,3 та 1,6 раза (р < 0,05) проти вірогідного зниження лише вмісту постпрандіальної глюкози у 1,4 раза (р < 0,05) у першій групі (табл. 2). Оскільки, крім дієтичних рекомендацій, хворі обох груп отримували як антигіперглікемізувальний засіб метформін, зазначені ефекти у хворих другої групи ми можемо віднести на рахунок впливу комбінації метформіну із кверцетином. Свідченням цього стало істотне зниження інсулінемії в обох групах (у 1,3 та 2,4 раза (р < 0,05)) із нормалізацією показника в другій групі хворих, вірогідне зниження із нормалізацією показника вмісту в крові HbA1c як маркера тривалості гіперглікемії (лише у хворих другої групи у 1,2 раза (р < 0,05)), а також істотное зниження HOMA IR — у 1,3 та 2,4 раза відповідно (р < 0,05) як маркера ступеня ІР (табл. 2). Таким чином, нами відзначений вірогідний позитивний вплив статинів, метформіну та ЕФЛ у комбінації з кверцетином на показники ліпідного спектру крові, глікемії та ІР, що свідчить про гіполіпідемічні властивості кверцетину, здатність оптимізувати вміст глюкози в крові та знижувати ступінь ІР.
Обговорення
Зважаючи на дані літератури, які вказують на те, що статини та метформін можуть негативно впливати на функціональний стан печінки і викликати підвищення маркерів пошкодження гепатоцитів за умов тривалого застосування, ми вивчили ймовірний вплив комплексної терапії на біохімічні маркери цитолізу, холестазу, а також прояви печінковоклітинної недостатності (ПКН) та мезенхімального запалення. Результати дослідження наведені у табл. 1. Так, через місяць від початку терапії активність цитолізу гепатоцитів значно меншої інтенсивності зберігалася лише у 6 осіб (15,6 %) другої групи, тоді як у першій групі він залишався у 17 хворих (60,7 %), із наявністю вірогідної різниці між групами (р < 0,05). Встановлено позитивний вплив додаткового призначення кверцетину щодо усунення мезенхімально-запального синдрому, маркери якого після лікування залишалися активними лише у 7 осіб другої групи (21,9 %), у той час як у першій групі — у 19 осіб (67,9 %), та синдрому ПКН (15,6 проти 60,7 % відповідно), із наявністю вірогідної різниці між групами (р < 0,05). Аналіз біохімічних маркерів холестазу після лікування вказує на вищу ефективність терапії у хворих другої групи у 1,6 раза порівняно з першою групою, де взагалі маркери холестазу мали тенденцію до зростання, однак аналіз довірчого інтервалу вказує на відсутність вірогідної різниці показників між групами (р > 0,05) (табл. 1).
Незважаючи на те, що статини і метформін можуть справити негативний вплив на цілісність мембрани гепатоцита, нами не було встановлено їх негативного впливу на ферментативні маркери цитолізу. Навпаки, під впливом призначеної терапії у хворих обох груп активність АсАТ, підвищена до лікування у 3,0 раза (p < 0,05), знизилась вірогідно у першій групі в 1,4 раза, у другій групі — у 1,9 раза (p < 0,05), активність АлАТ, підвищена до лікування у 3,6 раза (p < 0,05), знизилась відповідно у 1,3 та 1,7 раза (p < 0,05), із наявністю істотної різниці між показниками після лікування у групах (p < 0,05). При порівнянні показників після лікування із такими показниками у ЗО слід вказати, що в жодній групі ці показники референтних значень не досягли (p < 0,05).
Комплексна терапія з включенням кверцетину сприяла вірогідному підвищенню вмісту в крові антиатерогенних ЛПВЩ (в 1,3 раза (р < 0,05)) із нормалізацією показника після проведеного лікування, у той час як традиційна терапія у даного контингенту осіб до будь-яких вірогідних змін показників не призводила (табл. 2). Після проведеної терапії кверцетином з точки зору досягнення цільових рівнів ЛПВЩ було відзначено істотне зниження індексу атерогенності: у 2,1 раза у хворих другої групи (р < 0,05) проти 1,2 раза у хворих першої групи (р < 0,05) (табл. 2). Підсумовуючи вищесказане, можна дійти висновку про те, що кверцетин у комбінації із розувастатином, метформіном та ЕФЛ, кожен із яких є самостійним гіполіпідемічним засобом, потенціює їх дію і тим самим знижує вміст ХС ЛПНЩ у сироватці крові; терапія із додаванням кверцетину перевищує за інтенсивністю впливу традиційну комбінацію цих засобів без кверцетину.
Висновок
Комплексна терапія ЕФЛ, розувастатином, метформіном у комбінації з кверцетином в осіб із коморбідними НАСГ, ЦД2 та ДХН сприяє усуненню основних клініко-лабораторних симптомів загострення НАСГ, вірогідному зниженню інтенсивності запального процесу в печінці (зниження маркерів цитолізу, мезенхімального запалення), оборотному розвитку явищ стеатозу печінки (зниження ступеня стеатозу за даними стеатотесту) завдяки оптимізації ліпідного спектра крові зі зниженням умісту ХС проатерогенних ліпопротеїнів низької щільності, холестерину та тріацилгліцеролів у крові, вірогідному зростанню вмісту антиатерогенних ліпопротеїнів високої щільності в крові, сприяє нормалізації глікемії, зниженню інсулінемії, зниженню ступеня ІР із усуненням патогенетичного підґрунтя НАСГ. Комплексна терапія з додаванням кверцетину вірогідно сприяла підвищенню ефективності лікування ДХН на тлі ЦД2, зменшенню частоти виявлення протеїнурії, підвищенню ШКФ, зниженню ступеня гіперкреатинінемії.
Перспективою наших подальших досліджень у даному напрямку є встановлення інших плейотропних ефектів кверцетину за умов комплексного лікування різних коморбідних патологій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та їх власних фінансових інтересів, які могли б тлумачитись як такі, що впливають на результати та інтерпретацію їх рукопису.

/35.jpg)
/36.jpg)