Международный эндокринологический журнал Том 16, №8, 2020
Вернуться к номеру
Распространенность различных форм несахарного диабета и его осложнений в Республике Узбекистан
Авторы: Урманова Ю.М., Хамраева Д.И.
Ташкентский педиатрический медицинский институт, г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Центральний нецукровий діабет (НД) — захворювання, що характеризується нездатністю нирок реабсорбувати воду і концентрувати сечу, має в своїй основі дефект синтезу або секреції вазопресину і проявляється вираженою спрагою і екскрецією великої кількості розведеної сечі. Мета дослідження — оцінка поширеності різних форм нецукрового діабету та його ускладнень, якості діагностики й лікування за даними обласних ендокринологічних диспансерів Республіки Узбекистан (РУз). Матеріали та методи. У дослідженні використані дані реєстру хворих на НД, які перебувають на обліку в обласних ендокринологічних диспансерах усіх регіонів Республіки Узбекистан і Республіки Каракалпакстан (РКК) в 2018 році, а також власні спостереження. Встановлено, що в РУз та РКК на кінець 2018 року на обліку перебувало 1237 дітей і підлітків, хворих на НД. Проведено аналіз 397 випадків НД. Середній вік хворих становив 56 ± 2 роки. Результати. Переважно спостерігалася ідіопатична форма НД — 214 хворих (55,8 %), на другому місці за частотою центральна форма НД — 129 хворих (40,9 %), рідше спостерігалася ниркова — 26 (3,3 %) і спадкова форма захворювання — 3 (0,2 %). Більшість хворих (48,9 %) не пов’язували початок захворювання з будь-яким фактором. Однак у 20,4 % хворих нецукровий діабет розвинувся після травми черепа. У 4,8 % хворих причиною хвороби були пухлини гіпоталамо-гіпофізарної ділянки, а у 14,5 % хворих — нейровірусна інфекція. Спадкова схильність була у 0,4 % хворих. Висновки. У регіонах Республіки Узбекистан і РКК найчастіше спостерігалися дві форми нецукрового діабету: ідіопатична — 214 (55,8 %) і центральна — 129 випадків (40,9 %). Найбільше число хворих мали вік від 0 до 9 років — 85 пацієнтів (22,9 %). Середній вік хворих дітей і підлітків становив 7,6 року. Захворювання частіше відзначалося у осіб чоловічої статі (51,1 %).
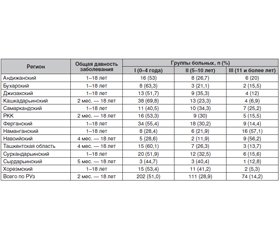
Актуальность. Центральный несахарный диабет (НД) — заболевание, характеризующееся неспособностью почек реабсорбировать воду и концентрировать мочу, имеющее в своей основе дефект синтеза или секреции вазопрессина и проявляющееся выраженной жаждой и экскрецией большого количества разведенной мочи. Цель исследования — оценка распространенности различных форм несахарного диабета и его осложнений, качества диагностики и лечения по данным областных эндокринологических диспансеров Республики Узбекистан (РУз). Материалы и методы. В исследовании использованы данные регистра больных НД, состоящих на учете в областных эндокринологических диспансерах всех регионов Республики Узбекистан и Республики Каракалпакстан (РКК) в 2018 году, а также собственные наблюдения. Установлено, что в РУз и РКК на конец 2018 г. на учете состояли 1237 детей и подростков, больных НД. Проведен анализ 397 случаев заболевания НД. Средний возраст больных составил 5,6 ± 2,0 года. Результаты. Преимущественно наблюдалась идиопатическая форма НД — 214 больных (55,8 %), на втором месте по встречаемости находилась центральная форма НД — 129 больных (40,9 %), в то время как реже наблюдалась почечная форма — 26 (3,3 %) и наследственная форма заболевания — 3 (0,2 %). Большинство больных (48,9 %) не связывали начало заболевания с каким-либо фактором. Однако у 20,4 % больных несахарный диабет развился после травмы черепа. У 4,8 % больных причиной болезни явились опухоли гипоталамо-гипофизарной области, а у 14,5 % больных — нейровирусная инфекция. Наследственная предрасположенность была у 0,4 % больных. Выводы. В регионах Республики Узбекистан и РКК наиболее часто наблюдались две формы несахарного диабета: идиопатическая — 214 (55,8 %) и центральная — 129 случаев (40,9 %). Наибольшее число больных было в возрасте от 0 до 9 лет — 85 пациентов (22,9 %). Средний возраст больных детей и подростков составил 7,6 года. Заболевание чаще встречалось у лиц мужского пола (51,1 %).
Background. Central diabetes insipidus is characterized by the inability of the kidneys to reabsorb water and concentrate urine, which is due to the defect in the synthesis or secretion of vasopressin and is manifested by severe thirst and excretion of large amounts of diluted urine. The purpose of the study is to assess the prevalence of various forms of diabetes insipidus and its complications, the quality of diagnosis and treatment according to the data of regional endocrinological dispensaries of the Republic of Uzbekistan. Materials and methods. The study used data from the register of patients with diabetes insipidus registered in regional endocrinological centers in all regions of the Republic of Uzbekistan and the Republic of Karakalpakstan in 2018, as well as our own observations. It was found that by the end of 2018, 1,237 children and adolescents with diabetes insipidus were registered in the Republic of Uzbekistan and the Republic of Karakalpakstan. Of these, data of 397 patients with diabetes insipidus were analyzed. Their average age was 5.6 ± 2 years. Results. The idiopathic form of diabetes insipidus was observed predominantly — in 214 individuals (55.8 %), the second most common form was central diabetes insipidus — 129 patients (40.9 %), while the renal and hereditary forms of the disease were less common — 26 (3.3 %) and 3 (0.2 %), respectively. The majority of patients (48.9 %) did not associate the onset of the disease with any factor. However, in 20.4 % of individuals, diabetes insipidus developed after a skull injury. In 4.8 % of patients, the cause of the disease was tumors of the hypothalamic-pituitary region, and in 14.5 % — neuroviral infection. Hereditary predisposition was observed in 0.4 % of patients. Conclusions. In the regions of the Republic of Uzbekistan and the Republic of Karakalpakstan, two forms of diabetes insipidus were most common: idiopathic — 214 (55.8 %) and central — 129 cases (40.9 %). Most of the patients — 85 children (22.9%) — were aged 0 to 9 years. The average age of ill children and adolescents was 7.6 years. The disease was more often detected in males (51.1 %).
нецукровий діабет; епідеміологія; діти; підлітки
несахарный диабет; эпидемиология; дети; подростки
diabetes insipidus; epidemiology; children; adolescents
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
- Garrahy A., Sherlock M., Thompson C.J. Management of endocrine disease: Neuroendocrine surveillance and management of neurosurgical patients. Eur. J. Endocrinol. 2017. 176 (5). R217-R233. doi. 10.1530/EJE-16-0962
- Dedov I.I., Mel’nichenko G.A., Pigarova E.A., Dzeranova L.K., Rozhinskaya L.Y., Przhiyalkovskaya E.G. et al. Federal clinical guidelines for the diagnosis and treatment of diabetes insipidus in adults. Obesity and metabolism. 2018. 15 (2). 56-71. doi: 10.14341/OMET9670 (in Russian)
- Nayak P., Montaser A.S., Hu J., Prevedello D.M., Kirschner L.S., Ghalib L. Predictors of Postoperative Diabetes Insipidus Following Endoscopic Resection of Pituitary Adenomas. J. Endocr. Soc. 2018. 2 (9). 1010-1019. doi: 10.1210/js.2018-00121.
- Milano S., Carmosino M., Gerbino A., Svelto M., Procino G. Hereditary Nephrogenic Diabetes Insipidus: Pathophysiology and Possible Treatment. An Update. Int. J. Mol. Sci. 2017. 18 (11). pii: E2385. doi: 10.3390/ijms18112385.
- Robertson G.L. Diabetes insipidus: Differential diagnosis and management. Best Pract. Res. Clin. Endocrinol. Metab. 2016. 30 (2). 205-18. doi: 10.1016/j.beem.2016.02.007.
- Garrahy A., Sherlock M., Thompson C.J. Management of endocrine disease: Neuroendocrine surveillance and management of neurosurgical patients. Eur. J. Endocrinol. 2017. 176 (5). R217-R233. doi: 10.1530/EJE-16-0962.
- Pigarova E.A., Dzeranova L.K. Diagnosis and treatment of central diabetes insipidus. Obesity and metabolism. 2014. 11 (4). 48. (in Russian). doi: 10.14341/omet2014448-55.
- Chang L.S., Yialamas M.A. Checkpoint Inhibitor-Associated Hypophysitis. J. Gen. Intern. Med. 2017. 33 (1). 125-127. doi: 10.1007/s11606-017-4135-6.
- Ghirardello S., Malattia C., Scagnelli P., Maghnie M. Current Perspective on the Pathogenesis of Central Diabetes Insipidus. J. Pediatr. Endocrinol. Metab. 2005. 18 (7). doi: 10.1515/jpem.2005.18.7.631.
- Adams J.R., Blevins L.S., Allen G.S. et al. Disorders of water metabolism following transsphenoidal pituitary surgery: A single institution’s experience. Pituitary. 2006. 9 (2). 93-99. doi: 10.1007/s11102-006-9276-2.
- Arai S.R., Butzlaff A., Stotts N.A., Puntillo K.A. Quench the Thirst: Lessons From Clinical Thirst Trials. Biol. Res. Nurs. 2013. 16 (4). 456-466. doi: 10.1177/1099800413505900.
- Milano S., Carmosino M., Gerbino A. et al. Hereditary Nephrogenic Diabetes Insipidus: Pathophysiology and Possible Treatment. An Update. International Journal of Molecular Sciences. 2017. 18 (11). 2385. doi: 10.3390/ijms18112385.
- Fleseriu M., Hashim I.A., Karavitaki N. et al. Hormonal Replacement in Hypopituitarism in Adults: An Endocrine Society Clinical Practice Guideline. J. Clin. Endocr. Metab. 2016. 101 (11). 3888-3921. doi: 10.1210/jc.2016-2118.
- Bhatia M.S., Goyal A., Saha R., Doval N. Psychogenic Polydipsia — Management Challenges. Shanghai Archives of Psychiatry. 2017. 29 (3). 180-183. doi: 10.11919/j.issn.1002-0829.216106.
- Chanson P., Salenave S. Treatment of neurogenic diabetes insipidus. Ann. Endocrinol. (Paris). 2011. 72 (6). 496-499. doi: 10.1016/j.ando.2011.09.001.
- Arima H., Oiso Y., Juul K.V. et al. Efficacy and safety of desmopressin orally disintegrating tablet in patients with central diabetes insipidus: results of a multicenter open-label dose-titration study. Endocr. J. 2013. 60 (9). 1085-1094. doi: 10.1507/endocrj.EJ13-0165.
- Robertson G.L. Diabetes insipidus: Differential diagnosis and management. Best Practice & Research Clinical Endocrinology & Metabolism. 2016. 30 (2). 205-218. doi: 10.1016/j.beem.2016.02.007.

/118.jpg)
/119.jpg)