Международный эндокринологический журнал Том 16, №8, 2020
Вернуться к номеру
До питання розвитку артеріальної гіпертензії в міських мешканців з ожирінням
Авторы: Єфіменко Т.І., Місюра К.В.
ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
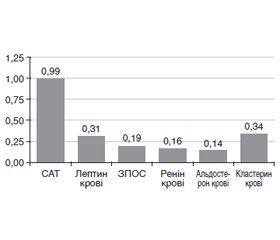
Актуальність дослідження обумовлена необхідністю оптимізації профілактики розвитку артеріальної гіпертензії (АГ) серед міського населення України, насамперед з ожирінням (Ож). Мета: деталізувати особливості розвитку АГ у міських мешканців з Ож, розробити метод прогнозування АГ на основі визначення особливостей взаємозв’язку параметрів, що характеризують основні ланки патогенезу обох патологій. Матеріали та методи. Обстежені 1094 мешканці м. Харкова, які не лікувалися в минулому з приводу Ож та АГ. Визначали індекс маси тіла, окружність талії, вимірювали артеріальний тиск. Методом біоімпедансного аналізу досліджували склад тіла пацієнтів, імуноферментним методом — рівні інсуліну, лептину, реніну, альдостерону та кластерину в сироватці крові. Особливості центральної гемодинаміки оцінювалися методом інтегральної реографії тіла: визначали ударний об’єм (мл), серцевий викид (л/хв), ударний індекс (мл/м2), серцевий індекс (л/хв • м2). Результати. Міські мешканці середнього віку з ожирінням потребують інтенсифікації профілактичної роботи щодо розвитку АГ. У чоловіків її треба розпочинати навіть у віці до 40 років. Розвиток поєднаної патології (АГ та Ож) в осіб середнього віку обумовлений наявністю інсулінорезистентності, що супроводжується змінами циркулюючих рівнів інсуліну, лептину, альдостерону, змінами ударного індексу та загального периферичного опору судин, виникненням системного низькоінтенсивного запалення в організмі. До факторів, які насамперед обумовлюють розвиток та прогресування Ож у даної категорії населення, слід віднести появу інсулінорезистентності. Визначення за допомогою методу інтегральної реографії тіла змін ударного індексу — інформативний маркер розвитку та прогресування АГ. Наявність поєднаної патології (АГ з Ож) характеризується змінами рівнів лептину та кластерину порівняно з пацієнтами з Ож без АГ, що також треба враховувати при розробці терапевтичних підходів. Висновки. Визначені під час роботи підходи до прогностичної класифікації, створеної за допомогою дискримінантного аналізу, міських мешканців середнього віку — представників української популяції можуть стати основою для оптимізації алгоритмів формування серед них груп ризику щодо розвитку Ож та АГ.
Актуальность исследования обусловлена необходимостью оптимизации профилактики артериальной гипертензии (АГ) среди городского населения Украины, в первую очередь с ожирением (Ож). Цель: детализировать особенности развития АГ у городских жителей с Ож, разработать метод прогнозирования АГ на основании определения особенностей взаимодействия параметров, которые характеризуют основные звенья патогенеза обеих патологий. Материалы и методы. Обследованы 1094 жителя г. Харькова, которые не лечились в прошлом по поводу Ож и АГ. Определяли индекс массы тела, окружность талии, измеряли артериальное давление. Методом биоимпедансного анализа исследовали состав тела пациентов, иммуноферментным методом — уровни инсулина, лептина, ренина, альдостерона и кластерина в сыворотке крови. Особенности центральной гемодинамики оценивались методом интегральной реографии тела: определяли ударный объем (мл), сердечный выброс (л/мин), ударный индекс (мл/м2), сердечный индекс (л/мин • м2). Результаты. Городские жители среднего возраста с ожирением нуждаются в интенсификации профилактической работы в отношении АГ. У мужчин ее нужно начинать уже в возрасте до 40 лет. Развитие сочетанной патологии (АГ и Ож) у лиц среднего возраста обусловлено наличием инсулинорезистентности, которая сопровождается изменениями циркулирующих уровней инсулина, лептина, альдостерона, изменениями ударного индекса и общего периферического сопротивления сосудов, возникновением системного низкоинтенсивного воспаления в организме. К факторам, которые в первую очередь обусловливают развитие и прогрессирование Ож у данной категории населения, следует отнести проявление инсулинорезистентности. Определение с помощью метода интегральной реографии тела изменений ударного индекса — информативный маркер развития и прогрессирования АГ. Наличие сочетанной патологии (АГ с Ож) характеризируется изменениями уровней лептина и кластерина по сравнению с пациентами с Ож без АГ, что также нужно учитывать при разработке терапевтических подходов. Выводы. Выявленные в процессе работы подходы к прогностической классификации, созданной с помощью дискриминантного анализа, городских жителей среднего возраста — представителей украинской популяции могут стать основой для оптимизации алгоритмов формирования средних групп риска развития Ож и АГ.
Background. The relevance of the study is due to the need to optimize the prevention of arterial hypertension (AH) among the urban population of Ukraine, primarily those with obesity. The purpose was to detail the features of AH development in obese urban residents, and to develop a method for predicting AH in this category of the population. Materials and methods. A total of 1,094 residents of the city of Kharkiv who had not been treated for obesity and AH were examined. Body mass index, waist circumference, blood pressure were evaluated. Bioimpedance analysis was used to study body composition, immunoassay — serum levels of insulin, leptin, renin, aldosterone and clusterin. Features of central hemodynamics were assessed by the method of integral body rheography: stroke volume (ml), cardiac output (L/min), stroke volume index (ml/m2), cardiac index (L/min/m2) were determined. Results. It was found that middle-aged urban residents with obesity require intensification of preventive work in terms of AH development. In men, it should be started even before the age of 40. Development of concomitant pathology of AH and obesity in middle-aged people is due to the presence of insulin resistance, which is accompanied by changes in the circulating levels of insulin, leptin, aldosterone, in the stroke volume index and total peripheral vascular resistance, the occurrence of low-grade systemic inflammation in the body. Patients with obesity and AH differ from those with AH without obesity in terms of the level of volemia, the severity of changes in hemodynamics caused by the functioning of the heart, total peripheral vascular resistance, the degree of changes in the renin-aldosterone system, and the intensity of low-grade systemic inflammation. The results of the work made it possible to assert that one of the factors that primarily determine the development and progression of obesity in this category of the population is insulin resistance. Integral body rheography, a method for detecting changes in the stroke volume index, is an informative marker for the development and progression of AH. The presence of concomitant pathology of AH and obesity is characterized by changes in the levels of leptin and clusterin compared to the patients with obesity without hypertension, which should also be taken into account when developing therapeutic approaches. Conclusions. The approaches to the prognostic classification (created using the discriminant analysis program) of middle-aged urban residents — representatives of the Ukrainian population, identified in the process of work, can become the basis for optimizing the algorithms for the formation of risk groups for the development of obesity and AH.
ожиріння; артеріальна гіпертензія; дискримінантний аналіз; прогнозування; профілактика
ожирение; артериальная гипертензия; дискриминантный анализ; прогнозирование; профилактика
obesity; arterial hypertension; discriminant analysis; prognosis; prevention
Вступ
Матеріали та методи
Результати
/124.jpg)
/127.jpg)
/128.jpg)
/128_2.jpg)
/128_3.jpg)
Обговорення
Висновки
- Shariq O.A., McKenzie T.J. Obesity-related hypertension: a review of pathophysiology, management, and the role of metabolic surgery. Gland Surg. 2020. 9(1). 80-93. doi: 10.21037/gs.2019.12.03.
- Jiang S.Z., Lu W., Zong X.F., Ruan H.Y., Liu Y. Obesity and hypertension. Exp. Ther. Med. 2016. 12(4). 2395-2399. doi: 10.3892/etm.2016.3667.
- Schütten M.T., Houben A.J., de Leeuw P.W., Stehouwer C.D. The Link Between Adipose Tissue Renin-Angiotensin-Aldosterone System Signaling and Obesity-Associated Hypertension. Physiology (Bethesda). 2017. 32(3). 197-209. doi: 10.1152/physiol.00037.2016.
- Cabandugama P.K., Gardner M.J., Sowers J.R. The Renin Angiotensin Aldosterone System in Obesity and Hypertension: Roles in the Cardiorenal Metabolic Syndrome. Med. Clin. North. Am. 2017. 101(1). 129-137. doi: 10.1016/j.mcna.2016.08.009.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1–7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- Cohen J.B. Hypertension in Obesity and the Impact of Weight Loss. Curr. Cardiol. Rep. 2017. 19(10). 98. doi: 10.1007/s11886-017-0912-4.
- Poirier P., Giles T.D., Bray G.A. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2006. 113. 898-918. doi: 10.1161/CIRCULATIONAHA.106.171016.
- Fantin F., Giani A., Zoico E., Rossi A.P., Mazzali G., Zamboni M. Weight Loss and Hypertension in Obese Subjects. Nutrients. 2019. 11(7). 1667. doi: 10.3390/nu11071667.
- Wofford M.R., Hall J.E. Pathophysiology and treatment of obesity hypertension. Curr. Pharm. Des. 2004. 10(29). 3621-3637. doi: 10.2174/1381612043382855.
- Kravchun N.A., Polozova L.G., Popova S.S., Dorosh Ye.G. Hypercorticoidism and obesity. Mìžnarodnij endokrinologìčnij žurnal. 2014. 2(58). doi: https://doi.org/10.22141/2224-0721.2.58. 2014.76478.
- Tsioufis C. Relation of left ventricular concentric remodeling to levels of C-reactive protein and serum amyloid A in patients with essential hypertension. Amer. J. Cardiol. 2005. 96(2). 252-6. doi: 10.1016/j.amjcard.2005.03.054.
- Watanabe T., Yasunari K., Nakamura M., Maeda K. Carotid artery intima-media thickness and reactive oxygen species formation by monocytes in hypertensive patients. J. Hum. Hypertens. 2006 May. 20(5). 336-340. doi: 10.1038/sj.jhh.1001990.
- Navarro-González J.F., Mora C., Muros M., García J., Donate J., Cazaña V. Relationship between inflammation and microalbuminuria in prehypertension. J. Hum. Hypertens. 2013. 27(2). 119-125. doi: 10.1038/jhh.2011.118.
- Misjura K.V., Kravchun P.P. Clusterine as a marker of systemic inflammation in people with different body weights. Вісник проблем біології і медицини. 2017. 137(1). 174-179. (in Ukrainian)
- Murata C., Ramírez A.B., Ramírez G., Cruz A., Morales J.L., Lugo-Reyes S.O. Discriminant analysis to predict the clinical diagnosis of primary immunodeficiencies: a preliminary report. Rev. Alerg. Mex. 2015. 62(2). 125-133. PMID: 25958376. (in Spanish)
- Germino F.W. The management and treatment of hypertension. Clin. Cornerstone. 2009. 9, Suppl 3. Р. 27-33. doi: 10.1016/s1098-3597(09)60016-8.
- Engeli S., Negrel R., Sharma A.M. Physiology and pathophysiology of the adipose tissue renin-angiotensin system. Hypertension. 2000. 35(6). 1270-1277. doi: 10.1161/01.hyp.35.6.1270.
- Hardy O.T., Czech M.P., Corvera S. What causes the insulin resistance underlying obesity? Curr. Opin. Endocrinol. Diabetes Obes. 2012. 19(2). 81-87. doi: 10.1097/MED.0b013e3283514e13.
- Czech M.P. Insulin action and resistance in obesity and type 2 diabetes. Nat. Med. 2017. 23(7). 804-814. doi: 10.1038/nm.4350.

/124_2.jpg)
/125.jpg)
/126.jpg)
/126_2.jpg)
/127_2.jpg)
/128_4.jpg)
/129.jpg)