Резюме
Мета: визначення патогенетичної ролі окиснювального стресу у розвитку діабетичної міопатії у дітей, хворих на цукровий діабет. Матеріали та методи. Під спостереженням знаходилось 60 дітей, хворих на цукровий діабет 1-го типу (ЦД1), віком від 11 до 17 років. До 1-ї групи ввійшло 20 пацієнтів із тривалістю захворювання до 1 року; до 2-ї групи — 20 пацієнтів з перебігом захворювання від 1 до 5 років; до 3-ї групи було включено 20 пацієнтів з перебігом захворювання 5 років і більше. Групу контролю становили 20 умовно здорових дітей. Усім дітям проводилось вимірювання індексу скелетної мускулатури, ультразвукове дослідження скелетних м’язів і визначення рівня креатинфосфокінази, гомоцистеїну та нітротирозину в сироватці крові. Результати. За даними проведеної ультразвукової діагностики встановлено, що у дітей, хворих на ЦД1, у динаміці захворювання відбувалося зниження маси скелетної мускулатури за рахунок зменшення товщини м’язів. Доведено, що гіперглікемія у дітей, хворих на ЦД1, призводила до значного окиснювального стресу, про що свідчило збільшення вмісту гомоцистеїну та нітротирозину в сироватці крові, та ураження скелетних м’язів, що підтверджувалося високими рівнями креатинфосфокінази в сироватці крові починаючи з 1-го року захворювання. Найсуттєвіші зміни були встановлені в 3-й групі дітей, у яких визначались найвищі значення гомоцистеїну та нітротирозину порівняно як з контрольною, так і 1-ю групою дослідження (р < 0,05). Встановлено зворотний кореляційний зв’язок між рівнями гомоцистеїну, нітротирозину та індексом скелетної мускулатури (відповідно r = –0,39 (p < 0,05); r = –0,35 (p < 0,05)) та залежність даних показників від стану глікемічного контролю. Висновки. У дітей, хворих на цукровий діабет 1-го типу, відмічалось прогресивне підвищення активності креатинфосфокінази з 1-го року захворювання, що свідчить про раннє ураження м’язової тканини. Однією з причин ураження скелетних м’язів і формування діабетичної міопатії у дітей, хворих на цукровий діабет, виступав окиснювальний стрес, що посилювався при незадовільному глікемічному контролі.
Цель: определение патогенетической роли окислительного стресса в развитии диабетической миопатии у детей, больных сахарным диабетом. Материалы и методы. Под наблюдением находилось 60 детей, больных сахарным диабетом 1-го типа (СД1), в возрасте от 11 до 17 лет. В 1-ю группу вошло 20 пациентов с длительностью заболевания до 1 года; во 2-ю группу — 20 пациентов с течением заболевания от 1 до 5 лет; в 3-ю группу было включено 20 пациентов с течением заболевания 5 лет и более. Группу контроля составили 20 условно здоровых детей. Всем детям проводилось измерение индекса скелетной мускулатуры, ультразвуковое исследование скелетных мышц и определение уровня креатинфосфокиназы, гомоцистеина и нитротирозина в сыворотке крови. Результаты. По данным проведенной ультразвуковой диагностики установлено, что у детей, больных СД1, в динамике заболевания происходило снижение массы скелетной мускулатуры за счет уменьшения толщины мышц. Доказано, что гипергликемия у детей, больных СД1, приводила к значительному окислительному стрессу, о чем свидетельствовало увеличение содержания гомоцистеина и нитротирозина в сыворотке крови, и поражению скелетных мышц, которое подтверждалось высокими уровнями креатинфосфокиназы в сыворотке крови начиная с 1-го года заболевания. Существенные изменения были установлены в 3-й группе детей, у которых определялись высокие значения гомоцистеина и нитротирозина по сравнению как с контрольной, так и с 1-й группой исследования (р < 0,05). Установлена обратная корреляционная связь между уровнями гомоцистеина, нитротирозина и индексом скелетной мускулатуры (соответственно r = –0,39 (p < 0,05); r = –0,35 (p < 0,05)) и зависимость данных показателей от состояния гликемического контроля. Выводы. У детей, больных сахарным диабетом 1-го типа, отмечалось прогрессивное повышение активности креатинфосфокиназы с 1-го года заболевания, что свидетельствует о раннем поражения мышечной ткани. Одной из причин поражения скелетных мышц и формирования диабетической миопатии у детей, больных сахарным диабетом, выступает окислительный стресс, который усиливался при неудовлетворительном гликемическом контроле.
Background. The purpose was to determine the pathogenetic role of oxidative stress in the development of diabetic myopathy in children with diabetes mellitus. Materials and methods. The study included 60 children with type 1 diabetes mellitus (DM1), aged 11 to 17 years. Group 1 included 20 patients with a duration of disease less than 1 year. Group 2 consisted of 20 patients with a duration of diabetes from 1 to 5 years. Group 3 was formed of 20 kids with the duration of diabetes over 5 years. The control group consisted of 20 apparently healthy children. All children underwent the skeletal muscle index determination, ultrasound examination of skeletal muscles, and determination of the level of creatine phosphokinase, homocysteine, and nitrotyrosine in the blood serum. Results. According to the conducted ultrasound diagnostics, the DM1 children were found to present a decrease in the mass of skeletal muscles due to a reduced muscle thickness in the dynamics of the disease. It was proved that hyperglycemia in children with DM1 resulted in the significant oxidative stress confirmed by an increase in the blood serum content of homocysteine and nitrotyrosine, and damage to skeletal muscles, which was confirmed by high blood serum levels of creatine phosphokinase, started from 1 year of illness. Significant changes were found in group 3 of children, where high values of homocysteine and nitrotyrosine were determined in comparison with both the control and group 1 of the study (p < 0.05). An inverse correlation was found between the levels of homocysteine, nitrotyrosine, and the skeletal muscle index, respectively (r = –0.39 (p < 0.05); r = –0.35 (p < 0.05)), and the dependence of these indicators on the state of glycemic control. Conclusions. There is a progressively increased activity of creatine phosphokinase from 1 year of DM1, which indicated early damage to the muscle tissue in children with type 1 diabetes mellitus. One of the causes of skeletal muscle damage and the formation of diabetic myopathy in diabetic children is oxidative stress, which increased with poor glycemic control.
Вступ
Маніфестація цукрового діабету 1-го типу (ЦД1), хоча може відбуватись у будь-якому віці, частіш за все спостерігається у дитячому віці. Незважаючи на схожість процесів, що лежать в основі розвитку захворювання, ЦД1 у дитячому віці має свої епідеміологічні, патофізіологічні особливості та демонструє специфічну відповідь на лікування, що не дозволяє екстраполювати підходи до ведення дорослих пацієнтів з цим діагнозом на дітей [1]. Навіть в країнах з достатнім рівнем забезпеченості інсуліном, контролем глікемії та медичної допомоги експертів у хворих може спостерігатися поганий метаболічний контроль, що призводить до розвитку хронічних мікро- та макросудинних ускладнень і стає причиною тяжкої інвалідності та ранньої смертності [2]. Поряд з мікросудинними хронічними ускладненнями, що зазвичай асоціюються з ЦД1 за рахунок дисфункції малого масиву судин у критичних ділянках (ретинопатія, нефропатія), виникають структурні та функціональні зміни у скелетних м’язах внаслідок пошкодження більшого масиву судин-мішеней. Це впливає на загальну метаболічну функцію організму та може виступати однією з причин несприятливого перебігу захворювання й розвитку інсулінорезистентності [3].
Численні дослідження, в тому числі з морфології змін судинної стінки, а саме базальної мембрани при ЦД1, вказують на її потовщення у судинах мікроциркуляторного русла скелетних м’язів, предиктором чого є ступінь і тривалість гіперглікемії [3]. Згідно з сучасними уявленнями про механізми виникнення цукрового діабету як 1-го, так і 2-го типу та розвиток їх ускладнень, важливу роль відіграє окиснювальний стрес [4]. У науковій літературі зберігається інтерес до вивчення ролі гомоцистеїну та нітротирозину як маркерів окиснювального стресу в патогенезі цукрового діабету [5, 6]. Підвищена активність оксидативних процесів поряд зі зниженням біодоступності оксиду азоту (NO) [7–9] призводить до прогресування патологічних змін в мікросудинному руслі з поступовим розрідженням капілярної сітки в скелетній мускулатурі [3, 10]. Все це може призводити до порушення функції скелетних м’язів і розвитку діабетичної міопатії — стану, що характеризується зниженням загальної фізичної здатності, відчуттям м’язової слабкості та зниженням м’язової маси на фоні перебігу ЦД1 [11]. Тому вивчення ролі окиснювального стресу в розвитку порушень з боку м’язової системи як одного з патогенетичних аспектів, що обумовлює погіршення метаболічного контролю та виникнення хронічних ускладнень ЦД1, дозволить деталізувати ранні діагностичні критерії діабетичної міопатії та розширити наукові уявлення про закономірності їх змін на різних стадіях перебігу ЦД1, що і визначає актуальність вивчення даного питання.
Мета дослідження: визначення патогенетичної ролі окиснювального стресу у розвитку діабетичної міопатії у дітей, хворих на цукровий діабет.
Матеріали та методи
Під спостереженням знаходилось 60 дітей, хворих на цукровий діабет 1-го типу, віком від 11 до 17 років. Залежно від тривалості перебігу ЦД1 пацієнти були розподілені на 3 групи. До 1-ї групи ввійшло 20 дітей з тривалістю цукрового діабету до 1 року; до 2-ї групи — 20 пацієнтів з тривалістю цукрового діабету від 1 року до 5 років; до 3-ї групи було включено 20 дітей з тривалістю захворювання на цукровий діабет понад 5 років. Контрольну групу становили 25 умовно здорових дітей. Усі групи були репрезентативні за віком, статтю та індексом маси тіла (ІМТ) (табл. 1). Критеріями включення пацієнтів у дослідження були: згода пацієнта та його батьків на участь у дослідженні; відсутність кетоацидозу (кетонові тіла визначали в сечі до і після тестування); максимальний рівень глікемії натщесерце в день дослідження не перевищував 10,5 ммоль/л, а мінімальний рівень глікемії — 5,7 ммоль/л.
/40.jpg)
З дослідження були виключені пацієнти за відсутності згоди на участь у дослідженні; діти з ЦД1 з ожирінням або надмірною масою тіла; за наявності гострих запальних процесів або вроджених вад розвитку на стадії декомпенсації.
Відповідно до рекомендацій Протоколу надання медичної допомоги дітям із цукровим діабетом, затвердженого Наказом № 254 МОЗ України від 27.04.2006, із змінами, внесеними згідно з Наказами Міністерства охорони здоров’я № 55 (v0055282-09) від 03.02.2009, № 864 (v0864282-13) від 07.10.2013, у дітей, хворих на цукровий діабет, визначався стан глікемічного контролю. Ідеальний/оптимальний рівень глікемічного контролю мали 11 (18,3 %) дітей, хворих на ЦД1, субоптимальний контроль визначався у 17 (28,3 %) дітей, які знаходились під спостереження, та глікемічний контроль з високим ризиком для життя мав місце у 32 (53,4 %) пацієнтів. Розподіл дітей по групах за станом глікемічного контролю наведено в табл. 2.
Усім дітям проводилось вимірювання довжини та маси тіла з подальшим обчисленням індексу маси тіла. Дітям контрольної та досліджуваних груп проводилось визначення м’язової маси.
У віці до 15 років її визначали за формулою A.M. Peters [12]. Після 15 років для розрахунку м’язової маси використовували формулу Р. Boer, яка враховувала стать дитини [13]. Для кількісної оцінки стану м’язової маси використовували індекс скелетної мускулатури (ІСМ), який розраховували за формулою [14]:
ІСМ = (маса скелетної мускулатури/маса тіла) × 100.
Ультразвукове дослідження скелетних м’язів проводилось на ультразвуковому апараті «SA 8000 Live» лінійним датчиком з частотою 7–13 МГц. Дослідженню підлягали: передня група м’язів стегна та задня група м’язів гомілки та довжелезного м’яза спини. М’язи стегна досліджувалися на рівні межі верхньої і середньої третин по передній поверхні, проводилися вимірювання товщини м’язів у строго поперечному зрізі. М’язи гомілки оцінювалися на рівні середньої третини з вимірюванням їх товщини перпендикулярно поверхні малої гомілкової кістки. М’язи спини оцінювались на рівні нижньої частини грудного відділу хребта. Їх товщину вимірювали при позиції датчика строго паралельно хребту. Також обчислювалась сумарна товщина досліджуваних м’язових груп (СТМ).
Дослідження вмісту в сироватці крові гомоцистеїну проводилося за допомогою імуноферментного аналізу з використанням набору «Homocysteine» (EIA, Велика Британія). Вміст у сироватці крові рівня нітротирозину визначався за допомогою набору «Nitrotyrosine» (ELISA, Нідерланди). Імуноферментний аналіз показників проводився на базі Навчального медико-лабораторного центру ЗДМУ (керівник — д.мед.н., професор Абрамов А.В., свідоцтво про технічну компетентність № 033/18, видане 26 грудня 2018 р., чинне до 25 грудня 2023 р.). Рівень креатинфосфокінази визначався в сироватці крові за допомогою автоматичного біохімічного аналізатора «Mindray BS-200» (Китай) з використанням встановлених стандартних діагностичних і контрольних матеріалів.
Статистична обробка результатів проводилась за допомогою пакета статистичних програм Statistica 13.0 (StatSoft Inc. № JPZ8041382130ARCN10-J). Перевірка нормальності проводилась за тестом асиметрії Шапіро — Уїлка. При нормальному розподілі показників у вибірці дані наведені у вигляді середнього арифметичного та стандартної помилки середнього (M ± m) з використанням t-критерія Стьюдента. При розподілі показників за законом, відмінним від нормального, результати наведені медіаною (Me) та нижнім і верхнім квартилем (Q25; Q75) із використанням U-критерія Манна — Уїтні. Кореляційні зв’язки оцінювали за ранговим коефіцієнтом Спірмена. Різниця досліджуваних критеріїв між групами вважалась статистично вірогідною при p < 0,05.
При плануванні дослідження було отримано дозвіл регіональної комісії з питань біоетики Запорізького державного медичного університету. Усі процедури, проведені в дослідженнях за участю дітей, відповідали етичним стандартам інституційного й національного комітету з досліджень і Гельсінській декларації 1964 року та її пізнішим поправкам або порівнянним етичним стандартам. Інформована згода була отримана від кожного з учасників, включених у дослідження, та їх офіційних опікунів.
Результати
За результатами проведеного дослідження встановлено, що в динаміці перебігу ЦД1 у дітей відбувалось зниження маси скелетної мускулатури (табл. 3).
Про це свідчило вірогідне зниження показника ІСМ у 2-й та 3-й групі порівняно з показником контрольної групи (р < 0,05). Встановлено, що зниження маси скелетної мускулатури відбувалося за рахунок зменшення товщини м’язів, що підтверджувалося даними проведеної ультразвукової діагностики. Найбільш суттєві зміни було встановлено в групі дітей з тривалістю захворювання понад 5 років, у яких СТМ зменшувалась на 12 % відносно показника контрольної групи (р < 0,05).
Поряд зі змінами товщини скелетних м’язів у хворих на цукровий діабет в динаміці захворювання спостерігалися зміни їх архітектоніки. Слід відмітити, що перші зміни архітектури скелетних м’язів у дітей відмічалися вже на першому році захворювання на цукровий діабет і характеризувались підвищенням ехогенності окремих м’язових пучків внаслідок підвищення щільності м’яза та збільшення кількісті перимізійних перетинок. У пацієнтів 2-ї групи разом із підвищенням рівня ехогенності м’язової тканини спостерігалося зменшення гомогенності м’язів та поява неоднорідності їх внутрішньої структури за рахунок змін з боку візуалізації епімізію. Найбільш суттєві структурні зміни в скелетних м’язах спостерігалися у хворих з тривалістю ЦД1 понад 5 років, у яких разом із вищеозначеними змінами порушувалася впорядкованість розташування внутрішньом’язових сполучнотканинних прошарків і втрачалась характерна посмугованіть м’язів як наслідок деструктурованості [15].
Враховуючи, що креатинфосфокіназа вважається одним із поширених маркерів наявності мікроушкоджень м’язів [16], ми дослідили вміст даного ферменту у дітей, хворих на цукровий діабет (табл. 4).
В результаті проведеного дослідження було виявлено вірогідно високий рівень креатинфосфокінази серед дітей з тривалістю перебігу ЦД1 до 1 року, активність якої була в 1,6 раза вище, ніж в контрольній групі (р < 0,05). В подальшому в динаміці захворювання відмічалося помірне зниження активності креатинфосфокінази. Проте її вміст в сироватці крові дітей 3-ї групи був статистично вищим порівняно за аналогічний показник групи контролю. На нашу думку, це може бути пов’язано з формуванням хронічного неспецифічного запалення в м’язовій тканині низької інтенсивності, що підтримує її ураження, яке розвивається в умовах хронічної гіперглікемії, обумовленої ЦД1 [17].
З огляду на те, що наслідком хронічного місцевого м’язового запалення може виступати системне запалення та оксидативний стрес [18], нами було вивчено рівень гомоцистеїну у сироватці крові як одного з маркерів його розвитку. Встановлено, що у дітей, хворих на цукровий діабет, 1-ї та 2-ї групи рівень гомоцистеїну статистично не відрізнявся від показників групи контролю, в той час як при тривалості перебігу ЦД1 понад 5 років вміст гомоцистеїну в сироватці крові вірогідно перевищував рівень даного показника як в контрольній групі, так і в групах дітей з меншою тривалістю ЦД1 (табл. 4). Збільшення вмісту гомоцистеїну в сироватці крові у хворих на ЦД1 супроводжувалося зменшенням м’язового компонента, що підтверджувалося встановленим зворотним кореляційним зв’язком рівня гомоцистеїну з індексом скелетної мускулатури (r = –0,39, p < 0,05) та показником сумарної товщини м’язів (r = –0,45, p < 0,05).
Визначення концентрації нітротирозину в сироватці крові як маркеру пероксинітрит-опосередкованого окиснювального пошкодження тканин показало, що зміни його рівня мали різнонаправлений характер залежно від тривалості перебігу ЦД1. Неочікуваними виявилися результати, які були отримані нами в 1-й та 2-й групі пацієнтів, у яких вміст нітротирозину виявився в 17 та 7,5 раза відповідно нижчим за його показники в контрольній групі (p < 0,01). В той же час у групі пацієнтів з тривалістю перебігу ЦД1 понад 5 років рівень нітротирозину був в 1,4 раза вищим, ніж аналогічний показник контрольної групи (табл. 4). Слід відзначити, що найвищі значення нітротирозину спостерігалися у пацієнтів з високою активністю креатинфосфокінази (r = +0,45, p < 0,05) та гіпергомоцистеїнемією (r = +0,57, p < 0,05), що супроводжувалося зменшенням ІСМ (r = –0,35, p < 0,05) й сумарної товщини м’язів (r = –0,48, p < 0,05) та порушенням архітектоніки скелетних м’язів, що може вказувати на формування діабетичної міопатії.
Беручи до уваги роль гіперглікемії в розвитку низькоінтенсивного хронiчного запалення та окиснювального стресу, а також неоднорідність пацієнтів за рівнем глікемічного контролю у групах спостереження, ми проаналізували рівень креатинфосфокінази, гомоцистеїну та нітротирозину у дітей, хворих на ЦД1, залежно від рівня глікемічного контролю (рис. 1).
/42.jpg)
За результатами проведеного аналізу було встановлено, що у пацієнтів з оптимальним глікемічним контролем рівень креатинфосфокінази в сироватці крові не мав статистичної відмінності від показників контрольної групи і становив 72,07 (49,82; 82,78) U/l проти 60,74 (41,45; 86,14) U/l відповідно (p > 0,05). В той же час при погіршенні глікемічного контролю у хворих на цукровий діабет спостерігалося збільшення активності креатинфосфокінази, рівень якої становив 89,64 (68,29: 98,74) U/l у пацієнтів 2-ї групи та 75,55 (66,29; 99,77) U/l — у пацієнтів 3-ї групи (р < 0,05). Також нами отримано позитивний кореляційний зв’язок між вмістом креатинфосфокінази та рівнем ранкової глюкози в сироватці крові (r = +0,50, p < 0,05).
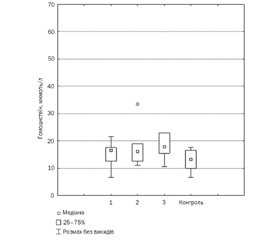
Поряд зі змінами креатинфосфокінази нами було виявлено статистично значуще підвищення показників рівня гомоцистеїну серед дітей, у яких спостерігався глікемічний контроль з високим ризиком для життя — 17,75 (15,50; 23,00) мкмоль/л, проти показника 13,25 (10,00; 16,50) мкмоль/л контрольної групи, p < 0,05 (рис. 2).
У той же час у дітей з ідеальним/оптимальним та субоптимальним рівнем глікемічного контролю вміст гомоцистеїну становив відповідно 16,5 (12,50; 17,50) мкмоль/л та 16,0 (12,5; 19,00) мкмоль/л і статистично не відрізнявся від його рівня в контрольній групі (p > 0,05).
Аналіз вмісту нітротирозину виявив його вірогідне зниження майже в 20 разів серед дітей, у яких спостерігався оптимальний рівень глікемічного контролю (1,55 (1,5; 1,7) нмоль/л) порівняно з контрольною групою (29,50 (25,00; 32,00) нмоль/л; p < 0,05). В подальшому при погіршенні стану глікемічного контролю відмічалось підвищення рівня нітротирозину в сироватці крові з 6,00 (1,9; 19,00) нмоль/л у пацієнтів із субоптимальним глікемічним контролем до 26,00 (16,50; 46,50) нмоль/л при глікемічному контролі з високим ризиком для життя (рис. 3).
Обговорення
Таким чином, отримані дані демонструють, що гіперглікемія, яка розвивається у дітей, хворих на ЦД1, призводить до значного окиснювального стресу, про що свідчить збільшення вмісту гомоцистеїну в сироватці крові, та викликає ураження скелетних м’язів, що підтверджується високими рівнями креатинфосфокінази в сироватці крові. Наслідком підвищення гомоцистеїну може бути збільшення концентрації активних форм кисню, які можуть призвести до розвитку запалення як місцевого, так і системного, що призводить до ураження м’язів та зниження їх регенераторної здібності [19]. Також маркером окиснювального стресу виступає 3-нітротирозин, який є індикатором продукції активних форм азоту [20]. Можна припустити, що низькі рівні нітротирозину в дебюті цукрового діабету пов’язані з посиленим синтезом антиоксидантів, що стримує розвиток нітрозативного стресу за рахунок гальмування окиснення молекул оксиду азоту [21, 22]. Також у низці досліджень було показано, що синтез нітротирозину певний час може пригнічувати гомоцистеїн за рахунок зниження вивільнення оксиду азоту [23]. Отримані нами результати узгоджуються з даними досліджень Г.І. Азізової із співавт. (2014), в якому було встановлено низький рівень оксиду азоту та нітротирозину при компенсації цукрового діабету 2-го типу та підвищення інтенсивності окиснювального стресу при декомпенсації захворювання [24]. В той же час довготривала гіпергомоцистеїнемія на фоні дії постійної гіперглікемії призводить, з одного боку, до порушення балансу між продукцією та детоксикацією активних форм кисню з подальшим виснаження антиоксидантної системи [25], а з іншого — до зниження біодоступності оксиду азоту, накопичення його активних форм, що призводить до гіперпродукції пероксинітриту та нітротирозину [26]. В свою чергу, зниження біодоступності оксиду азоту, який регулює кровотік в м’язах, призводить до пошкодження м’язової тканини за рахунок ішемії, формування хронічного неспецифічного запалення, порушення утилізації глюкози скелетними м’язами та посилення гіперглікемії [19]. Таким чином, формується замкнуте коло.
Висновки
1. У дітей, хворих на цукровий діабет 1-го типу, відмічалось прогресивне підвищення активності креатинфосфокінази з 1-го року захворювання, що свідчить про раннє ураження м’язової тканини.
2. Однією з причин ураження скелетних м’язів у дітей, хворих на цукровий діабет, виступають оксидативний і нітрозативний стреси, які посилювались при незадовільному глікемічному контролі.
3. Підвищення концентрації нітротирозину в сироватці крові дітей, хворих на цукровий діабет, може вказувати на формування діабетичної міопатії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Chiang, Jane L., David M. Maahs, Katharine C. Garvey, Korey K. Hood, Lori M. Laffel, Stuart A. Weinzimer, Joseph I. Wolfsdorf, and Desmond Schatz. Type 1 diabetes in children and adolescents: a position statement by the American Diabetes Association. Diabetes Care. 2018. Vol. 41. № 9. P. 2026-2044. doi: 10.2337/dci18-0023.
2. Patterson C.C., Karuranga S., Salpea P., Saeedi P., Dahlquist G., Soltesz G., Ogle G.D. Temporary removal: IDF Diabetes Atlas: Worldwide Estimates of Incidence, Prevalence and Mortality of Type 1 Diabetes in Children and Adolescents: Results from the International Diabetes Federation Diabetes Atlas. Diabetes Research and Clinical Practice. 2019. Vol. 157. P. 107842. doi: 10.1016/j.diabres.2019.107842.
3. Barrett E.J., Liu Z., Khamaisi M., King G.L., Klein R., Klein et al. Diabetic microvascular disease: an endocrine society scientific statement. The Journal of Clinical Endocrinology & Metabolism. 2017. Vol. 102. № 12. P. 4343-4410. doi: 10.1210/jc.2017-01922.
4. Иванов В.В., Шахристова Е.В., Степовая Е.А., Литвяков Н.В., Перекуча Н.А., Носарева О.Л., Федорова Т.С., Новицкий В.В. Окислительный стресс в патогенезе сахарного диабета 1 типа: роль ксантиноксидазы адипоцитов. Бюллетень сибирской медицины. 2017. Т. 16. № 4. С. 134-143. doi: 10.20538/1682-0363-2017-4-134–143.
5. Martin C., Krogvold L., Farik S. et al. An immunohistochemical study of nitrotyrosine expression in pancreatic islets of cases with increasing duration of type 1 diabetes and without diabetes. Histochem. Cell. Biol. 2017. № 147. P. 605-623. doi: 10.1007/s00418-016-1533-5.
6. Feng Y., Shan M.Q., Bo L., Zhang X.Y., Hu J. Association of homocysteine with type 1 diabetes mellitus: a meta-analysis. Int. J. Clin. Exp. Med. 2015. Vol. 8. № 8. P. 12529-38. PMID: 26550163; PMCID: PMC4612848.
7. Coleman S.K., Rebalka I.A., D’Souza D.M., Hawke T.J. Skeletal muscle as a therapeutic target for delaying type 1 diabetic complications. World journal of diabetes. 2015. Vol. 6. № 17. P. 1323. doi: 10.4239 / wjd.v6.i17.1323.
8. Быков И.М., Ивченко Л.Г., Доменюк Д.А., Костюкова Н.Ю., Сторожук А.П., Илиджев Д.М. Особенности свободнорадикального окисления и антиоксидантной защиты у детей с сахарным диабетом первого типа. Кубанский научный медицинский вестник. 2017. T. 24. № 4. C. 27-38. URL: https://cyberleninka.ru/article/n/osobennosti-svobodnoradikalnogo-okisleniya-i-antioksidantnoy-zaschity-u-detey-s-saharnym-diabetom-pervogo-tipa (дата звернення: 19.11.2020).
9. Супрун Э.В., Терещенко С.В. Роль эндотелиальной дисфункции в формировании осложнений сахарного диабета и перспективы ее коррекции рецепторным антагонистом интерлейкина-1. Вісник наукових досліджень. 2017. № 2. С. 5-12. doi: 10.11603/2415-8798.2017.2.7612.
10. Kusters Y.H., Barrett E.J. Muscle microvasculature’s structural and functional specializations facilitate muscle metabolism. American Journal of Physiology-Endocrinology and Metabolism. 2016. Vol. 310. № 6. P. E379-E387. doi: 10.1152/ajpendo.00443.2015.
11. Krause M.P., Riddell M.C., Hawke T.J. Effects of type 1 diabetes mellitus on skeletal muscle: clinical observations and physiological mechanisms. Pediatric Diabetes. 2010. Vol. 12. № 4(pt. 1). P. 345-364. doi: 10.1111/j.1399-5448.2010.00699.x.
12. Peters A.M., Snelling H.L.R., Glass D.M., Bird N.J. et al. Estimation of Lean Body Mass in Children. Survey of Anesthesiology. 2012. Vol. 56. № 1. P. 26-27. doi: 10.1097/01.SA.0000410700.55371.0f.
13. Boer P. Estimated lean body mass as an index for normalization of body fluid volumes in humans. American Journal of Physiology-Renal Physiology. 1984. Vol. 247. № 4. P. F632-F636. doi: 10.1152/ajprenal.1984.247.4.F632.
14. Janssen I., Heymsfield S.V., Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. Journal of the American Geriatrics Society. 2002. Vol. 50. № 5. P. 889-896. doi: 10.1046/j.1532-5415.2002.50216.x.
15. Pashkova O.E., Chudova N.I., Stoiak H.V. Іrizin as a marker of diabetic myopathy іn children with diabetes type 1. Problems of endocrine pathology. 2020. № 1(71). P. 49-57. doi: 10.21856/J-Pep.2020.1.07.
16. Гунина Л.М., Дмитриев А.В. Формирование алгоритма диагностики синдромов микроповреждения мышц и отсроченной мышечной болезненности у спортсменов. Український журнал медицини, біології та спорту. 2020. Т. 5. № 4(26). С. 414-425. doi: 10.26693/jmbs05.04.414.
17. Perandini L.A., Chimin P., Lutkemeyer D.D.S., Câmara N.O.S. et al. Chronic inflammation in skeletal muscle impairs satellite cells function during regeneration: can physical exercise restore the satellite cell niche. The FEBS Journal. 2018. Vol. 285. № 11. P. 1973-1984. doi: 10.1111/febs.14417.
18. Sun Z., Yan B., Yu W.Y., Yao X., Ma X., Sheng G., Ma Q. Vitexin attenuates acute doxorubicin cardiotoxicity in rats via the suppression of oxidative stress, inflammation and apoptosis and the activation of FOXO3a. Experimental and therapeutic medicine. 2016. Vol. 12. № 3. P. 1879-1884. doi: 10.3892/etm.2016.3518.
19. Veeranki S., Tyagi S.C. Defective homocysteine metabolism: potential implications for skeletal muscle malfunction. Int. J. Mol. Sci. 2013. № 14. P. 15074-15091. doi: 10.3390/ijms140715074.
20. Черников А.А., Северина А.С., Шамхалова М.Ш., Шестакова М.В. Роль механизмов «метаболической памяти» в развитии и прогрессировании сосудистых осложнений сахарного диабета. Сахарный диабет. 2017. T. 20. № 2. P. 126-134. doi: 10.14341/7674.
21. Kurutas E.B. The importance of antioxidants which play the role in cellular response against oxidative/nitrosative stress: current state. Nutrition journal. 2015. Vol. 15. № 1. P. 71. doi: 10.1186/s12937-016-0186-5.
22. Pisoschi A.M., Pop A. The role of antioxidants in the chemistry of oxidative stress: A review. European journal of medicinal chemistry. 2015. № 97. P. 55-74. doi: 10.1016/j.ejmech.2015.04.040.
23. Zhang X., Li H., Jin H., Ebin Z., Brodsky S., Goligorsky M.S. et al. Effects of homocysteine on endothelial nitric oxide production. American Journal of Physiology-Renal Physiology. 2000. Vol. 279. № 4. P. F671-F678.
24. Азизова Г.И., Дадашова А.Р., Амирова М.Ф. Биомаркеры оксидативного стресса и состояние антиоксидантной системы при сахарном диабете типа 2. Universum: медицина и фармакология. 2014. № 6(7). С. 1-9. URL: https://cyberleninka.ru/article/n/biomarkery-oksidativnogo-stressa-i-sostoyanie-antioksidantnoy-sistemy-pri-saharnom-diabete-tipa-2 (дата звернення: 19.11.2020).
25. Sirdah M.M. Protective and therapeutic effectiveness of taurine in diabetes mellitus: A rationale for antioxidant supplementation. Diabetes & Metabolic Syndrome: Clinical Research & Reviews. 2015. Vol. 9. № 1. P. 55-64. doi: 10.1016/j.dsx.2014.05.001.
26. Dong Y., Sun Q., Liu T., Wang H., Jiao K., Xu J., Wang W. et al. Nitrative stress participates in endothelial progenitor cell injury in hyperhomocysteinemia. PloS one. 2016. Vol. 11. № 7. doi: 10.1371/journal.pone.0158672.
/42.jpg)

/40.jpg)
/41.jpg)
/42_2.jpg)
/43.jpg)