Журнал «Здоровье ребенка» Том 16, №1, 2021
Вернуться к номеру
Особливості імунного статусу дітей із різною тяжкістю атопічного дерматиту
Авторы: Недельська С.М., Вакула Д.О.
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
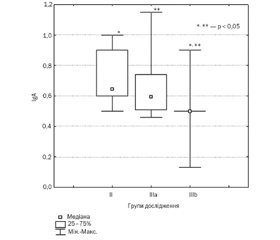
Актуальність. Атопічний дерматит (АД) — найбільш поширене атопічне захворювання серед дітей, що характеризується ураженнями шкіри із вираженим свербежем. Розвиток АД пов’язують із генетичною схильністю, впливом епігенетичних факторів, що призводять до порушення епідермальної бар’єрної функції, імунодизрегуляцією та IgE-опосередкованою сенсибілізацією до найбільш поширених алергенів. Особливе значення дослідники надають не лише поляризації Th2-імунної відповіді, але й особливостям роботи вродженої ланки імунітету. Метою дослідження було вивчити особливості імунного статусу у дітей із урахуванням тяжкості перебігу атопічного дерматиту. Матеріали та методи. Основну групу становили 85 дітей віком від 3 місяців до 3 років із верифікованим діагнозом АД, групу контролю — 20 дітей без проявів атопії в анамнезі. Для оцінки тяжкості шкірних проявів використовували шкалу SCORAD. Діти, які брали участь у дослідженні, були розподілені на групи за тяжкістю АД. Усім дітям проводився загальний клінічний аналіз крові. Вивчення імунного статусу у дітей основної групи включало в себе типування лімфоцитарної популяції за CD-маркерами (C3, C4–2, CD3+, CD19–, CD4+, CD8–, CD4–, CD8+, CD3–, CD56+, CD19+, CD14, CD45), вимірювання рівнів IgA, IgM, IgG, IgE, дослідження системи комплементу (С3, С4–2), фагоцитарної активності нейтрофілів і проліферативної активності лімфоцитів проводилося методом проточної цитометрії у ТОВ «Сінево». Метод імуноферментного аналізу використовувався для виявлення рівнів інтерлейкіну (ІЛ)-13 (ELISA Kit, Thermo Fisher Scientific, Австрія), дослідження проводилося на базі Навчального медико-лабораторного центру Запорізького державного медичного університету. Статистичну обробку результатів проводили за допомогою офіційного програмного пакета Statistica 13.0. Результати. У дітей із тяжким перебігом АД та рівнями ІЛ-13, нижчими від рівнів контрольної групи та груп дітей із тяжким і середньотяжким перебігом, спостерігалася еозинофілія периферійної крові, приріст CD4+, CD8– із одночасним зниженням рівнів CD4–, CD8+, дисімуноглобулінемія та нижчі рівні С3 порівняно із іншими групами дослідження (р < 0,05). Висновки. Отримані результати дають змогу припустити, що у дітей тяжкий перебіг АД був пов’язаний зі змінами системи комплементу та низькими рівнями цитотоксичних клітин, транзиторною гіпогаммаглобулінемією, що, в свою чергу, потребує більш детального вивчення каскадів імунологічних реакцій у дітей з АД.
Актуальность. Атопический дерматит (АД) — наиболее распространенное атопическое заболевание среди детей, характеризующееся поражением кожи с выраженным зудом. Развитие АД связывают с генетической предрасположенностью, влиянием эпигенетических факторов, которые приводят к нарушению эпидермальной барьерной функции, иммунодисрегуляцией и IgE-опосредованной сенсибилизацией к наиболее распространенным аллергенам. Особое значение исследователи придают не только поляризации Th2-иммунного ответа, но и особенностям работы врожденного звена иммунитета. Целью исследования было изучить особенности иммунного статуса у детей с учетом тяжести течения атопического дерматита. Материалы и методы. Основную группу составили 85 детей в возрасте от 3 месяцев до 3 лет с верифицированным диагнозом АД, группу контроля — 20 детей без проявлений атопии в анамнезе. Для оценки тяжести кожных проявлений использовали шкалу SCORAD. Дети, которые принимали участие в исследовании, были разделены на группы по тяжести АД. Всем детям проводился общий клинический анализ крови. Изучение иммунного статуса у детей основной группы включало типирование лимфоцитарной популяции по CD-маркерам (C3, C4–2, CD3+, CD19–, CD4+, CD8–, CD4–, CD8+, CD3–, CD56+, CD19+, CD14, CD45), измерение уровней IgA, IgM, IgG, IgE, исследование системы комплемента (С3, С4–2), фагоцитарной активности нейтрофилов и пролиферативной активности лимфоцитов проводилось методом проточной цитометрии в ООО «Синэво». Метод иммуноферментного анализа использовался для выявления уровней интерлейкина (ИЛ)-13 (ELISA Kit, Thermo Fisher Scientific, Австрия), исследование проводилось на базе Учебного медико-лабораторного центра Запорожского государственного медицинского университета. Статистическую обработку результатов проводили с помощью официального программного пакета Statistica 13.0. Результаты. У детей с тяжелым течением АД и уровнями ИЛ-13 ниже уровней контрольной группы и групп детей с тяжелым и среднетяжелым течением наблюдалась эозинофилия периферической крови, прирост CD4+, CD8– с одновременным снижением уровней CD4–, CD8+, дисиммуноглобулинемия и низкие уровни С3 по сравнению с другими группами исследования (р < 0,05). Выводы. Полученные результаты позволяют предположить, что у детей тяжелое течение АД было связано с изменениями системы комплемента и низкими уровнями цитотоксических клеток, транзиторной гипогаммаглобулинемией, что, в свою очередь, требует более детального изучения каскадов иммунологических реакций у детей с АД.
Background. Atopic dermatitis (AD) is the most common allergic disease among children of young age. Severe forms of AD with skin bacterial and fungal overgrowth may be associated with features of the immune response in different age groups. Plenty of studies demonstrated not only polarization of the Th2 immune response in AD patients, but also the Th1 immune dysregulation. The purpose of this study was to investigate the features of the immune response in children with varying severity of atopic dermatitis. Materials and methods. The study included 85 children aged 3 months to 3 years with a verified diagnosis of AD, living in the Zaporozhzhia region. Twenty healthy children without atopy formed a control group. The patients were divided into groups depending on the severity of AD based on the SCORAD scale. The serum levels C3, C4–2, CD3+, CD19–, CD4+, CD8–, CD4–, CD8+, CD3–, CD56+, CD19+, CD14, CD45, IgA, IgM, IgG, IgE, С3, С4–2, phagocytic activity of neutrophils, and proliferative activity of lymphocytes were measured by flow cytometry (Synevo). ELISA method was used to detect serum levels of IL-13 (ELISA Kit, Thermo Fisher Scientific, Austria). Statistical processing of the results was performed using the official software package Statistica 13.0. Results. The study revealed eosinophilia in 60 % of the children with a mild and moderate course of AD (Me 5.62 [3.64; 7.81]) and in 56 % of the children with a severe course (Me 6.18 [3.13; 9.42]). The children with a severe course of AD and low levels of IL-13, C3 had transient hypogammaglobulinemia and significantly lower levels of the C3 complement, increased levels of CD4+, CD8– with simultaneously decreased levels of CD4–, CD8+ compared with groups of the children with high levels of IL-13 (р < 0.05). Conclusion. The results suggest that severe forms of AD in children of the young age were associated with changes in the complement system and low levels of cytotoxic cells, transient hypogammaglobulinemia. It requires deeper research of the cascades of the immune response in children with AD.
діти; атопічний дерматит; імунітет
дети; атопический дерматит; иммунитет
children; atopic dermatitis; immunity
Вступ
Матеріали та методи
Результати
/50.jpg)
Обговорення
Висновки
- Mariona Pinart, Richard Albang, Dieter Maier et al. Systematic Review on the Definition of Allergic Diseases in Children: The MeDALL Study. Int. Arch. Allergy Immunol. 2015. 168. 110-121. DOI: 10.1159/000442414.
- Luci С., Gaudy-Marqueste С., Rouzaire Р. et al. Peripheral natural killer cells exhibit qualitative and quantitative changes in patients with psoriasis and atopic dermatitis. British Journal of Dermatology. 166(4). 789-796. doi: 10.1111/j.1365-2133.2012.10814.x.
- Kunal Malik, Kerry D. Heitmiller, Tali Czarnowicki. An Update on the Pathophysiology of Atopic Dermatitis. Dermatologic Clinics. 35(3). P. 317-326. DOI: 10.1016/j.det.2017.02.006.
- Eric B. Brandt, Umasundari Sivaprasad. Th2 Cytokines and Atopic Dermatitis. J. Clin. Cell. Immunol. 2011 Aug 10. 2(3). 110. doi: 10.4172/2155-9899.1000110.
- Wollenberg A., Räwer H.-C., Schauber J. Innate Immunity in Atopic Dermatitis. Clinical Reviews in Allergy & Immunology. 2010. 41(3). 272-281. doi: 10.1007/s12016-010-8227-x.
- Fedorciv O.E., Mochulskaya O.M. New approaches to the diagnosis of atopic dermatitis in children. Rossiyskiy vestnik perinatologii i pidiatrii. 2017. 62(3). 99-104.
- Pakholchuk O.P. Otsinka roli disfunktsiyi mukozalnogo bar’eru u formuvanns harchovoyi giperchutlivosti u ditey. Astma ta alergiya. 2018. 1. 1-5.
- Ali Yalcindag, Rui He, Dhafer Laouini et al. The complement component C3 plays a critical role in both TH1 and TH2 responses to antigen. J. Allergy Clin. Immunol. 2006. 117(6). 1455-1461.
- Nedelska D.O., Vakula O.P. Pakholchuk Rol’ umovno-patogennikh gribkovikh shtamiv u perebigu atopichnogo dermatitu u ditej. Vistnik problem biologiyi i mediczini. 2020. 3(157). 287-293. doi: 10.29254/2077-4214-2020-3-157-287-293.
- Nedelska S.M., Vakula D.O., Pakholchuk O.P. Cytokines profile (IL-4, IL-13) of children with severу forms of atopic dermatitis versus other grades of severity. Biological Markers in Fundamental and Clinical Medicine. 2019. 3(2). 29-33. doi: 10.29256/v.03.02.2019.escbm06.
- Stephanie M. Rangel, Amy S. Paller Bacterial colonization, overgrowth, and superinfection in atopic dermatitis. Clin. Dermatol. 2018. 36(5). 641-647. doi: 10.1016/j.clindermatol.2018.05.005.
- Ma W., Bryce P.J., Humbles A.A., Laouini D., Yalcindag A., Alenius H. et al. CCR3 is essential for skin eosinophilia and airway hyperresponsiveness in a murine model of allergic skin inflammation. J. Clin. Invest. 2002. 109. 621-8.
- Carla Mastrorilli, Carlo Caffarelli, Karin Hoffmann-Sommergruber. Food allergy and atopic dermatitis: Prediction, progression, and prevention. Pediatr Allergy Immunol. 2017. 28(8). 831-840. doi: 10.1111/pai.12831.
- Purwar R., Bäumer W., Niebuhr M., Tschernig T., Kietzmann M., Werfel T. A protective role of complement component 3 in T cell-mediated skin inflammation. Experimental Dermatology. 2011. 20(9). 709-714. doi: 10.1111/j.1600-0625.2011.01295.x .
- Jenny Giang, Marc A.J. Seelen, Martijn B.A. van Doorn et al. Complement Activation in Inflammatory Skin Diseases. Front. Immunol. 2018. 9. 639. doi: 10.3389/fimmu.2018.00639.
- Maciej M. Markiewski, John D. Lambris. The role of complement in inflammatory diseases from behind the scenes into the spotlight. Am. J. Pathol. 2007 Sep. 171(3). 715-27. doi: 10.2353/ajpath.2007.070166.
- Chiara Giacomassi, Norzawani Buang, Guang Sheng Ling et al. Complement C3 Exacerbates Imiquimod-Induced Skin Inflammation and Psoriasiform Dermatitis. J. Invest. Dermatol. 2017 Mar. 137(3). 760-763. doi: 10.1016/j.jid.2016.11.011.
- Aghamohammadi A., Cheraghi T., Gharagozlou M. et al. IgA deficiency: correlation between clinical and immunological phenotypes. J. Clin. Immunol. 2009. 29. 130-6.
- Keles S., Artac H., Kara R. et al. Transient hypogammaglobulinemia and unclassified hypogammaglobulinemia: similarities and differences. Pediatr. Allergy Immunol. 2010. 21. 843-51.
- Ozcan C., Metin A., Ercoglu M., Kocabas C.N. Allergic diseases in children with primary immunodeficiencies. Turk. J. Pediatr. 2014. 56. 41-7.

/48.jpg)
/49_2.jpg)
/49.jpg)
/50_2.jpg)