Журнал «Здоровье ребенка» Том 16, №1, 2021
Вернуться к номеру
Інтенсивність мезентеріального кровотоку і ступінь зрілості кишечника в новонароджених групи ризику розвитку некротизуючого ентероколіту
Авторы: Знаменська Т.К.(1), Воробйова О.В.(1), Власов О.О.(2)
(1) — ДУ «Інститут педіатрії, акушерства і гінекології імені акад. О.М. Лук’янової НАМН України», м. Київ, Україна
(2) — КП «Дніпропетровська обласна дитяча клінічна лікарня», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
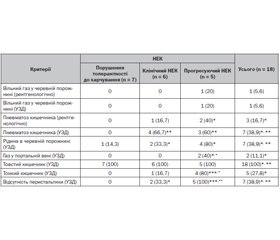
Актуальність. Останніми роками поширюється використання ультразвукового дослідження черевної порожнини для діагностики некротизуючого ентероколіту (НЕК) у новонароджених. На початкових стадіях захворювання товщина стінки кишки, ехогенність і перфузія збільшуються внаслідок запалення кишечника та набряку слизової оболонки. При прогресуванні НЕК потоншення стінки кишечника, відсутність перфузії та перистальтики превалюють і попереджають про можливість перфорації кишечника. Це є доказом діагностичної переваги УЗД щодо оцінки прогресування НЕК. У статті наведено результати власного досвіду використання УЗД черевної порожнини для діагностики НЕК у передчасно народжених дітей. Мета: оцінити ступінь зрілості кишечника і зв’язок між допплерівськими індексами кишкової перфузії та судинним опором у басейні верхньої брижової артерії в недоношених новонароджених на 1-шу — 5-ту добу життя з ризиком розвитку НЕК. Матеріали та методи. У статті проведено обстеження випадково обраних 34 передчасно народжених дітей з малою та дуже малою масою тіла та з терміном гестації 28–36 тижнів від матерів з обтяженим перебігом вагітності. Були оцінені максимальна систолічна швидкість, кінцева діастолічна швидкість і середня швидкість кровотоку при ≥ 5 послідовних циклах серцевих скорочень. На підставі цих показників був розрахований пульсовий індекс. Результати. Після проведеного дослідження на 1-шу — 5-ту добу життя ретроспективно новонароджені були розподілені за групами залежно від клінічних діагнозів наприкінці раннього неонатального періоду. Новонароджені групи ризику, що народилися в асфіксії тяжкого ступеня, з високими показниками судинного опору у верхній брижовій артерії на 1-шу — 5-ту добу життя, а також при товщині стінки кишки менше ніж 1,6 мм мають підвищений ризик розвитку НЕК. Висновки. Виявлені високі показники судинного опору у верхній брижовій артерії на 1-шу — 5-ту добу життя в передчасно народжених дітей із дуже малою масою тіла та високим ризиком розвитку НЕК допоможуть приймати правильні клінічні рішення щодо тактики ведення й лікування, зокрема про початок ентерального харчування і розширення його обсягу.
Актуальность. В последние годы распространяется использование ультразвукового исследования брюшной полости для диагностики некротизирующего энтероколита (НЭК) у новорожденных. На начальных стадиях заболевания толщина стенки кишки, эхогенность и перфузия увеличиваются вследствие воспаления кишечника и отека слизистой оболочки. При прогрессировании НЭК утончение стенки кишечника, отсутствие перфузии и перистальтики превалируют и предупреждают о возможности перфорации кишечника. Это является доказательством диагностического преимущества УЗИ в отношении оценки прогрессирования НЭК. В статье представлены некоторые результаты собственного опыта использования УЗИ брюшной полости для диагностики НЭК у преждевременно рожденных детей. Цель: оценить степень зрелости кишечника и связь между допплеровскими индексами кишечной перфузии и сосудистым сопротивлением в бассейне верхней брыжеечной артерии у недоношенных новорожденных на 1–5-е сутки жизни с риском развития НЭК. Материалы и методы. В статье проведено обследование случайно выбранных 34 недоношенных детей с малой и очень малой массой тела и со сроком гестации 28–36 недель от матерей с отягощенным течением беременности. Оценивались: максимальная систолическая скорость, конечная диастолическая скорость и средняя скорость кровотока при ≥ 5 последовательных циклах сердечных сокращений. На основании этих показателей был рассчитан пульсовой индекс. Результаты. После проведенного исследования на 1–5-е сутки жизни ретроспективно новорожденные были распределены по группам в зависимости от клинических диагнозов в конце раннего неонатального периода. Новорожденные группы риска, родившиеся в асфиксии тяжелой степени, с высокими показателями сосудистого сопротивления в верхней брыжеечной артерии на 1–5-е сутки жизни, а также при толщине стенки кишки менее 1,6 мм имеют повышенный риск развития НЭК. Выводы. Выявленные высокие показатели сосудистого сопротивления в верхней брыжеечной артерии на 1–5-е сутки жизни у недоношенных детей с очень низкой массой тела и высоким риском развития НЭК помогут принимать правильные клинические решения по тактике ведения и лечения, в том числе о начале энтерального питания и расширении его объема.
Background. In recent years, the use of abdominal ultrasound for the diagnosis of necrotizing enterocolitis (NEC) in newborns has spread. At the initial stages of the disease, intestinal wall thickness, echogenicity and perfusion increase due to intestinal inflammation and mucosal edema. With the progression of NEC, thinning of the intestinal wall, lack of perfusion and peristalsis prevail and warn of the risk of intestinal perforation. This is the evidence of the diagnostic advantage of ultrasound in assessing the progression of NEC. The article presents some results of our own experience of using abdominal ultrasound to diagnose NEC in premature babies. The purpose was to assess the degree of intestinal maturity and the relationship between Doppler indices of intestinal perfusion and vascular resistance in the superior mesenteric arterial bed in premature newborns on day 1–5 of life who are at risk of developing NEC. Materials and methods. The authors examined 34 randomly selected premature babies with low and very low body weight and gestational age from 28 to 36 weeks who were born to mothers with complications of pregnancy. Maximum systolic velocity, end-diastolic velocity, and mean blood flow velocity were assessed at ≥ 5 consecutive heartbeats. Based on these indicators, the pulse index was calculated. Results. After the study on days 1–5 of life the newborns were divided retrospectively into groups depending on clinical diagnoses at the end of the early neonatal period. Babies born with severe asphyxia, with high vascular resistance in the superior mesenteric artery on day 1–5 of life, as well as with a bowel wall thickness of less than 1.6 mm, have an increased risk of developing NEC. Conclusions. The revealed high vascular resistance in the superior mesenteric artery on day 1–5 of life in premature infants with very low body weight and with a high risk of developing NEC will help make correct clinical decisions on management and treatment, including the initiation of enteral nutrition and expanding its volume.
передчасно народжені діти; некротизуючий ентероколіт; ультразвукове дослідження; рання діагностика
преждевременно рожденные дети; некротизирующий энтероколит; ультразвуковое исследование; ранняя диагностика
рremature newborns; necrotizing enterocolitis; ultrasound examination; early diagnosis
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Cuna A.C., Reddy N., Robinson A.L., Chan S.S. Bowel ultrasound for predicting surgical management of necrotizing enterocolitis: a systematic review and meta-analysis. Pediatr. Radiol. 2018. Vol. 48(5). P. 658-666. doi: 10.1007/s00247-017-4056-x.
- Janssen Lok. M., Miyake H., Hock A., Daneman A., Pierro A., Offringa M. Value of abdominal ultrasound in management of necrotizing enterocolitis: a systematic review and meta-analysis. Pediatr. Surg. Int. 2018 Jun. Vol. 34(6). P. 589-612. doi: 10.1007/s00383-018-4259-8.
- Bohnhorst B. Usefulness of abdominal ultrasound in diagnosing necrotising enterocolitis. Arch. Dis. Child. Fetal. Neonatal. Ed. 2013. Vol. 98(5). F445-50. doi: 10.1136/archdischild-2012-302848.
- Dilli D., Suna Oğuz S., Erol R., Ozkan-Ulu H., Dumanlı H., Dilmen U. Does abdominal sonography provide additional information over abdominal plain radiography for diagnosis of necrotizing enterocolitis in neonates? Pediatr. Surg. Int. 2011. Vol. 27(3). P. 321-327. doi: 10.1007/s00383-010-2737-8.
- Faingold R., Daneman A., Tomlinson G., Babyn P.S. et al. Necrotizing enterocolitis: assessment of bowel viability with color doppler US. Radiology. 2005. Vol. 235(2). P. 587-594. doi: 10.1148/radiol.2352031718.
- Македонський І.О., Знаменська Т.К., Мавропуло Т.К. та ін. Некротизуючий ентероколіт у новонароджених. Житомир: Вид. О.О. Євенок, 2019. 207 с.
- Epelman M., Daneman A., Navarro O.M., Morag I. et al. Necrotizing enterocolitis: review of state-of-the-art imaging findings with pathologic correlation. Radiographics. 2007. Vol. 27(2). P. 285-305. doi: 10.1148/rg.272055098.

/55.jpg)
/56.jpg)