Резюме
Актуальність. За останні двадцять років відбулися значні зміни в лікуванні переломів плечової кістки (ППК). В остеосинтезі з’явилось багато високотехнологічних засобів. Численні майстер-класи, короткотривалі курси недостатньо висвітлюють проблемні питання остеосинтезу цими фіксаторами. Результати лікування ППК досить часто, на жаль, залишають бажати кращого. Мета роботи — аналіз біомеханічних аспектів сучасних фіксаторів для остеосинтезу ППК, причин ускладнень і незадовільних результатів їх застосування. Матеріали та методи. Аналіз доступних літературних даних, рентгенограм цікавих випадків, історій хвороби пацієнтів із ускладненнями і негативними результатами остеосинтезу ППК інтрамедулярними блокуючими стрижнями, LCP-пластинами. Результати. Результат лікування ППК значною мірою залежить від розуміння процесу репаративної регенерації. Намітилась тенденція до механістичного підходу в лікуванні переломів кісток та їх наслідків. При переломах хірургічної шийки ПК застосовують фігурні LCP-пластини. Вони передбачають уведення в головку кістки мінімум 4 блокуючих гвинтів. Часто це закінчується розвитком асептичного некрозу. Відсутність анатомічної репозиції відламків, а також проведення в головку ПК 5–7 гвинтів призводить до деформуючого артрозу плечового суглоба. Подібні ускладнення ми спостерігали у 10 пацієнтів. Уведення значної кількості гвинтів у головку кістки може ускладнитись зламом фіксатора на межі перепаду напруження пластини. У складних випадках ППК і при ускладненнях остеосинтезу іншими фіксаторами у 170 пацієнтів ми застосовували розроблений нами пристрій для фіксації кісткових відламків. Він захищений патентом України № 17502, усуває шкідливий тиск пластини на кістку, здійснює стабільний остеосинтез при максимально можливій короткій пластині. Блокування гвинтів у пластині при недостатньо репонованих фрагментах закінчується розвитком псевдоартрозу. Частим ускладненням застосування LCP-пластин є ефект зварювання між головкою гвинта і пластиною. На фоні остеопорозу кістки LCP-пластина фактично виконує роль протеза, що посилює явища остеопорозу. При пізньому видаленні LCP-пластини в таких випадках можлива рефрактура ПК. Висновки. Таким чином, остеосинтез LCP-пластинами переломів ПК має значні переваги перед традиційними контактними пластинами. Ускладнення і негативні результати остеосинтезу можуть виникнути при застосуванні їх не за показаннями, порушенні методики, техніки оперативного втручання та правильності ведення післяопераційного періоду.
Актуальность. За последние двадцать лет произо-шли значимые изменения в лечении переломов плечевой кости (ППК). В остеосинтезе появилось много высокотехнологических средств. Многочисленные мастер-классы, краткосрочные курсы недостаточно освещают проблемные вопросы остеосинтеза этими фиксаторами. Результаты лечения ППК довольно часто, к сожалению, оставляют желать лучшего. Цель работы — анализ биомеханических аспектов современных фиксаторов для остеосинтеза ППК, причин осложнений и неудовлетворительных результатов их применения. Материалы и методы. Анализ доступных литературных данных, рентгенограмм интересных случаев, историй болезни пациентов с осложнениями и негативными результатами остеосинтеза ППК интрамедуллярными блокирующими стержнями, LCP-пластинами. Результаты. Результат лечения ППК в значительной степени зависит от понимания процесса репаративной регенерации. Наметилась тенденция механистического подхода в лечении переломов костей и их последствий. При переломах хирургической шейки ПК применяют фигурные LCP-пластины. Они предусматривают введение в головку кости минимум 4 блокированных винтов. Нередко это приводит к развитию асептического некроза. Отсутствие анатомической репозиции отломков, а также проведение в головку ПК 5–7 винтов приводит к деформирующему артрозу плечевого сустава. Подобные осложнения мы наблюдали у 10 пациентов. Введение большого количества винтов в головку кости может осложниться изломом фиксатора на грани перепада напряжения пластины. В сложных случаях ППК и при осложнениях остеосинтеза другими фиксаторами у 170 пациентов мы применяли разработанное нами устройство для фиксации костных отломков. Оно защищено патентом Украины № 17502, устраняет вредное давление пластины на кость, осуществляет стабильный остеосинтез при максимально возможной короткой пластине. Блокировка винтов в пластине при недостаточно репонированных фрагментах заканчивается развитием псевдоартроза. Частым осложнением применения LCP-пластин является эффект сварки между головкой винта и пластиной. На фоне остеопороза кости LCP-пластина фактически выполняет роль протеза, что усиливает явления остеопороза. При позднем удалении LCP-пластины в таких случаях возможна рефрактура ПК. Выводы. Таким образом, остеосинтез LCP-пластинами переломов ПК имеет значительные преимущества перед традиционными контактными пластинами. Осложнения и отрицательные результаты остеосинтеза могут возникнуть при применении их не по показаниям, нарушении методики, техники оперативного вмешательства и правильности ведения послеоперационного периода.
Background. Over the past twenty years, there have been significant changes in the treatment of humerus fractures. Many high-tech tools have appeared in osteosynthesis. Numerous workshops and short-term courses do not sufficiently highlight vulnerabilities of osteosynthesis with fixators. Unfortunately, in many cases, the treatment results of humerus fractures could be better. The purpose of the work was the analysis of biomechanical aspects of modern fixators for humerus fractures osteosynthesis, causes for complications and unsatisfactory results in the application of fixators. Materials and methods. We have analyzed the available literature data, X-rays of interesting cases, patients’ histories with complications, and negative results of humerus fractures osteosynthesis by intramedullary blocking rods and LCP-plates. Results. The outcome of the humerus fracture treatment largely depends on the understanding of the process of reparative regeneration. There is a tendency for a mechanistic approach in the treatment of bone fractures and their consequences. In the case of surgical neck fractures, the curved LCP-plates are used. They require the placement of at least 4 blocking screws into the bone epiphyses. This often leads to the development of aseptic necrosis. The lack of the anatomical reposition of the fragments as well as the placement of 5–7 screws into the humerus head leads to deforming arthrosis of the shoulder joint. We have observed similar complications in 10 patients. The placement of a significant number of screws into the bone head can lead to complications when a fixator breaks at the point of the plate tension change. In complex cases of humerus fractures and complications of osteosynthesis with other fixators in 170 patients, we used a device for fixing bone fragments that has been developed by us. It is protected by the patent of Ukraine N 17502. The device eliminates harmful pressure of a plate on a bone, carries out a stable osteosynthesis using the shortest possible plate. Blocking screws in a plate with insufficiently reposed fragments cause the development of pseudoarthrosis. A common complication of LCP plates is the welding effect between the screw head and the plate. Against the background of osteoporosis of the bone, the LCP plate actually acts as a prosthesis, which exacerbates the effects of osteoporosis. Late LCP plate removal in such cases might cause humerus refraction. Conclusions. Osteosynthesis of humerus fractures using LCP plates has significant advantages over traditional contact plates. Complications and negative results of osteosynthesis may occur when they are used inappropriately and when the correct methods and techniques of surgical intervention and the appropriate postoperative care are not followed.
Вступ
За останні двадцять років відбулися значні зміни в лікуванні переломів плечової кістки (ППК). В остеосинтезі з’явилось багато високотехнологічних засобів, які вимагають суворого дотримання розроблених методик їх застосування [1, 7, 9]. Численні, часто дорогі майстер-класи, короткотривалі курси загалом недостатньо висвітлюють проблемні питання остеосинтезу сучасними фіксаторами, тонкощі методик і інші аспекти, що впливають на результати лікування. Останні досить часто, на жаль, залишають бажати кращого [2, 3, 5].
Мета роботи — аналіз біомеханічних аспектів сучасних фіксаторів для остеосинтезу ППК, причин ускладнень і незадовільних результатів їх застосування.
Матеріали та методи
Аналіз доступних літературних даних, вивчення рентгенограм цікавих випадків, історій хвороби пацієнтів із ускладненнями і негативними результатами остеосинтезу ППК інтрамедулярними блокуючими стрижнями (ІБС), LCP-пластинами [1, 7]. Вивчалась обґрунтованість використання обраного фіксатора для конкретного перелому, його вплив на зрощення фрагментів. Аналізувалася динаміка розвитку мозолі, її величина залежно від жорсткості фіксації, якості проведеної репозиції фрагментів. Вивчався результат застосування конкретного фіксатора відповідно до характеру лінії ППК, відповідність рекомендованій методиці, техніці оперативного втручання. При зламі LCP-пластин аналізувався вплив щільності розміщення гвинтів на зрощення фрагментів. Фіксувалася тривалість оперативного втручання із встановлення і видалення фіксатора, проблеми, які при цьому виникають. Відмічалися правильність ведення післяопераційного періоду, величина і тривалість дозованого і повного навантаження. Вивчалося чимало інших об’єктивних і суб’єктивних факторів, що впливали на кінцевий результат лікування ППК.
Результати та обговорення
Результат лікування ППК значною мірою залежить від правильного розуміння процесу репаративної регенерації (РР), механізму впливу на неї багатьох факторів. Останнім часом намітилась тенденція до механістичного підходу в лікуванні переломів кісток та їх наслідків [2, 6]. Нерідко лікар, приймаючи рішення на користь певної конструкції, сподівається на її фіксуючі можливості, при цьому маючи слабку уяву про біомеханіку взаємодії «фіксатор — кістка», а також особливості перебігу РР при такому способі фіксації. На наш погляд, багато переломів хірургічної шийки плечової кістки (ХШПК) при незначному зміщенні відламків (рис. 1а, б) в осіб похилого віку можна успішно лікувати консервативними методами. Застосування ІБС при таких переломах ми вважаємо необґрунтованим (рис. 1в).
/17.jpg)
Найчастіше при таких переломах застосовують фігурні LCP-пластини (рис. 2а). Вони передбачають введення в головку ПК мінімум 4 блокуючих гвинтів. Застосування більшої кількості гвинтів (рис. 2б) нерідко призводить до розвитку асептичного некрозу головки ПК (рис. 2в).
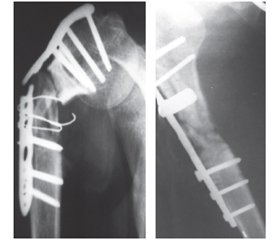
Переломи ХШПК є внутрішньосуглобовими переломами, які вимагають анатомічної репозиції (АР) відламків. Відсутність останньої, а також проведення в головку ПК 5–7 гвинтів призводить до деформуючого артрозу плечового суглоба. Подібні ускладнення ми спостерігали у 10 пацієнтів. Уведення значної кількості гвинтів у головку кістки (рис. 3а) може ускладнитись зламом фіксатора на межі перепаду напруження пластини (рис. 3б).
/18.jpg)
Фіксатор може зламатись при порушенні методики остеосинтезу і в інших ситуаціях. При скалкових переломах верхньої третини ПК бажано провести репозиційну стабілізацію відламків гвинтами. Проте встановити пластину поверх головок репозиційних гвинтів досить проблематично. Фіксація відламків дротяним серкляжем призводить до порушення їх кровопостачання, РР, що може закінчитись зламом LCP-пластини (рис. 4а). Для виправлення ситуації проведений остеосинтез розробленим нами пристроєм для фіксації кісткових відламків (ПФКВ), захищений патентом України № 17502 [4]. На сьогодні він застосований у 170 пацієнтів із різноманітними ППК і їх ускладненнями. На рис. 4б наведена рентгенограма пацієнта після повторного оперативного втручання. ПФКВ завдяки своїм конструктивним особливостям усуває шкідливий тиск пластини на кістку. Це, а також проведення гвинтів у різних площинах, наявність елемента взаємодії пластини з гвинтом забезпечують надійну фіксацію фрагментів ПК. Пристрій здійснює стабільний остеосинтез при максимально можливій короткій пластині.
Застосування LCP-пластини при поперечних і косих ПК вимагає особливо доброго контакту відламків. Блокування гвинтів у пластині при недостатньо репонованих фрагментах закінчується розвитком псевдоартрозу. Нехтувати золотим правилом «спочатку репонуй, а потім блокуй» не можна [8]. Ми спостерігали пацієнтку, у якої був проведений остеосинтез LCP-пластиною, проміжний скалок був фіксований до дистального фрагмента 2 тоншими кортикальними гвинтами. Незважаючи на наявність доброго контакту проміжного скалка із проксимальним фрагментом, без компресії репозиційним гвинтом на цьому рівні зрощення не відбулося. Через рік на контрольній рентгенограмі це проявлялось наявністю щілини (рис. 5а). Під час повторного оперативного втручання зачищені кінці фрагментів з’єднані репозиційним гвинтом, проведений остеосинтез ПФКВ (рис. 5б).
/18_2.jpg)
Результат остеосинтезу LCP-пластинами залежить від передопераційного планування, правильного формування конструкції фіксатора. Остання має бути найоптимальнішою для конкретного перелому. Так, при скалковому переломі ПК АР не обов’язкова при великій робочій довжині пластини (РДП) — ділянки пластини не заповнені гвинтами. Це забезпечує певну мікрорухомість відламків (МРВ), що сприяє процесу їх зрощення. Практика показує, що блокування невідрепонованих фрагментів гвинтами забезпечує жорстку фіксацію, сповільнює РР, часто закінчується розвитком псевдоартрозу. Ми спостерігали таке ускладнення у 6 випадках. На важливості анатомічної репозиції відламків перед блокуванням їх гвинтами LCP-пластини вказує наступне клінічне спостереження. Хворій С. із скалковим ПК (рис. 6а) проведений остеосинтез довгою LCP-пластиною, під час якого не відрепоновані фрагменти у верхній третині ПК заблоковані гвинтами, які проведені дуже близько до їх кінців, РДП при цьому практично відсутня. Навіть через 4 місяці після такого оперативного втручання зрощення відламків не спостерігалось (рис. 6б). Хворій проведена репозиційна фіксація відламків гвинтами діаметром 3,5 мм. Кінцева стабілізація перелому здійснена нашим ПФКВ, конструкція якого дозволяє встановлювати пластину пристрою поверх головок репозиційних гвинтів. Пластина ПФКВ лежить на півкільцях, на відстані 2 мм від ПК, забезпечує стабільну фіксацію і є значно коротшою порівняно із LCP-пластиною (рис. 6в).
При остеосинтезі LCP-пластинами застосовуються гвинти із метричною різьбою, яка має погану взаємодію із кісткою. Більшість гвинтів товщиною 5 мм посилюють травматизацію фрагментів, призводять до повторних переломів. Так, у пацієнтки К. ми спостерігали повторний злам ПК на рівні дистального гвинта (рис. 7а). При короткому дистальному фрагменті це створює певні технічні труднощі для повторного оперативного втручання. Конструкція ПФКВ і в таких випадках забезпечує стабільний остеосинтез, вона встановлена на фрагменти ПК спереду після фіксації їх репозиційним гвинтом (рис. 7б). У 3 пацієнтів рефрактура виникла на рівні проксимального гвинта. Ще у 4 випадках повторний перелом ПК виник на рівні отвору від гвинта після видалення фіксатора.
/19.jpg)
Застосування LCP-пластин забезпечує добрі результати при розумінні тих процесів, які відбуваються на стику відламків після остеосинтезу, правильному розумінні біомеханіки взаємодії «фіксатор — кістка». Загалом результат лікування LCP-пластинами залежить від знання багатьох деталей [7, 9]. Тому не можна сподіватися тільки на механічні можливості фіксатора, хоча його біомеханічна досконалість заслуговує на увагу. Важливою умовою забезпечення доброго результату є АР фрагментів. Тільки після її досягнення необхідно блокувати гвинти у пластині. Багато лікарів забувають про цей важливий момент у силу об’єктивних і суб’єктивних факторів. Тому часто остеосинтез, який вони проводять, є недосконалим (рис. 8а). Подібний недосконалий остеосинтез здійснений молодій пацієнтці М. під час подорожі Європою (рис. 8б). Після повернення в Україну проведений остеосинтез ПФКВ із спонгіозною автопластикою (рис. 8в). За відсутності АР скалкового перелому зрощення фрагментів можливе тільки при значній РДП. Вона забезпечує певну МРВ, вторинне їх зрощення через розвиток періостальної мозолі (ПМ). У 2 пацієнтів при значній РДП при переломі ПК велика ПМ призвела до парезу променевого нерва.
Використання LCP-пластини та значної кількості гвинтів при скалкових переломах у 2 пацієнтів закінчилося розвитком остеомієліту. Застосування великої кількості гвинтів збільшує загальну жорсткість фіксації. З іншого боку, кожен канал від гвинта є зоною перепаду напруження після видалення фіксатора. Отвір у кістці для гвинта додатково порушує її кровопостачання. Найбільш оптимальне розміщення гвинтів у пластині залежно від характеру перелому ще потребує свого дослідження.
Частим ускладненням застосування LCP-пластин є ефект зварювання між головкою гвинта і пластиною. Таке ускладнення було у 7 випадках. Ефект зварювання головки гвинта із пластиною створює багато проблем при видаленні фіксатора, а недокручування гвинта викликає дестабілізацію сегмента.
LCP-пластина при використанні значної кількості блокуючих гвинтів забезпечує жорстку фіксацію. На фоні остеопорозу кістки фіксатор фактично виконує роль протезу, що посилює явища остеопорозу. Після пізнього видалення LCP-пластини в таких випадках можлива рефрактура ПК. Таке ускладнення ми спостерігали у хворої О. Видалення LCP-пластини у неї проведено через 1,5 року після остеосинтезу. На рис. 9а наведена рентгенограма ПК перед видаленням фіксатора. Через 14 днів після незначного навантаження виникла рефрактура ПК. Під час видалення LCP-пластини виявлено ефект зварювання трьох дистальних гвинтів із пластиною, головки їх засвердлені. Гвинти залишені у кістці (рис. 9б). Проведений остеосинтез ПФКВ із спонгіозною кістковою пластикою. Стабільну фіксацію забезпечила набагато коротша пластина нашого ПФКВ порівняно із LCP-пластиною. Через 5 місяців на рентгенограмі відмічалось зрощення фрагментів (рис. 9в). Наведене клінічне спостереження висвітлило дві можливі проблеми, які можуть виникнути при остеосинтезі LCP-пластиною ПК.
/20.jpg)
Одним із ускладнень застосування цього фіксатора може бути пошкодження променевого нерва проксимальним кінцем пластини, встановлення його через боковий доступ при переломах середньої третини ПК. Це пов’язано зі значною довжиною LCP-пластини. В одного пацієнта променевий нерв був притиснений цим фіксатором. Причиною цього була відсутність ревізії променевого нерва під час оперативного втручання.
Висновки
Таким чином, остеосинтез LCP-пластинами переломів ПК має значні переваги перед традиційними контактними пластинами. Ускладнення і негативні результати остеосинтезу можуть виникнути при застосуванні їх не за показаннями, порушенні методики, техніки оперативного втручання та правильності ведення післяопераційного періоду.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Гуркин Б.Е., Гуркин М.Б., Ковалев В.А. и др. Способы лечения переломов диафиза плечевой кости. Новые технологии в травматологии и ортопедии. Ростов-на-Дону, 2017. C. 104-107. URL: https://elibrary.ru/item.asp?id=29200057.
2. Корж М.О., Яременко Д.О., Горидова Л.Д., Романенко К.К. Помилки та ускладнення в ортопедо-травматологічній практиці. Ортопедия, травматология и протезирование. 2010. № 2. С. 5-10.
3. Литвишко В.О. Закономірності утворення кісткового регенерату після діафізарного перелому за умов функціонального лікування з використанням пружно-стійкого з’єднання відламків: Дис. … д-ра мед. наук. Харків, 2018. 300 с.
4. Патент № 17502 UA. МПК6 А 61 В 17/58, А 61 В 17/62. Пристрій для фіксації кісткових відламків. П.І. Білінський (UA); патентовласник П.І. Білінський (UA); № 96051961; заявл. 20.05.96; опубл. 31.10.97; Бюл. № 5. 4 с.
5. Попсуйшапка А.К., Ужигова О.Е., Литвишко В.А. Частота несращений отломков при изолированных диафизарных переломах длинных костей конечностей. Ортопедия, травматология и протезирование. 2013. № 1. С. 39-43.
6. Романенко К.К. Діафізарні переломи довгих кісток, що не зрослися (чинники ризику, діагностика, лікування): Автореф. дис. … канд. мед. наук: спец. 14.01.21 «Травматологія та ортопедія». Харків, 2002. 18 с.
7. Anglen J., Kyle R.F. et al. Блокируемые пластины для переломов конечностей. Остеосинтез. 2011. № 1(14). С. 13-14; JAAOS. 2009. Vol. 17. № 7. P. 647-657.
8. Zimmermann G., Henle P., Kusswetter M. и др. Трансформирующий фактор роста (ТФР)-β1 как маркер замедленного сращения переломов. Ортопедия, травматология и протезирование. 2009. № 1. С. 57-65.
9. Ruedi Th.R., Buckley R.E., Moran Ch.G. AO Principles of fracture management. Stuttgart, New York: Thieme, 2007. 947 р.

/17.jpg)
/18.jpg)
/18_2.jpg)
/19.jpg)
/19_2.jpg)
/20.jpg)