Международный эндокринологический журнал Том 17, №1, 2021
Вернуться к номеру
Особенности гормонального тестирования тиреоидной функции у пациентов с сахарным диабетом 1-го типа и хронической болезнью почек
Авторы: Сазонова Е.Г.(1, 2), Мохорт Т.В.(2), Карлович Н.В.(1, 2)
(1) — ГУ «Республиканский центр медицинской реабилитации и бальнеолечения», г. Минск, Республика Беларусь
(2) — УО «Белорусский государственный медицинский университет», г. Минск, Республика Беларусь
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
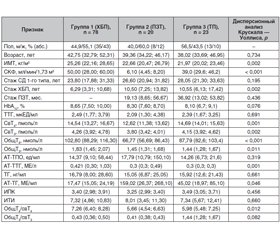
Актуальність. Перебіг хронічної хвороби нирок (ХХН) може впливати на метаболізм тиреоїдних гормонів. Встановлено, що зниження ниркової функції може поєднуватися зі змінами функції щитоподібної залози (ЩЗ). Тиреоїдна дисфункція також має наслідки для ренального потоку крові, швидкості клубочкової фільтрації (ШКФ), канальцевого транспорту, електролітного гомеостазу та структури клубочків. Мета дослідження — визначити особливості функції ЩЗ у пацієнтів із цукровим діабетом (ЦД) 1-го типу та ХХН, на підставі чого розробити рекомендації щодо термінів гормонального тестування тиреоїдної патології. Матеріали та методи. З метою визначення оптимальних термінів гормонального тестування була проведена оцінка тиреоїдної функції у 121 пацієнта з ЦД 1-го типу та ХХН. Пацієнти з ЦД 1-го типу та ХХН були розділені на 3 групи: перша — 78 осіб із ШКФ ≤ 60 мл/хв/1,73 м2, група 2 — 20 осіб, які отримують нирково-замісну терапію (НЗТ), група 3 — 23 особи після трансплантації нирки (ТН) з адекватною функцією трансплантату (тривалість роботи ниркового трансплантату — 3,62 (1,47–4,28) року). Результати. У пацієнтів із ЦД 1-го типу та ХХН знижена діагностична цінність рівня тиреотропного гормону (ТТГ) у зв’язку з відсутністю відмінностей його значень при зниженні вільного тироксину (вТ4) і вільного трийодтироніну (вТ3). Найбільш чутливим маркером тиреоїдної дисфункції є вТ3. Генез тиреоїдних порушень у пацієнтів з ЦД 1-го типу та ХХН має неімунну природу. У пацієнтів із ЦД 1-го типу, які отримують НЗТ, після процедури гемодіалізу відбувається збільшення периферичних загальних вТ4 і вТ3, що обумовлює необхідність моніторингу функціональних порушень ЩЗ безпосередньо після проведення сеансу гемодіалізу. Після ТН відбувається відновлення нормальних значень індексу периферичної конверсії (ІПК) і вТ3 протягом 1–2 років залежно від тривалості отримання НЗТ. У пацієнтів із ЦД 1-го типу з тривалістю роботи ренотрансплантату більше трьох років відбувається збільшення ІПК, що характеризує дисбаланс периферичних тиреоїдних гормонів у бік зниження вТ3 при відносно стабільному вТ4. Висновки. Тиреоїдні дисфункції характерні для всіх стадій патологічного процесу при ХХН у пацієнтів із ЦД 1-го типу, включаючи пацієнтів на термінальній стадії і після успішної трансплантації нирки. Зміни тиреоїдних гормонів асоційовані з тривалістю НЗТ, тривалістю роботи ренотрансплантату, а також можуть потенційно впливати на виживання пацієнтів після ТН.
Актуальность. Течение хронической болезни почек (ХБП) может оказывать влияние на метаболизм тиреоидных гормонов. Установлено, что снижение почечной функции может сочетаться с изменениями функции щитовидной железы (ЩЖ). Тиреоидная дисфункция также несет последствия для ренального потока крови, скорости клубочковой фильтрации (СКФ), канальцевого транспорта, электролитного гомеостаза и структуры клубочков. Цель исследования — определить особенности функции ЩЖ у пациентов с сахарным диабетом (СД) 1-го типа и ХБП, на основании чего разработать рекомендации по срокам гормонального тестирования тиреоидной патологии. Материалы и методы. С целью определения оптимальных сроков гормонального тестирования была проведена оценка тиреоидной функции у 121 пациента с СД 1-го типа и ХБП. Пациенты с СД 1-го типа и ХБП были разделены на 3 группы: первая — 78 человек с СКФ ≤ 60 мл/мин/1,73 м2, вторая — 20 человек, получающих почечно-заместительную терапию (ПЗТ), третья — 23 человека после трансплантации почки с адекватной функцией трансплантата (длительность работы почечного трансплантата — 3,62 (1,47–4,28) года). Результаты. У пациентов с СД 1-го типа и ХБП снижена диагностическая ценность уровня тиреотропного гормона в связи с отсутствием различий его значений при снижении свободного тироксина (свТ4) и свободного трийодтиронина (свТ3). Наиболее чувствительным маркером тиреоидной дисфункции является свТ3. Генез тиреоидных нарушений у пациентов с СД 1-го типа и ХБП имеет неиммунную природу. У пациентов с СД 1-го типа, получающих ПЗТ, после процедуры гемодиализа происходит увеличение периферических общих и свТ4, и свТ3, что обусловливает необходимость мониторинга функциональных нарушений ЩЖ непосредственно после проведения сеанса гемодиализа. После трансплантации почки происходит восстановление нормальных значений индекса периферической конверсии (ИПК) и свТ3 в течение 1–2 лет в зависимости от длительности получения ПЗТ. У пациентов с СД 1-го типа с длительностью работы ренотрансплантата более трех лет происходит увеличение ИПК, характеризующего дисбаланс периферических тиреоидных гормонов в сторону снижения свТ3 при относительно стабильном свТ4. Выводы. Тиреоидные дисфункции характерны для всех стадий патологического процесса при ХБП у пациентов с СД 1-го типа, включая пациентов на терминальной стадии и после успешной трансплантации почки. Изменения тиреоидных гормонов ассоциированы со стажем ПЗТ, длительностью работы ренотрансплантата, а также могут потенциально оказывать влияние на выживаемость пациентов после трансплантации почки.
Background. Chronic kidney disease (CKD) is known to affect the thyroid axis, including thyroid hormone metabolism. It has been established that a decrease in renal function can be combined with changes in thyroid function. Thyroid dysfunction also has implications for renal blood flow, glomerular filtration rate (GFR), tubular transport, electrolyte homeostasis, and glomerular structure. The purpose of the study was to determine the features of thyroid function in patients with type 1 diabetes mellitus (T1DM) and CKD and develop recommendations for hormonal testing of thyroid pathology. Materials and methods. One hundred and twenty-one patients with T1DM with CKD were divided into 3 groups: group 1 — 78 individuals with GFR ≤ 60 ml/min/1.73 m2, group 2 — 20 people receiving renal replacement therapy (RRT), group 3 — 23 patients after renal transplantation (RT) with adequate graft function (the duration of the renal transplant is 3.62 (1.47; 4.28) years). Results. In T1DM and CKD group, the diagnostic value of thyroid-stimulating hormone is reduced due to the absence of differences in its values with a decrease in T4 and T3. Free T3 is the most sensitive marker of thyroid dysfunction in CKD. Thyroid disorders in T1D and CKD patients have a non-immune genesis. T1DM patients on RRT after hemodialysis (HD) procedure have an increase in total and free T4 and free T3, consequently, monitoring of thyroid disorders should be done immediately after the HD session. The restoration of normal values of peripheral conversion index and free T3 occurs within 1–2 years after TR, depending on the duration of RRT receiving. After more than 3 post-transplantation years, there is an increase in peripheral conversion index, which characterizes the imbalance of peripheral thyroid hormones towards a decrease in free T3 with relatively stable free T4. Conclusions. Thyroid dysfunctions are typical for all stages of the pathological process in CKD in patients with type 1 diabetes mellitus, including patients at the terminal stage and after successful kidney transplantation. The changes in thyroid hormones are associated with the RRT experience and can potentially affect the survival of patients.
тиреоїдні дисфункції; цукровий діабет 1-го типу; хронічна хвороба нирок; гормональні тести
тиреоидные дисфункции; сахарный диабет 1-го типа; хроническая болезнь почек; гормональные тесты
thyroid dysfunction; type 1 diabetes mellitus; chronic kidney disease; hormonal tests
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
- Van Hoek I., Daminet S. Interactions between thyroid and kidney function in pathological conditions of these organ systems: a review. Gen. Comp. Endocrinol. 2009. 160 (3). 205-15. doi: 10.1016/j.ygcen.2008.12.008.
- Mohamedali M., Reddy Maddika S., Vyas A., Iyer V., Cheriyath P. Thyroid disorders and chronic kidney disease. Int. J. Nephrol. 2014. 520281. doi: 10.1155/2014/520281.
- Vargas F., Moreno J.M., Rodríguez-Gómez I., Wangensteen R., Osuna A., Alvarez-Guerra M., García-Estañ J. Vascular and renal function in experimental thyroid disorders. Eur. J. Endocrinol. 2006. 154 (2). 197-212. doi: 10.1530/eje.1.02093.
- Bando Y., Ushiogi Y., Okafuji K., Toya D., Tanaka N., Miura S. Non-autoimmune primary hypothyroidism in diabetic and non-diabetic chronic renal dysfunction. Exp. Clin. Endocrinol. Diabetes. 2002. 110 (8). 408-15. doi: 10.1055/s-2002-36427.
- Chen H.S., Wu T.E., Jap T.S., Lu R.A., Wang M.L., Chen R.L., Lin H.D. Subclinical hypothyroidism is a risk factor for nephropathy and cardiovascular diseases in Type 2 diabetic patients. Diabet Med. 2007. 24 (12). 1336-44. DOI: 10.1111/j.1464-5491.2007.02270.x
- Garber J.R., Cobin R.H., Gharib H., Hennessey J.V., Klein I., Mechanick J.I., Pessah-Pollack R. et al.; American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr. Pract. 2012. 18 (6). 988-1028. doi: 10.4158/EP12280.GL.
- National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am. J. Kidney Dis. 2002. 39 (2 Suppl. 1). S1-266. PMID: 11904577.
- Levey A.S., Bosch J.P., Lewis J.B., Greene T., Rogers N., Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann. Intern. Med. 1999. 130 (6). 461-70. doi: 10.7326/0003-4819-130-6-199903160-00002.
- Mullur R., Liu Y.Y., Brent G.A. Thyroid hormone regulation of metabolism. Physiol. Rev. 2014. 94 (2). 355-82. doi: 10.1152/physrev.00030.2013.
- Ali Z., Bhaskar S.B. Basic statistical tools in research and data analysis. Indian J. Anaesth. 2016. 60 (9). 662-669. doi: 10.4103/0019-5049.190623.
- Kim H.Y., Choi J.Y., Kwon H.W., Jung J.H., Han M., Park S.K., Kim S.B. et al. Comparison of Clinical Outcomes Between Preemptive Transplant and Transplant After a Short Period of Dialysis in Living-Donor Kidney Transplantation: A Propensity-Score-Based Analysis. Ann. Transplant. 2019. 24. 75-83. doi: 10.12659/AOT.913126.
- Helanterä I., Salmela K., Kyllönen L., Koskinen P., Grönhagen-Riska C., Finne P. Pretransplant dialysis duration and risk of death after kidney transplantation in the current era. Transplantation. 2014. 98 (4). 458-64. doi: 10.1097/TP.0000000000000085. PMID: 24646770.
- Basu G., Mohapatra A. Interactions between thyroid disorders and kidney disease. Indian J. Endocrinol. Metab. 2012. 16 (2). 204-13. doi: 10.4103/2230-8210.93737.
- Schultheiss U.T., Daya N., Grams M.E., Seufert J., Steffes M., Coresh J., Selvin E., Köttgen A. Thyroid function, reduced kidney function and incident chronic kidney disease in a community-based population: the Atherosclerosis Risk in Communities study. Nephrol. Dial Transplant. 2017. 32 (11). 1874-1881. doi: 10.1093/ndt/gfw301.
- Huang X., Ding L., Peng K., Lin L., Wang T., Zhao Z., Xu Y. et al. Thyroid hormones associate with risk of incident chronic kidney disease and rapid decline in renal function: a prospective investigation. J. Transl. Med. 2016. 14 (1). 336. doi: 10.1186/s12967-016-1081-8.

/43.jpg)
/44.jpg)