Газета «Новости медицины и фармации» №2 (746), 2021
Вернуться к номеру
Особливості цитоморфологічних змін популяції нейтрофілів у розробці диференціально-діагностичних критеріїв атипової пневмонії
Авторы: Ракша-Слюсарева О.А.(1), Трихліб В.І.(2), Слюсарев О.А.(1), Тарасова І.А.(3), Боєва С.С.(1)
(1) — Донецький національний медичний університет МОЗ України, м. Краматорськ, Україна
(2) — Українська військово-медична академія, м. Київ, Україна
(3) — ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Вступ
На даний час гострі респіраторні захворювання (ГРЗ), грип та негоспітальна пневмонія залишаються актуальними серед як цивільного населення, так і військовослужбовців.
Негоспітальна пневмонія є поширеною та серйозною хворобою в багатьох країнах світу. Захворюваність становить 2–12 випадків на 1000 населення на рік. Більшість випадків лікуються амбулаторно, приблизно 20 % вимагає госпіталізації, і з цієї групи хворих приблизно у 10 % розвивається тяжкий стан, який потребує лікування у відділенні інтенсивної терапії, зі смертністю понад 50 %. Найбільша кількість смертей реєструється в перші кілька днів після госпіталізації. Раннє виявлення пацієнтів із тяжкою формою сприяє не лише ранньому початку антибіотикотерапії, але й адекватній підтримуючій допомозі [1].
Еталонним стандартом діагностики негоспітальної пневмонії є поява інфільтрату на рентгенограмі легень за наявності нещодавно набутих респіраторних ознак та симптомів (кашель, посилене виділення мокротиння, задишка, лихоманка та аномальні аускультативні дані). У той же час клінічні прояви не завжди супроводжуються змінами на рентгенограмі органів грудної клітки. Особливо часто в літніх людей атипові симптоми й вони не мають лихоманки.
Ускладнює ситуацію те, що більшість клінічних проявів як окремо, так і в поєднанні мають недостатню точність для діагностики та прогнозування негоспітальної пневмонії. Багато симптомів можуть спостерігатись і при інших захворюваннях (гострому бронхіті, загостренні бронхіальної астми, застійній серцевій недостатності тощо). Численні неінфекційні захворювання також можуть супроводжуватися респіраторними симптомами, появою нових інфільтратів у легенях, системними запальними ознаками, лихоманкою, лейкоцитозом та реакцією біомаркерів запалення, що може призвести до помилкового діагнозу бактеріальної пневмонії.
Також відомо і про відсутність діагностичного значення анамнезу та даних клінічного обстеження. У той же час, незважаючи на відомі обмеження, дані клінічного обстеження щодня використовуються для прийняття рішень у рутинній клінічній практиці [2, 3].
Часто лікарі при обстеженні хворого не мають можливості виконати рентгенографію або КТ органів грудної клітки [2].
Усе це призводить до більш пізнього встановлення діагнозу та призначення антибактеріальної терапії. З урахуванням можливих тяжких наслідків відстроченої антибіотикотерапії лікарі мають невеликий проміжок часу для початку антибіотикотерапії та застосування інших методів лікування, що впливає на результати лікування.
Зазвичай при виявленні інфільтрації в легенях припускають бактеріальну етіологію пневмонії. Але зміни в легенях можуть бути й вірусної та неінфекційної етіології, а встановлення етіології є складним завданням.
У хворих із позалікарняною пневмонією традиційними критеріями встановлення діагнозу, окрім клінічних даних, є загальні показники запалення (лейкоцитоз, лихоманка, підвищений рівень С-реактивного білка (СРБ) та бактеріологічний посів крові).
Позитивні бактеріологічні посіви крові у хворих на тяжку негоспітальну пневмонію корелюють із несприятливим результатом, отже, швидкий початок антибактеріальної терапії є ключовим. Але результати бактеріологічних досліджень отримують лише через 24–48 годин, що може бути пізно при лікуванні хворого. У той же час негативний результат бактеріологічного посіву мокротиння в пацієнта з підозрою на негоспітальну пневмонію не виключає можливості тяжкої бактеріальної інфекції.
При діагностиці негоспітальної пневмонії лихоманка, кашель, виділення мокротиння, аномальні аускультаційні дані грудної клітки, задишка мали менше діагностичне значення, ніж показники прокальцитоніну та високочутливого СРБ [3].
За даними іншого дослідження, при обстеженні 1651 хворого із негоспітальною пневмонією в 32,8 % рівень прокальцитоніну був меншим за 0,1 нг/мл (І рівень), у 21,6 % — більшим за 0,1, але меншим від 0,25 нг/мл (ІІ рівень), у 10,2 % — більшим за 0,25, але меншим від 0,5 нг/мл (ІІІ рівень), у 35,4 % — більшим від 0,5 нг/мл (рівень IV). Прокальцитонін мав специфічність на рівні 35 %, чутливість — 92 %. Установлено, що при І рівні прокальцитоніну у хворих був низький показник 30-денної смертності, незалежно від клінічного ризику, включаючи пацієнтів вищих класів ризику. Серед хворих з індексом тяжкості пневмонії високого ризику (класи IV/V) одна чверть пацієнтів мала прокальцитонін на I рівні. При рівні I прокальцитоніну також менше реєстрували несприятливих результатів. Подібні результати спостерігалися при стратифікації CURB-65 [4].
Порогове значення прокальцитоніну 0,25 мкг/л має, за даними низки досліджень, високу чутливість (98 %) для виявлення бактеріємії. Прокальцитонін краще відображає ступінь тяжкості негоспітальної пневмонії порівняно з СРБ (hsCRP), кількістю лейкоцитів, візуальною аналоговою шкалою, які не допомогли відрізнити легку та тяжчу пневмонію [2].
Інші автори відмічають, що СРБ, рівень лейкоцитів не мають специфічності щодо бактеріальної інфекції, тому що високий рівень СРБ може бути обумовлений іншими численними запальними захворюваннями, ішемією, включаючи інфаркт міокарда. При проведенні диференціальної діагностики бактеріальної інфекції та неінфекційних причин запалення в госпіталізованих хворих прокальцитонін був більш чутливим (85 проти 78 %) і більш специфічним (83 проти 60 %) порівняно із СРБ. Також прокальцитонін був більш чутливим у диференціації між бактеріальною та вірусною етіологією захворювання [3]. За іншими даними, прокальцитонін краще, ніж СРБ (hsCRP), підвищує точність діагностики, щоб відрізнити бактеріальну негоспітальну пневмонію від вірусної та неінфекційної етіології [2]. Прокальцитонін може допомогти також і як показник тяжкості захворювання, ризику смерті та необхідності початку антибактеріальної терапії.
Ступінь запальної реакції, обумовлений інфекцією, часто обмежений через відносно низьку вірулентність багатьох збудників, виявлених при пневмонії, асоційованій із ШВЛ, через існуючий синдром системної запальної реакції в кожного інтубованого та тяжкого хворого. Це обмежує точність діагностики за допомогою прокальцитоніну при асоційованій із ШВЛ пневмонії [3]. За відсутності інфекції рівень прокальцитоніну зазвичай зменшується нижче від 1 нг/мл (або 1 мкг/л) протягом 48 годин, вказуючи на важливість повторних вимірювань.
Визначення рівня прокальцитоніну як біомаркера все частіше застосовується в країнах Європи при діагностиці сепсису, септичному шоці, при менш тяжких інфекціях, у тому числі негоспітальній пневмонії [3].
Є свідчення того, що разом із ретельно зібраними даними об’єктивного огляду, рентгенографією біомаркери (РСТ, hsCRP) можуть значно підвищити точність діагностики негоспітальної пневмонії.
Підвищений рівень адреномедуліну, копептину, натрійуретичних пептидів, кортизолу, маркерів згортання та інші комбінації запальних цитокінів суттєво пов’язані зі смертністю при негоспітальній пневмонії.
У той же час жоден біомаркер не повинен використовуватися самостійно, вони є допоміжними засобами при встановленні діагнозу в кожного пацієнта.
Біомаркери можуть бути корисними для виявлення хворих, які потребують антибактеріальної терапії, можуть визначити природу захворювання або його тяжкість, бути показником для прогнозування смерті.
Мета дослідження — визначити ймовірні особливості та відмінності цитоморфологічних змін основної популяції лейкоцитів — нейтрофілів та моноцитів, що пов’язані з неспецифічною резистентністю периферичної крові, у військовослужбовців, які брали участь в АТО/ООС, хворих на атипову пневмонію (АП), для добору та подальшої розробки додаткових критеріїв її ранньої діагностики.
Матеріали та методи
Досліджені та проаналізовані лейкограми крові 149 осіб — мобілізованих та військовослужбовців за контрактом під час АТО/ООС (хворих на гострі респіраторні захворювання — 84 особи, АП — 65 осіб) та 150 умовно здорових осіб віком 19–45 років. Уміст лейкоцитів периферичної крові та відносний уміст елементів лейкограми периферичної крові визначали за допомогою звичайних методів [5, 6]. Отримані результати виражали в абсолютних числах (Г/л) та порівнювали з нормою для умовно здорового населення (УЗН) [7, 8]. Аналізували цитоморфологічні зміни гемограми крові за загальною кількістю клітинних розпадів, умістом гігантських тромбоцитів (ознака процесів підвищення перекисного окиснення ліпідів), а також відсотком цитоморфологічно змінених клітин в окремих пулах лейкоцитів [5, 6, 9–14]. Досліджували зміни цитоморфології такого основного постійного пулу лейкоцитів, як нейтрофіли. При вивченні цитоморфологічних змін нейтрофілів визначали вміст нейтрофілів із фрагментованим (ФЯН), гіпо- (ГпСН) і гіперсегментованим (ГрСН) ядром, кількість клітин із розривами цитоплазматичної мембрани і набуханням ядра (НЯН), із ворсинчастістю хроматину ядра (ВХН), клітин із токсогенною зернистістю цитоплазми (ТЗН), уміст адгезій нейтрофілів (АдН). При аналізі цитоморфологічних змін нейтрофілів ураховували їх кількість на 100 клітин конкретного пулу. Отримані результати виражали у відсотках та порівнювали з нормою для умовно здорового населення [11]. Дослідження препаратів мазків крові проводили за допомогою імерсійного мікроскопа-тринокуляра MICROmed XS-4130 на базі Донецького національного медичного університету МОЗ України (м. Краматорськ). Отримані результати оброблялися методами варіаційної статистики і рангової кореляції з використанням PCL. Були використані програми Statistica Windows і пакет відповідних програм вимірювань.
Результати та обговорення
У більш ранніх дослідженнях нами встановлені особливості розподілу популяцій лейкоцитів у периферичній крові хворих на атипову пневмонію, що є додатковими критеріями при її диференціальній діагностиці з ГРЗ на ранніх стадіях захворювання [8, 15, 16].
Проведені дослідження показали відмінності в цитоморфології основних популяцій лейкоцитів при атиповій пневмонії порівняно з ГРЗ в перші дні захворювання. Загальна кількість клітинних розпадів при АП (41,84 ± 8,40 %) у середньому була меншою, ніж при ГРЗ (56,72 ± 4,50), але не мала вірогідних відмінностей. При цьому цей показник в УЗН (8,5 ± 1,3 %) був значно та вірогідно нижчим за такий у групі АП й ГРЗ (при Р < 0,05).
Раніше нами було встановлено [15, 16], що у хворих на АП частіше реєструвався підвищений уміст нейтрофільних гранулоцитів — 90,0 ± 6,0 %, ці зміни були вірогідними порівняно з показниками у хворих на ГРЗ — 40,00 ± 4,58 % (P < 0,05). У популяції нейтрофільних гранулоцитів реєструвалися значні цитоморфологічні зміни.
Проведені дослідження показали, що такі зміни цитоморфології нейтрофілів, як ТЗН, НЯН, ВХН, ГпСН, тією чи іншою мірою реєструвались у всіх обстежених при АП й ГРЗ, значно й вірогідно перевищуючи частоту виявлення в УЗН. ФЯН виявлялись у 100 % хворих на АП й у 85,7 ± 5,83 % — при ГРЗ. ГрСН та АдН реєструвались не в усіх обстежених з АП й ГРЗ. Як ГрСН, так і АдН частіше реєструвались у хворих на АП, ніж на ГРЗ, відповідно становлячи 81,8 ± 6,4 % і 72,7 ± 1,4 %, 42,8 ± 8,2 % і 57,5 ± 1,5 %. Але відмінності в частоті виявлення цих показників у хворих на АП і ГРЗ були невірогідними (Р > 0,05).
Частота випадків збільшення вмісту моноцитів становила у хворих на АП 85,7 ± 7,0 %, що було значно вищим показником, ніж у хворих на ГРЗ, — 60,0 ± 4,4 %. Але різниця між цими показниками не була вірогідною (P > 0,05). Частота виявлення активованих форм моноцитів також була вищою у хворих на АП — 83,30 ± 6,21 %, порівняно з хворими на ГРЗ — 72,70 ± 4,04 %, але невірогідно (P > 0,05).
Отримані результати свідчили про те, що частота виявлення в периферичній крові хворих нейтрофілів із конкретними цитоморфологічними змінами не є тим критерієм, який може бути використаний у диференціальній діагностиці АП та ГРЗ у перші дні захворювання.
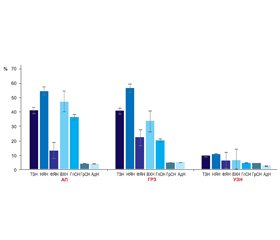
У зв’язку з цим нами була розглянута можливість отримання інформації щодо додаткових критеріїв діагностики АП порівняно з ГРЗ у перші дні хвороби за показниками вмісту нейтрофілів із цитоморфологічними змінами в пулі цих клітин. При цьому визначався відносний уміст окремих цитоморфологічно змінених клітин пулу нейтрофілів. Результати дослідження вмісту (частки) клітин із різними цитоморфологічними змінами в пулі нейтрофілів хворих на АП, ГРЗ та в УЗН наведені на рис. 1.
Уміст клітин із ТЗН при АП становив 40,48 ± 8,53 % і практично не відрізнявся від такого у хворих на ГРЗ — 40,23 ± 4,00 %. При цьому частка клітин із ТЗН була значно й вірогідно вищою при АП й ГРЗ порівняно з показниками УЗН — 9,50 ± 0,91 % (P < 0,05).
Клітин із НЯН у хворих на АП й ГРЗ було відповідно 53,97 ± 4,70 % та 56,50 ± 5,47 %, що переважало більше ніж у 5 разів показники УЗН — 10,30 ± 1,34 % (P < 0,05).
Уміст клітин ВХН у хворих на АП становив 46,9 ± 7,1 % й був значно, але невірогідно вищим за ці показники у хворих на ГРЗ — 33,26 ± 1,62 % (P > 0,05). В УЗН цей показник становив 6,60 ± 0,65 % й був значно та вірогідно меншим за такий у групах осіб з АП й ГРЗ (P < 0,05).
Уміст нейтрофілів із фрагментованим ядром становив при АП у середньому 12,8 ± 4,6 % і був значно нижчим за цей показник при ГРЗ — 22,6 ± 5,6 %, але зареєстровані відмінності не були вірогідними (P > 0,05). У контингенту УЗН уміст клітин із фрагментованим ядром у популяції нейтрофілів був значно та вірогідно нижчим — 6,3 ± 0,9 (P < 0,05). Частка клітин із гіперсегментованим ядром у пулі нейтрофілів у хворих на АП, ГРЗ та УЗН практично не відрізнялась і становила 3,90 ± 1,65 %, 4,43 ± 1,10 % та 4,1 ± 0,8 % відповідно.
Уміст клітин із гіпосегментованим ядром, тобто молодих сегментоядерних нейтрофілів, у пулі нейтрофілів хворих на АП становив 35,9 ± 6,8 % і був значно та вірогідно більшим за такий у хворих на ГРЗ — 19,88 ± 3,87 % та в УЗН — 4,45 ± 0,05 % (P < 0,05).
Уміст адгезованих нейтрофілів, поява яких свідчить про запальний процес, у хворих на АП становив 3,81 ± 1,36 % і був трохи нижчим за такий при ГРЗ — 4,80 ± 0,73 % та перевищував показники УЗН — 2,3 ± 0,3 %. Але відмінності між цими показниками в досліджуваних групах були невірогідними (P > 0,05).
Таким чином, отримані результати щодо частоти виявлення клітин із ТЗ і НЯН свідчили, що при АП реєструється більш виражений токсико-запальний процес і процес перекисного окиснення ліпідів. При цьому відносний уміст гіпосегментованих нейтрофілів у перші дні захворювання вірогідно збільшувався при АП майже втричі порівняно з ГРЗ, становлячи 1/3 пулу, що може бути використане для розробки додаткових критеріїв діагностики АП у перші дні захворювання.
Висновки
Отримані результати свідчать про можливість використання цитоморфологічних змін нейтрофілів периферичної крові як додаткових критеріїв для диференціальної діагностики АП та ГРЗ у перші дні захворювання. Як додаткові діагностичні критерії можуть слугувати лише зміни вмісту окремих клітин в пулах нейтрофілів. Зокрема, для АП на відміну від ГРЗ характерне збільшення відносного вмісту гіпосегментованих нейтрофілів до 1/3 пулу або більше.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/4_m.jpg)