Газета «Новости медицины и фармации» №2 (746), 2021
Вернуться к номеру
Ефективність застосування дієтичної добавки Цитроімунал у профілактичному лікуванні дорослих і дітей з частими захворюваннями лор-органів
Авторы: Хіміч Т.Ю., Савво О.М.
Харківський національний медичний університет, м. Харків, Україна
Харківський національний університет ім. В.Н. Каразіна, м. Харків, Україна
Рубрики: Оториноларингология
Разделы: Клинические исследования
Версия для печати
Вступ
У даний час відмічається значне зростання рецидивуючих запальних захворювань, що вражають осіб найбільш працездатного віку та дітей. Хвороби лор-органів посідають одне з чільних місць у структурі цієї захворюваності [1, 13]. Найчастіше вони є наслідками респіраторно-вірусної інфекції, по суті — її ускладненнями. Останніми роками проблема лікування й запобігання таким ускладненням значно загострилася [10, 14, 15]. Це відбулося здебільшого у зв’язку з ростом резистентності основних збудників інфекцій верхніх дихальних шляхів до антибіотиків, появою антибіотикорезистентних штамів, що продукують бета-лактамази, посиленням ролі умовно-патогенної мікробної флори (ентеробактерії, синьогнійна паличка, внутрішньоклітинні збудники). Активно впроваджувана група цефалоспоринів III–IV покоління, на жаль, має в 6–10 разів нижчу активність щодо стрептококів і стафілококів, а застосування фторхінолонів і тетрациклінів у дитячому віці обмежене можливістю серйозних побічних ефектів [2, 3, 5, 17]. Таке становище призвело до того, що, незважаючи на величезний арсенал лікарських засобів, сучасних хірургічних методів, фізіотерапії, лікування лор-захворювань далеко не завжди таке ефективне, як цього б хотілося. Ця ситуація сприяла появі або поновленню інтересу до імунодіагностики й імунокорекції, особливо при захворюваннях в осіб з факторами ризику, зокрема в тих, хто часто хворіє [4, 6, 8, 11].
Серед пацієнтів, які часто хворіють (ПЧХ), наша увага була звернена на дорослих і дітей з частими захворюваннями лор-органів, що найчастіше зустрічаються в таких осіб. Традиційне лікування в більшості випадків призводило до повторних рецидивів захворювань лор-органів.
При плануванні даної серії досліджень ми виходили з розуміння того, що для успішного профілактичного лікування дітей, які часто хворіють (ДЧХ), із частими захворюваннями лор-органів важливим є вибір препарату для профілактики рецидивів захворювання [13, 14, 16].
У нашій роботі з дітьми й дорослими ми зупинилися на дієтичних добавках Цитроімунал і Цитроімунал Бебі — вони як стимулюють роботу макрофагів, так і мають протизапальну дію.
Метою цього дослідження було вивчення ефективності застосування дієтичних добавок Цитроімунал і Цитроімунал Бебі в лікуванні дорослих і дітей із частими захворюваннями лор-органів.
Матеріали та методи
З метою вивчення лікувальної дії препаратів було проліковано 60 дорослих віком від 25 до 43 років і 60 дітей віком від 9 до 12 років. Сформовано 4 групи пацієнтів, у яких часті захворювання лор-органів супроводжувалися частими рецидивами, а проведена терапія не приводила до зменшення рецидивів захворювання: 1-ша група — 30 дітей, у комплексному лікуванні яких використовувався спрей Цитроімунал Бебі; 2-га група — 30 дітей, у профілактичному лікуванні яких спрей Цитроімунал Бебі використовувався разом з таблетками Цитроімунал Бебі; 3-тя група — 30 дорослих, у комплексному лікуванні яких використовувалися краплі Цитроімунал; 4-та група — 30 дорослих, у профілактичному лікуванні яких використовувалися разом краплі Цитроімунал і капсули Цитроімунал. Дорослі й діти приймали Цитроімунал у капсулах і Цитроімунал Бебі в таблетках протягом 15 днів після закінчення курсу лікування краплями та спреєм Цитроімунал і краплями Цитроімунал Бебі.
Дослідження проводили до лікування, на 10-ту й 30-ту добу і через 6 місяців після початку лікування.
Про стан місцевого імунітету в обстежених пацієнтів судили за вмістом у слині лізоциму, димерного й мономерного IgA, IgG. Відомо, що слина за складом імуноглобулінів схожа на секрет гортані й відображає імунітет слизових покривів [2].
Уміст лізоциму в слині, імуноглобулінів — у сироватці й слині визначали спектрофотометрично [3, 4].
У сироватці крові вміст антитіл до етіологічних збудників лор-захворювань і до загальної антигенної детермінанти (ЗАД) бактерій як показник стану антимікробного імунітету оцінювали за допомогою імуноферментного аналізу. Результати реакції вираховували за показаннями оптичної щільності (ОЩ) суміші бактеріальних антигенів і досліджуваної сироватки на апараті Stat Fax 303 Plus (США). Ставили два контролі: контроль сироватки (лунки не сенсибілізували антигеном) і контроль антитіл (у лунки не вносили сироватку). Як негативний стандарт використовували пул сироватки 10 здорових донорів. Рівень антитіл у сироватці до мікробних антигенів вираховували за формулою: ОЩ450-630 досліджуваної сироватки/ОЩ450-630 стандарту й виражали у відносних одиницях.
Афінність антитіл оцінювали за допомогою відносної величини за методикою R. Luxton, E. Tompson [20], Я.І. Тельнюк та ін. [18].
Фагоцитарну активність лейкоцитів крові оцінювали за здатністю клітин поглинати S.aureus (штам 209) [7]. Визначали фагоцитарний індекс (ФІ) — число клітин, які фагоцитували, і фагоцитарне число (ФЧ) — кількість бактерій, поглинутих однією клітиною. Ефективність внутрішньоклітинного кілінгу (біоцидність лейкоцитів) оцінювали за методом S. Nielsen [21]. Число поглинутих, але живих бактерій визначали після висіву лізату клітин за методом Гольда на чашки Петрі з м’ясопептонним агаром. Лізис лейкоцитів виконували шляхом додавання триразового об’єму води.
Отримані дані піддавали статистичній обробці. З цією метою використовували пакет прикладних програм Statgraphics. Для виявлення значущих відмінностей порівнюваних показників використовували t-критерій Стьюдента. Відмінності вважали вірогідними при рівні значимості p < 0,05. Дані наведені у вигляді середнього арифметичного значення М і середнього квадратичного відхилення m.
Результати та обговорення
У результаті проведених досліджень було встановлено, що серед пацієнтів усіх 4 груп після курсу лікування препаратами Цитроімунал і Цитроімунал Бебі відзначався позитивний ефект в осіб як із хронічним тонзилітом, так і з хронічним риносинуситом. Позитивний терапевтичний ефект був отриманий у всіх пацієнтів, які раніше проходили традиційний курс лікування (отримували антимікробні, протизапальні засоби).
Спостереження за цими хворими впродовж 6 місяців показало, що захворюваність лор-органів знизилася до 1–2 епізодів на рік у 1-й і 3-й групах і до 1–4 епізодів на рік — у 2-й і 4-й групах пацієнтів. Детальний аналіз показав, що у 26,6 % дітей 2-ї групи не спостерігалося жодного епізоду захворювання протягом року, у 56,6 % — 1 епізод захворювання на рік, у 16,8 % — 2 епізоди захворювання на рік. У дітей 1-ї групи спостерігалася така картина: 10,0 % хворіли 1 раз на рік, 30,0 % — 2 рази на рік, 50 % — 3 рази на рік, 10 % — 4 рази на рік. До проведення імунотерапії діти 1-ї і 2-ї груп хворіли 5–6 разів на рік. Аналіз захворюваності серед дорослих пацієнтів показав, що у 18,3 % пацієнтів 4-ї групи не спостерігалося жодного епізоду захворювання протягом року, у 55,7 % — 1 епізод захворювання на рік, у 26 % — 2 епізоди захворювання на рік. У пацієнтів 3-ї групи відзначалася така картина: 14,5 % хворіли 1 раз на рік, 29,1 % — 2 рази на рік, 48 % — 3 рази на рік, 8,4 % — 4 рази на рік. До проведення імунотерапії ці пацієнти хворіли 4–5 разів на рік.
У разі виникнення лор-захворювань у пацієнтів усіх груп хвороба перебігала легше, але у 2-й і 4-й групах була менш тривалою. Лікування лор-патології в пацієнтів усіх аналізованих груп вимагало менш інтенсивного терапевтичного втручання, ніж до проведення імунотерапії. У разі розвитку синуситу в терапії використовувалися антигістамінні препарати, проводилося топічне лікування слизової оболонки носа, фізіотерапія, у разі розвитку тонзиліту проводився комплекс заходів, що включає промивання лакун мигдаликів, змазування мигдаликів антисептичними розчинами, фізіотерапевтичні процедури.
Захворюваність дітей 2-ї групи на гострі респіраторні інфекції (ГРІ) знизилася до 1–2 епізодів, дітей 1-ї групи — до 2–3 епізодів на рік (до лікування діти хворіли на ГРІ 3–5 разів на рік). Ця категорія дітей після проведеного лікування за захворюваністю на ГРІ та хвороби лор-органів була виключена з групи дітей, які часто хворіють.
З огляду на отримані клінічні дані надалі імунологічному обстеженню в динаміці були піддані пацієнти 2-ї і 4-ї груп, у яких порівняно з пацієнтами 1-ї і 3-ї груп було отримано найкращий клінічний ефект. Групи порівняння (5-ту і 6-ту групу) становили 30 пацієнтів (по 15 пацієнтів у кожній групі), які отримували традиційне лікування, що не включало спрей (краплі) і таблетки Цитроімунал Бебі і Цитроімунал.
При імунологічному обстеженні наша увага була звернена на показники, що характеризують стан імунітету цієї категорії пацієнтів.
Було встановлено, що на 10-й день від початку курсу Цитроімуналу в пацієнтів вірогідно підвищувався вміст у слині sIgA і лізоциму, сироваткових IgG і IgA, фагоцитарна й біоцидна активність лейкоцитів крові, а також зростали титр АТ до етіологічних інфекційних агентів і ЗАД бактерій і афінність вироблюваних антимікробних антитіл.
У 2-й групі обстежуваних дітей концентрація секреторного IgA в слині зростала в 2,0 раза, сироваткового IgA — в 1,58 раза, IgG — у 1,62 раза, лізоциму — в 1,67 раза порівняно з вихідними значеннями. Реакція гуморальної ланки імунної системи цих дітей нагадувала реакцію дітей, які епізодично хворіють (ДЕХ), на розвиток лор-захворювань. У гострий період захворювання в ДЕХ уміст sIgA в слині підвищувався в 1,88 раза, сироваткового IgA — в 1,41 раза, IgG — у 2,71 раза, лізоциму — в 1,29 раза порівняно з їх вмістом до захворювання. Слід зауважити, що в ДЧХ порівняно з ДЕХ у цей період був нижчим вміст у слині sIgA (0,28 ± 0,02 г/л; у ДЕХ — 0,49 ± 0,09 г/л), сироваткового IgA (0,19 ± 0,02 г/л; у ДЕХ — 0,24 ± 0,02 г/л), IgG (0,156 ± 0,130 г/л; у ДЕХ — 0,193 ± 0,140 г/л) і лізоциму (27,3 ± 2,1 мг/л; у ДЕХ — 34,1 ± 2,6 мг/л). Після одужання у ДЧХ, які отримали Цитроімунал Бебі, всі показники місцевого імунітету відповідали значенням норми й залишалися такими і через 6 місяців.
У 4-й групі обстежуваних дорослих пацієнтів концентрація секреторного IgA в слині зростала в 1,5 раза, сироваткового IgA — у 1,2 раза, лізоциму — в 1,66 раза, рівень IgG практично підвищувався незначно порівняно з вихідними значеннями. Після одужання пацієнтів, які приймали Цитроімунал, і при подальшому аналізі їх показники місцевого імунітету зберігалися на рівні норми через 6 місяців.
У пацієнтів, які в комплексному лікуванні не отримували Цитроімунал Бебі, істотного підвищення показників факторів імунітету не відбувалося (табл. 1). Через 1 і 6 місяців вивчені показники місцевого імунітету в них були на рівні значень до захворювання (інтерморбідний період).
На 10-й день імунотерапії у дітей 2-ї групи ФІ і ФЧ лейкоцитів крові підвищувалися в 1,68 і 1,69 раза відповідно, біоцидність — у 3,2 раза; у дорослих пацієнтів 4-ї групи ФІ і ФЧ лейкоцитів крові підвищувалися в 1,5 і 1,7 раза відповідно, біоцидність — у 2,4 раза (табл. 2). У пацієнтів 2-ї і 4-ї груп висока фагоцитарна й біоцидна активність зберігалася протягом усього терміну спостереження. У пацієнтів 5-ї і 6-ї груп, які не отримували Цитроімунал, підвищення активності фагоцитарних клітин на 10-ту добу було значно меншим, ніж у пацієнтів 2-ї і 4-ї груп (табл. 2). Слід зазначити, що значно підвищена порівняно з періодом до лікування фагоцитарна активність клітин у пацієнтів 2-ї і 4-ї груп зберігалася і на 30-ту добу, і через 6 місяців після закінчення лікування. Разом з тим видно, що в усі вивчені терміни (10-та доба, 30-та доба, 6 місяців) фагоцитарна й біоцидна активність лейкоцитів крові дітей 2-ї групи і дорослих пацієнтів 4-ї групи була вірогідно вищою, ніж у пацієнтів 5-ї і 6-ї груп. Також слід зазначити, що в пацієнтів 5-ї групи фагоцитарна активність клітин крові на 10-ту й 30-ту добу і 6 міс. після закінчення лікування була вірогідно нижчою, ніж у ДЕХ.
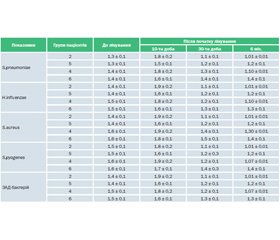
Під впливом Цитроімуналу в пацієнтів, які часто й тривало хворіють, 2-ї і 4-ї груп на 10-ту добу зростало вироблення антитіл до етіологічних інфекційних факторів і ЗАД бактерій до рівня, що відзначається в гострий період захворювання в пацієнтів, які хворіють епізодично. У пацієнтів 2-ї і 4-ї груп також зростала афінність вироблюваних антимікробних антитіл (табл. 3, 4). У період клінічного благополуччя (на 30-ту добу і через 6 міс. після закінчення лікування) у хворих 2-ї і 4-ї груп рівень антитіл до мікробних антигенів і афінність IgG і ЗАД відповідали значенням пацієнтів, які хворіють епізодично, після одужання (табл. 3, 4).
У пацієнтів, які не отримували Цитроімунал, на 10-ту добу підвищення титру антитіл до етіологічних інфекційних збудників було не настільки вираженим, а афінність вироблюваних антимікробних АТ вірогідно не змінювалася порівняно зі значеннями до лікування (табл. 3, 4). На 30-ту добу і через 6 міс. після закінчення лікування в пацієнтів 5-ї і 6-ї груп афінність АТ була вірогідно нижчою, ніж у пацієнтів 2-ї і 4-ї груп.
Отримані дані свідчать про те, що традиційна терапія, яка не включає препарати Цитроімунал і Цитроімунал Бебі, не компенсує імунореактивність у дорослих і не відновлює її в дітей до норми. Недостатня імунореактивність створює умови для персистенції інфекції і виникнення нових захворювань або рецидивування наявної патології, розвитку ускладнень у дітей і дорослих.
Отримані дані вказують на те, що призначення різних лікарських форм Цитроімунал Бебі (дітям) і Цитроімунал (дорослим) сприяє усуненню імунних розладів, пов’язаних з частою захворюваністю дітей і дорослих. Дослідження показали, що запропонована імунотерапія в 3–5 разів знижує частоту захворювань лор-органів і запобігає розвитку ускладнень. Крім того, застосування препаратів Цитроімунал і Цитроімунал Бебі сприяє підвищенню загальної імунореактивності організму й зниженню загальної захворюваності дітей і дорослих (грип, гострі респіраторні захворювання, захворювання шлунково-кишкового тракту).
Спостереження за хворими протягом півроку показало, що запропонована терапія дає тривалий виражений ефект.
Список литературы
1. Алексеева Е.С. Распространенность рецидивирующих воспалительных заболеваний в группе «часто и длительно болеющие пациенты». Актуальные проблемы современной медицины и фармации 2018: сборник тезисов докладов LXXII Международной научно-практической конференции студентов и молодых ученых. Минск: БГМУ, 2018. С. 1678.
2. Безшапочный С.Б., Гасюк Ю.А., Лобурец В.В., Вахнина А.Б. Механизмы местной защиты слизистой оболочки полости носа и околоносовых пазух. Вестник оториноларингологии. 2013. № 4. С. 44-47.
3. Богомильский М.Р. Значение бактериальной иммунокоррекции в лечении болезней уха, горла и носа у детей. Трудный пациент. 2007. № 10.
4. Вавилова В.П., Чернюк О.С., Караульнова Т.А., Тарасов Н.И. Новые пути влияния на местные факторы защиты у детей с патологией лимфоглоточного кольца. Лечащий врач. 2011. 6. 99-102.
5. Гаращенко Т.И., Ильенко Л. И., Гаращенко М. В. Элиминационная терапия слизистых оболочек верхних дыхательных путей в профилактике гриппа и ОРВИ. Вестник оториноларингологии. 2004. № 5. С. 58-59.
6. Заплатников А.Л., Гирина А.А., Коровина Н.А., Глухарева Н.С. Рибосомальная иммунопрофилактика острых и рекуррентных респираторных инфекций у детей. Фарматека. 2015. 1. 34-39.
7. Караулов А.В., Ликов В.Ф., Евстигнеева И.В., Кокушков Д.В. Оценка различных методов иммуномониторинга при проведении иммунокоррекции. Аллергология и иммунология. 2005. 6(2). 136-137.
8. Кищук В.В. Клініко-імунологічні підходи до оцінки функціонального стану піднебінних мигдаликів для діагностики та лікування хворих на хронічний тонзиліт: Автореф. дис… д-ра мед. наук. Київ, 2001. 35 с.
9. Кондратьева И.А., Ярылин А.А., Егорова С.Г. и др. Практикум по иммунологии: Учебное пособие для студентов высших учебных заведений. Под ред. Кондратьевой И.А. и Ярылина А.А. 2-е изд., испр. и доп. Москва: Издательский центр «Академия», 2004. 214 с.
10. Кузнецова Л.В. Лечение и профилактика острых респираторных заболеваний на фоне иммуномодулирующей терапии с применением комплекса Бион 3. Укр. медичний часопис. 2014, 29 червня (електронна публікація).
11. Мельников О.Ф., Заболотный Д.И. Диагностика иммунодефицитов при патологии слизистой оболочки на основе определения иммуноглобулинов в секретах. Киев: Институт оториноларингологии им. А.И. Коломийченко АМН Украины, 2003. 31 с.
12. Мельников О.Ф., Тимченко С.В., Заболотная Д.Д. и др. Соотношение в показателях местного иммунитета при воспалительных процессах в верхних дыхательных путях. Ринологія. 2002. № 4. С. 11-15.
13. Морозова О.В., Цыплаков Д.Э., Красножен В.Н. Иммуноморфологические особенности хронического ринита. Вестн. оторинолар. 2009. 5. С. 16-19.
14. Охотникова Е.Н. Комплексный подход к восстановлению иммунной защиты организма у детей. Укр. мед. часопис. 2012. № 6(92). С. 52-55.
15. Пальчун В.Т. Предупредить хронизацию и осложнения острого воспаления ЛОР-органов. Вестн. оториноларингологии. 2009. № 2. С. 4-6.
16. Плужников М.С., Лавренова Г.В., Катинас Е.Б. Основные принципы иммунокорригирующей терапии в оториноларингологии. Вестн. оторинолар. 2008. № 4.
17. Росси Дж.А. Методы диагностики и терапевтические возможности лечения рекуррентных респираторных инфекций у детей. РМЖ. 2014. 26. 1945-1948.
18. Тельнюк Я.И., Сетдикова Н.Х., Карсонова М.М. Особенности иммунной системы больных хроническим рецидивирующим фурункулезом и влияние иммунотропной терапии. Иммунология. 2003. № 1. С. 20-23.
19. Феклистова Л.В. Иммунная реабилитация часто болеющих детей: возможности применения Бион 3 Кид в качестве средства профилактики ОРЗ. Мед. совет. 2013. Спецвыпуск. 12 с.
20. Luxton R.W., Tompson E.J. Affinity distributions of antigen-specific IgG in patiens with multiple sclerosis and in patiens with viral encetalitis. J. Immunol. Meth. 1990. Vol. 131. P. 277-282.
21. Nielsen S.L., Blak F.T., Storgaard V. et al. Evaluation of a method for measurement of intracellular killing of staphylocyccus aureus in human neatrophiee granulocyte. ARMIS. 1995. № 103. Р. 460-468.
22. Fitzgerald K.A. NLR-containing inflammasomes: Central mediators of host defense and inflammation. European Journal of Immunology. 2010. Vol. 40(3). P. 595-598.

/9_m.jpg)