Вступ
Цукровий діабет (ЦД) у всіх його формах — це проблема глобального рівня, що стає тяжким людським і соціально-економічним тягарем для будь-якої країни світу, незалежно від рівня її економічного розвитку та доходів населення [1]. Патології підшлункової залози (ПЗ), у тому числі хронічний панкреатит (ХП), за темпами поширеності, відсотком хворих, які тимчасово, а то й постійно втратили працездатність, без перебільшення також можна віднести до вагомих медико-соціальних проблем сучасності [2].
Дискусія про те, як пов’язані між собою ХП і ЦД, ведеться досить давно, але в існуючих консенсусах цьому питанню приділено невелику увагу, а сформульовані положення мають недостатньо високий рівень доказовості [3].
Підшлункова залоза є унікальним органом із надзвичайно складною анатомо-фізіологічною організацією. Одночасне існування тканин, що мають ендокринну та екзокринну активність, вимагало проведення багаторічних досліджень для вивчення функціональних взаємозв’язків між цими двома частинами органа. На сучасному етапі розвитку медичної науки приходить розуміння того, що ці різні відділи ПЗ є частиною одного органа, тому порушення екзо- й ендокринної функції слід розглядати цілісно, у рамках так званої ацинарно-острівцево-ацинарної осі [4].
Функціонально активна паренхіма ПЗ, представлена ацинусами й острівцями, синтезує велику кількість різноманітних гормонів і біологічно активних речовин. Острівці підшлункової залози — це скупчення ендокринних клітин, розташованих серед екзокринної частини ПЗ, які становлять до 2–3 % від загального об’єму залози. Острівці складаються з п’яти типів ендокринних клітин (α, β, δ, ε і клітини PP/F), які синтезують і секретують, відповідно, глюкагон, інсулін, соматостатин (ССТ), грелін і поліпептиди ПЗ, усі з яких вважаються пептидними гормони. Бета-клітини є найбільш численним типом клітин (60–70 %) острівців, які секретують інсулін, що, в свою чергу, бере участь в тому числі й у регуляції екзокринної секреції ПЗ: інсулін стимулює базальну секрецію амілази та потенціює секретагог-стимульовану секрецію амілази. Альфа-клітини становлять близько 20 % і разом з δ-клітинами (1–2 %) утворюють мантію на зовнішній частині острівців ПЗ. У вентральній частці ПЗ деякі типи клітин географічно розділені PP/F-клітинами. Кількість ε-клітин регулюється в процесі розвитку і становить близько 10 % від загального об’єму острівця ПЗ плода, але в подальшому диференціюються на α- і β-клітини, тому у дорослих вони зустрічаються рідко. При цьому амілін і галанін синтезуються в β-клітинах і секретуються разом з інсуліном, а панкреастатин виробляється α-, β- і δ-клітинами і є похідним хромограніну, тоді як адреномедулін продукується в клітинах PP/F. Отже, щоб зрозуміти вплив цих острівцевих пептидів на екзокринну функцію ПЗ, важливо розуміти, що деякі з них (інсулін, глюкагон і панкреатичний поліпептид) унікальні тільки для острівців, але інші, такі як соматостатин, більш поширені в шлунково-кишковому тракті, що може вплинути на екзокринну функцію ПЗ локально або системно. Оскільки острівцеві пептиди можуть регулювати інші клітини всередині острівця, ефекти конкретного пептиду можуть бути опосередковані безпосередньо також на екзокринні клітини або шляхом впливу на секрецію інсуліну або іншого острівцевого пептиду [5].
Отже, дослідження змін гастроінтестинальних гормонів (ГІГ), що виробляються в тому числі і ПЗ, та їх динаміки на фоні корекції зовнішньосекреторної недостатності (ЗСН) ПЗ, особливо у хворих з поєднанням ХП та ЦД 2 типу, є актуальним, не до кінця вивченим питанням сучасної клінічної медицини.
Мета: визначити зміни рівня гастроінтестинальних гормонів у сироватці крові та їх динаміку на фоні замісної ферментної терапії у хворих на хронічний панкреатит та цукровий діабет 2 типу.
Матеріали та методи
Під нашим спостереженням за 2019–2021 рр. знаходилися 92 хворі на ХП та ЦД 2 типу, які перебували на стаціонарному лікуванні в ендокринологічному та гастроентерологічному КНП «Закарпатська обласна клінічна лікарня ім. А. Новака» ЗОД, у хірургічному відділенні № 1 Мукачівської центральної районної лікарні ім. Святого Мартина, а також знаходились на амбулаторно-диспансерному спостереженні у дільничного сімейного лікаря за місцем проживання.
Серед обстежених чоловіків було 53 (57,6 %), жінок — 39 (42,4 %). Середній вік становив (51,8 ± 6,2) року. У контрольну групу ввійшло 20 практично здорових осіб (11 чоловіків (55,0 %), 9 жінок (45,0 %)). Середній вік — (45,2 ± 5,1) року.
Усі дослідження виконувались за згодою пацієнтів, а методика їх проведення відповідала Гельсінській декларації прав людини 1975 р. та її перегляду 1983 р., Конвенції Ради Європи про права людини і біомедицину та законодавству України.
Усім обстеженим пацієнтам проведено загальноклінічні, антропометричні, інструментальні та лабораторні методи дослідження. Для верифікації діагнозу звертали увагу на характер скарг, анамнез захворювання. Усім пацієнтам виконано ультразвукове дослідження органів черевної порожнини за загальноприйнятою методикою. У сироватці крові проведено стандартні загальні та біохімічні дослідження з акцентом на показники вуглеводного обміну (глюкози, інсуліну, глікозильованого гемоглобіну (HbA1c, %), тесту на порушення толерантності до глюкози).
Усім обстеженим хворим до та після лікування у сироватці крові методом імуноферментного аналізу (ІФА) проводили визначення рівня гастроінтестинальних гормонів, а саме показника сироваткового соматостатину, із застосуванням тест-системи Human Somatostatin EIA-1 Kit фірми RayBiotech, № 1.03930004301; рівня сироваткового холецистокініну (ХЦК) — із використанням тест-системи фірми Peninsula Laboratories (США); рівень сироваткового гастрину (ГН) визначався за допомогою ELISA Gastrin-EIA test kit Cat. No, CS001 30.
Діагноз ХП встановлювали відповідно до марсельсько-римських критеріїв (1989) з доповненнями Я.С. Циммермана (1995) та уточненнями Міжнародної класифікації хвороб 10-го перегляду, а також за Наказом МОЗ України від 10.09.2014 р. № 638 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при хронічному панкреатиті» [6]. Для вивчення зовнішньосекреторної функції підшлункової залози проводилось копрологічне дослідження, визначався рівень амілази сироватки крові та фекальної еластази 1 (ФЕ-1), а також використовували 13С-змішаний тригліцеридний (13С-ЗТДТ) та 13С-амілазний дихальні тести (13С-АДТ). Дихальні проби аналізували на інфрачервоному спектроскопі IRIS (IZINTA, Угорщина). Під час проведення С13-ЗТДТ отримали 13 дихальних проб. Залежно від концентрації 13СО2 у різних пробах будується крива, характер якої відображає наявність і ступінь ЗСН ПЗ. Екзокринну недостатність ПЗ, що супроводжується дефіцитом ліпази, виявляли шляхом аналізу кривої, яка відображає концентрацію 13СО2 у дихальних пробах (максимальна концентрація між 150 і 210 хв дослідження та сумарна концентрація після 360 хв дослідження). У нормі максимальна концентрація 13CO2 між 150 і 210 хв дослідження становить більше 8 %, а сумарна концентрація на 360 хв дослідження — 30–35 % 13СO2. При ЗСН ПЗ спостерігається зниження активності інтрадуоденальної панкреатичної ліпази при максимальній концентрації між 150 і 210 хв дослідження менше 8 % 13СО2 і сумарній концентрації 13СО2 у кінці 360 хв — менше 23 % [7, 8].
Також проводили С13-АДТ. При нормальній активності панкреатичної амілази сумарна концентрація 13CO2 до кінця тесту (360 хв) повинна становити більше 10 %, якщо показник менший за 10 % — це свідчить про зниження активності панкреатичної амілази і вказує на хронічне ураження ПЗ [7, 8].
Рівень ФЕ-1 досліджували за допомогою ІФА, використовуючи тест-системи фірми ScheBo® Biotech AG (Німеччина). Інтерпретацію результатів проводили за такою градацією: рівень ФЕ-1 у калі більше 200 мкг/г калу — збережена зовнішньосекреторна функція ПЗ; 150–200 мкг/г калу — легка ЗСН ПЗ; 100–150 мкг/г калу — помірна ЗСН ПЗ; менше 100 мкг/г калу — тяжка ЗСН ПЗ.
Надання медичної допомоги обстеженим хворим на ЦД проводили згідно з клінічними протоколами МОЗ України та локальними протоколами. Діагноз ЦД 2 типу встановлено згідно з рекомендаціями IDF (2005), а також із урахуванням критеріїв уніфікованого клінічного протоколу (Наказ МОЗ України від 21.12.2012 № 1118) [9]. Ступінь тяжкості ЦД 2 типу оцінювали за рівнем HbA1c (норма — до 6,0 %).
Хворих на ХП та ЦД 2 типу розподілено на дві клінічні групи — залежно від методу корекції ЗСН ПЗ, а саме: І група (n = 40) — хворі на ХП та ЦД 2 типу на фоні базисної терапії (модифікація способу життя, дієтичні рекомендації, прийом метформіну в індивідуальному дозуванні) приймали ферментний препарат (мінітаблетки) пангрол 10 000 чи мезим капсули 10 000 («Берлін-Хемі», Німеччина) по 1 капсулі 3 рази на добу під час прийому їжі. Одна капсула мінітаблеток містить свиний панкреатин з мінімальною активністю ліпази 10 000 ОД Євр.Фарм., амілази — 9000 ОД Євр.Фарм., протеази — 500 ОД Євр.Фарм. Пацієнтам І групи призначено інгібітор протонної помпи (ІПП) пантопразол по 20 мг 1 раз на добу зранку за 30–40 хвилин до прийому їжі.
Хворі на ХП та ЦД 2 типу ІІ групи (n = 52) на фоні базисної терапії приймали ферментний препарат (мінітаблетки) пангрол 25 000 чи мезим капсули 25 000 («Берлін-Хемі», Німеччина) по 1 капсулі 3 рази на добу під час прийому їжі. Одна капсула мінітаблеток містить панкреатин (порошок з підшлункових залоз свиней), що має мінімальну ліполітичну активність 25 000 ОД Євр.Фарм., мінімальну амілолітичну активність — 22 500 ОД Євр.Фарм., мінімальну протеолітичну активність — 1250 ОД Євр.Фарм. Хворі ІІ групи отримували також ІПП пантопразол по 40 мг 1 раз на добу зранку за 30–40 хвилин до прийому їжі. Курс лікування вищенаведеними препаратами у хворих І та ІІ групи становив 1 місяць.
Ефективність лікування оцінювали наприкінці першого місяця терапії ферментними препаратами за допомогою дихальних тестів (С13-ЗТДТ та С13-АДТ) та зміни рівня ФЕ-1, а також повторно визначали показники соматостатину, гастрину та холецистокініну у сироватці крові.
Критеріями виключення хворих з дослідження також були: ЦД 1 типу, ЦД 2 типу (легкий та тяжкий (із вираженими проявами діабетичної ангіонейропатії) ступінь), наявність гелікобактерної інфекції, онкологічні захворювання (у тому числі і підшлункової залози).
Наукове дослідження виконано в рамках НДР № 851 «Механізми формування ускладнень при захворюваннях печінки та підшлункової залози, методи їх лікування та профілактики», номер державної реєстрації 0115U001103, а також загальнокафедральної теми кафедри пропедевтики внутрішніх хвороб ДВНЗ «Ужгородський національний університет».
Аналіз та обробку результатів обстеження хворих здійснювали за допомогою комп’ютерної програми Statistica 10.0 (фірми StatSoft Inc., США) з використанням параметричних і непараметричних методів оцінки отриманих результатів.
Результати
У всіх пацієнтів, які знаходились під нашим спостереженням, діагностовано ЦД 2 типу середнього ступеня тяжкості, а також підтверджено діагноз ХП, що проявлялось порушенням ЗСН ПЗ за даними результатів клініко-лабораторних та інструментальних методів обстеження.
На фоні прийому замісної ферментної терапії у хворих на ХП та ЦД 2 типу наприкінці лікування визначали покращення клінічної симптоматики (табл. 1). Прийом мінітаблетованого поліферментного препарату з мінімальною активністю ліпази 10 000 та 25 000 ОД в обстежених на ХП та ЦД 2 типу призводив майже однаковою мірою до зменшення больового синдрому (на 30,0–34,6 % відповідно у хворих І та ІІ груп; р < 0,05) і проявів біліарної диспепсії (на 32,5–38,5 % відповідно у хворих І та ІІ груп; р < 0,05). Прояви кишкової диспепсії (схильність до проносів, поліфекалія, стеаторея, здуття живота) також зменшились після місячного курсу комплексної терапії, але більш виражену позитивну динаміку встановлено при використанні поліферментного препарату з мінімальною активністю ліпази 25 000 ОД на основний прийом їжі (ІІ група пацієнтів); р < 0,01.
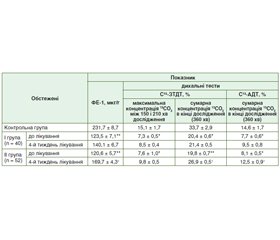
Ефективність проведеної замісної ферментної терапії в кінці 4-го тижня лікування у хворих на ХП та ЦД 2 типу оцінювали за допомогою С13-ЗТДТ та С13-АДТ та повторним визначенням активності ФЕ-1 (табл. 2).
До проведеної комплексної терапії у всіх обстежених хворих на ХП та ЦД 2 типу діагностовано ЗСН ПЗ за результатами 13С-ЗТДТ та 13С-АДТ, а також результатів ФЕ-1. Аналіз проведеної замісної ферментної терапії за результатами показників дихальних тестів та еластази-1 у калі вказує на більш виражену позитивну динаміку у ІІ групі хворих на ХП та ЦД 2 типу, які отримували мінітаблетований поліферментний препарат з мінімальною активністю ліпази 25 000 ОД. При цьому встановили статистично вірогідне підвищення максимальної концентрації 13СО2 між 150 і 210 хв дослідження (до (9,8 ± 0,5) %), а також сумарної концентрації 13СО2 в кінці 360 хв дослідження (до (26,9 ± 0,5) %) за результатами С13-ЗТДТ; р < 0,05. При характеристиці результатів С13-АДТ отримали ідентичні результати, як і при оцінці показників С13-ЗТДТ, а саме максимальну позитивну динаміку в обстежених хворих ІІ групи; р < 0,05. Слід зазначити, що у хворих І групи жоден лабораторно-інструментальний метод повторної оцінки ЗСН ПЗ не підтвердив його статистично вірогідну позитивну динаміку.
Аналіз рівня гастроінтестинальних гормонів у сироватці крові у хворих на ХП та ЦД 2 типу до лікування вказує на їх зміни порівняно з показниками контрольної групи, а саме статистично вірогідне зниження рівня гастрину (р < 0,01) і холецистокініну (р < 0,05) та підвищення рівня соматостатину у сироватці крові (р < 0,05). Результати наведені у табл. 3.
/20.jpg)
Повторне визначення концентрації вищенаведених гастроінтестинальних гормонів у сироватці крові дало змогу встановити вірогідне збільшення рівня гастрину у хворих ІІ групи (до (72,7 ± 3,0) пг/мл відповідно; р < 0,01), що супроводжувалось зменшенням показника соматостатину у сироватці крові (до (0,503 ± 0,044) пг/мл у хворих також ІІ групи; р < 0,05). Ці зміни супроводжувались збільшенням концентрації ХЦК у сироватці крові, проте вірогідну різницю нами не виявлено у жодній групі обстежених пацієнтів. У хворих на ХП та ЦД 2 типу І групи встановлено лише тенденцію до збільшення гастрину та, відповідно, незначне зниження рівня соматостатину у сироватці крові (р > 0,05).
Порушення вуглеводного обміну, що проявлялось до лікування збільшенням рівня глюкози, HbA1c, інсуліну, С-пептиду у сироватці крові та індексу НОМА-IR у хворих на ХП та ЦД 2 типу, після курсу терапії мали тенденцію до зменшення/нормалізації в обох групах обстежених пацієнтів (табл. 4). Привертає увагу той факт, що в ІІ групі обстежених хворих досягнуто статистично вірогідне покращення показників вуглеводного обміну (р < 0,05). Слід зазначити суттєве зниження рівня інсуліну у сироватці крові (у 2,1 раза) та індексу НОМА-IR (в 1,6 раза) в ІІ групі пацієнтів, які до базисної терапії отримували мінітаблетований поліферментний препарат з мінімальною активністю ліпази 25 000 ОД та ІПП в дозі 40 мг на добу, тоді як у хворих І групи рівень інсуліну знизився лише в 1,3 раза, а індексу НОМА-IR — в 1,2 раза.
Статистичний аналіз дав змогу встановити залежність між зниженням рівня гастрину та соматостатину у сироватці крові в обстежених хворих на ХП т ЦД 2 типу (ІІ група). Виявлено позитивний вплив нормалізації ГІГ на показники вуглеводного обміну, а саме рівень інсуліну та НОМА-IR. При цьому сильна кореляційна залежність встановлена між рівнем інсуліну, НОМА-IR та показником соматостатину. Зменшення рівня ССТ також позитивно вплинуло на динаміку ФЕ-1 та С13-ЗТДТ.
Обговорення
Відомо, що гормони, які виробляються ПЗ, суттєво впливають на зовнішньосекреторну частину залози, хоча дані експериментів in vivo суперечливі [4].
Соматостатин уперше був ідентифікований в екстрактах гіпоталамуса як фактор, здатний інгібувати вивільнення гормона росту, що містить 14 амінокислот (ССТ-14), а пізніше була виявлена друга форма, яка складається з 28 амінокислот (ССТ-28). Подальші дослідження встановили, що ССТ широко виробляється в організмі, включаючи інші відділи мозку, тонкий кишечник, острівці ПЗ та шлунок. На даний час ССТ розглядається і як гормон, і як паракринний регулятор. Як правило, діє як інгібітор певних фізіологічних процесів, таких як секреція гастрину в шлунку та секреція інсуліну в острівцях ПЗ. Основна кількість циркулюючого ССТ надходить з кишечника, а не з острівців ПЗ. Однак ССТ, що виділяється з острівців D-клітинами, має прямий вплив на інші острівцеві клітини, а також екзокринні клітини ПЗ. Результати досліджень in vivo вказують, що ендогенне вироблення ССТ підшлунковою залозою підвищується після прийому їжі і це певною мірою призводить до інгібування секреції інсуліну та амілази. Крім цього, імунонейтралізація циркулюючого ССТ призводить до посилення секреції амілази ПЗ [5].
Дослідження, спрямовані на вивчення дії ССТ на екзокринні клітини ПЗ, в основному проводилися з використанням ізольованих ацинусів підшлункової залози, які були відокремлені від острівців. У цих дослідженнях показано, що ССТ-14, ССТ-28 інгібують секрецію амілази. В іншому дослідженні, проведеному на перфузійній підшлунковій залозі щурів, встановлено, що високий рівень глюкози викликає секрецію як інсуліну, так і ССТ, а антагоніст ССТ посилює секрецію амілази, індуковану глюкозою [5].
Без сумніву, існує взаємозв’язок між гормонами, що виробляються острівцями, та екзокринними ферментами ацинусів ПЗ. Стає очевидним факт, що фармакологічний контроль ендокринних порушень ПЗ при ЦД має покращити функціонування екзокринного відділу залози, а також це має працювати і в протилежному напрямку, тобто корекція ЗСН ПЗ має позитивно впливати і на гормоноутворюючу функцію органа.
В експериментальному дослідженні S.G. Pierzynowski та співавт. (2017) встановлено, що в інтактних свиней пероральне введення ферментного препарату ПЗ (креон) за 1 годину до глюкозотолерантного тесту призводить до зниження рівня глюкози в крові. Інфузія амілази або пептидів амілази разом із глюкозою в біліопанкреатичну куксу також знижує рівень глюкози в крові у свиней з дуоденоеюнальним анастомозом. Отримані дані вказують на новий вплив (не пов’язаний із травленням) ентеральних ферментів ПЗ — ймовірно, амілази або її пептидів — на гомеостаз глюкози завдяки зменшенню загального всмоктування глюкози в кров і інсуліновій відповіді [10].
За даними S.G. Pierzynowski та співавт. (2018), підвищення активності амілази підшлункової залози в крові після інфузії амілази призводить до зниження стимульованого глюкозою вивільнення інсуліну/С-пептиду в експериментальних тварин після баріатричної операції. На основі проведених досліджень авторами зроблено висновок, що рівень амілази в крові — це динамічний фізіологічний параметр, який є не просто наслідком вироблення екзокринних травних ферментів ПЗ, але, скоріше, регульованим фактором, що бере участь в асиміляції глюкози і регуляції прандіального інсуліну [11].
Вплив екзокринної функції ПЗ на глюкозоопосередковану інсулінову відповідь та утилізацію глюкози вивчали на моделі свиней з недостатністю екзокринної функції підшлункової залози L. Lozinska та співавт. (2016). Результати припускають існування регуляторної комунікації ациноінсулярної осі. За їх даними, присутність ферментів ПЗ в кишечнику сприяє інсулінонезалежній утилізації глюкози [12].
Таким чином, отримані результати експериментальних досліджень дають змогу встановити взаємозалежні зв’язки між екзокринною та ендокринною частинами ПЗ. Особливо актуальним є подальше дослідження цих взаємозалежних впливів у пацієнтів з поєднанням ХП та ЦД 2 типу, а також визначення впливу патогенетично обґрунтованих схем лікування на їх динаміку.
Покращення ЗСН ПЗ на фоні прийому поліферментного препарату з мінімальною активністю ліпази 25 000 ОД у складі комплексної терапії у хворих на ХП та ЦД 2 типу за результатами наших досліджень також супроводжується вираженою позитивною динамікою у показниках вуглеводного обміну та рівнів ГІГ. Таким чином, використання ферментних препаратів у хворих з поєднаною патологією (ХП та ЦД 2 типу) є патогенетично обґрунтованим не лише для корекції ЗСН (за результатами динаміки рівня ФЕ-1, дихальних тестів), але й для покращення рівня ГІГ (соматостатину, гастрину, холецистокініну), що, в свою чергу, позитивно впливає на показники вуглеводного обміну (зниження рівня глюкози, інсуліну, С-пептиду у сироватці крові та індексу НОМА).
Проте необхідні подальші дослідження для більш чіткого розуміння впливу ГІГ, зміни ЗСН ПЗ на фоні ферментної терапії та показників вуглеводного обміну й їх взаємозв’язків у хворих на ХП та ЦД 2 типу.
Висновки
1. У хворих на ХП та ЦД 2 типу встановлено порушення рівнів гастроінтестинальних гормонів, а саме зниження рівня гастрину і холецистокініну та підвищення показника соматостатину у сироватці крові.
2. Використання поліферментного препарату з мінімальною активністю ліпази 25 000 ОД є ефективним засобом для нормалізації клінічних та лабораторно-інструментальних проявів ЗСН ПЗ у хворих на ХП та ЦД 2 типу.
3. Призначення поліферментного препарату з мінімальною активністю ліпази 25 000 ОД у поєднанні з ІПП у хворих на ХП та ЦД 2 типу є патогенетично обґрунтованим методом лікування ЗСН ПЗ, а також сприяє покращенню показників вуглеводного обміну на фоні нормалізації співвідношення рівня гастрину та соматостатину у даних пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Усі дослідження, виконані в межах даної наукової роботи (придбання реагентів, оплата досліджень в приватних лабораторних мережах), здійснено за рахунок фінансування здобувачем В.Є. Барані в межах гранту «Для підтримки наукових досліджень молодих угорськомовних науковців (рік присудження — 2019/2020 та 2020/2021 навчальні роки)».
Інформація про внесок кожного автора: Сірчак Є.С. — концепція і дизайн дослідження, аналіз отриманих даних; Барані В.Є. — обробка й аналіз матеріалів, написання тексту; Петрічко О.І. — підбір тематичних хворих; Рего О.Ю. — збирання й обробка матеріалів.
Отримано/Received 28.01.2021
Рецензовано/Revised 15.02.2021
Прийнято до друку/Accepted 21.02.2021

/20.jpg)
/21.jpg)