Вступ
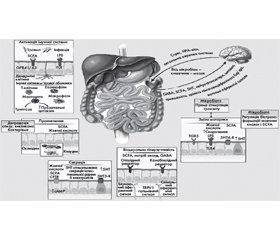
Виразкова хвороба дванадцятипалої кишки (ВХДПК) у дітей становить серйозну проблему клінічної медицини [1]. Упродовж останніх трьох десятиліть погляди на етіологію і патогенез даного захворювання істотно змінилися [2]. На сьогодні основною причиною виникнення ВХДПК вважається інфікування слизової оболонки Helicobacter pylori (H. pylori) [3–5]. H. pylori — один із найбільш поширених збудників хронічних інфекцій людини: приблизно 60 % населення нашої планети інфіковані ним, зокрема загальна поширеність у дитячій популяції становить в економічно нерозвинених країнах від 33 % у віці 10–15 місяців до 84 % у віці від 5 до 8 років [6] і в економічно розвинених від 8,9, 36,4 і 31,9 % у 1-, 2- і 4-річних дітей у Німеччині [7] та 1,9, 7,1 і 6,7 % у Японії [8]. Поєднання несприятливих чинників, наприклад вплив гіперпродукції хлористоводневої кислоти, пепсину, дуоденогастрального рефлюксу, інфекції Н. pylorі, призводить до порушення мікрофлори кишечника. Кишковий мікробіоценоз становить собою високоорганізовану систему з регуляцією якісного і кількісного складу мікрофлори в різних динамічних станах організму людини (рис. 1) [9].
/28.jpg)
Нормальна мікрофлора кишечника виконує важливу роль в організмі людини, особливо в дітей, впливаючи на імунітет і стійкість до патогенів, бере участь в усіх видах обміну макро- та мікронутрієнтів, активує ферменти кишечника, беручи участь у перетравленні харчових речовин і печінково-кишковій циркуляції компонентів жовчі, регуляції диференціювання та регенерації тканин, насамперед епітеліальних, підтримці іонного гомеостазу організму, має дезінтоксикаційну функцію [10–13]. Дисбактеріоз кишечника характеризується зміною якісного і/або кількісного складу мікробіоти, метаболічними та іншими порушеннями, що в деяких хворих супроводжується клінічними симптомами ураження кишечника. Проблема порушення кишечного мікробіоценозу обговорюється відомими експертами з питань гастроентерології, педіатрії, алергології, імунології, мікробіології, медичної генетики [14–16].
Застосування останнім часом молекулярно-генетичних методів дослідження в рамках глобального міжнародного проєкту «Мікробіом людини» дозволило ідентифікувати численні види мікроорганізмів, які знаходяться в різних екологічних нішах людини. Найчисленнішим мікробним угрупуванням у людини є кишкова мікробіота, кількість якої в 10 та 150 разів більша від загальної кількості клітин і генів в організмі людини відповідно. Як колонізація H. pylori впливає на склад мікробіоти кишечника в людини, невідомо. F. Frost et al. [17] досліджували зв’язок інфекції H. pylori зі складом мікробіоти кишечника в популяційному когортному дослідженні Study-of-Health-in-Pomerania (SHIP)-TREND та встановили глибокі зміни в мікробіотах осіб, інфікованих H. pylori. Зміни в мікробіоценозі порожнини товстої кишки, як правило, є передвісниками відхилень у мікробіоценозі в інших відкритих порожнинах, а також у фізіологічному статусі організму людини загалом [18]. Однак дані наукової літератури про кількісні і якісні зміни мікрофлори травного тракту як у нормі, так і при патології різняться між собою [19–21]. Тому вивчення мікробіологічних аспектів розвитку захворювань, зокрема асоційованих із H. pylori, потребує всестороннього аналізу.
Мета: проаналізувати стан мікробіоценозу кишечника в дітей, хворих на хелікобактерасоційовану виразку дванадцятипалої кишки.
Матеріали та методи
Проведено комплексне клінічне й інструментально-лабораторне обстеження 90 дітей, хворих на ВХДПК, асоційовану з H. pylori, віком 7–18 років (середній вік — 12,3 ± 2,6 року), які проживали в м. Чернівці та Чернівецькій області. Дослідження проводились у два етапи. Перший етап — ретроспективне дослідження за період 2010–2017 рр. із метою вивчення поширеності H. рylori-інфекції серед дитячого населення. Із цією метою проаналізовано архівні історії хвороби дітей, які перебували на стаціонарному лікуванні в гастроентерологічних відділеннях дитячих лікарень. Другий етап — проспективне дослідження. Для формування вибірки обрано описовий тип дослідження з одномоментним зрізом. Репрезентативність вибірки досягалася завдяки випадковому відбору дітей, які хворіли на ВХДПК, асоційовану з H. pylori. Критерії включення в дослідження: місце проживання (м. Чернівці та Чернівецька область), вік (7–18 років), стать (кількість хлопчиків та дівчаток), однотипність клінічного діагнозу, однотипний характер порушень функції шлунка, єдина діагностична програма, позитивний тест на H. pylori. Критерії виключення з дослідження: наявність декомпенсованої супутньої патології, вік до 7 років, обстеження в інших лікувально-профілактичних закладах, проживання за межами Чернівецької області, вживання антибактеріальної терапії, біопрепаратів, пробіотиків упродовж одного місяця та антисекреторних препаратів за 4 доби до дослідження. Дослідження проведене з урахуванням основних положень GCР ІCH та Гельсінської декларації з біомедичних досліджень. Дизайн дослідження передбачав дотримання принципів конфіденційності та поваги до особистості дитини й інших етичних принципів стосовно осіб, які виступають суб’єктами дослідження.
Верифікація клінічного діагнозу проводилася відповідно до протоколів лікування дітей за спеціальністю «дитяча гастроентерологія» (наказ МОЗ України № 59, 2013 рік). Верифікація H. pylori здійснювалася безпосередньо під час ендоскопічного дослідження (забір біоптатів із тіла, антрального відділу шлунка та цибулини ДПК). У сироватці крові дітей, хворих на ВХДПК, методом імуноферментного аналізу виявляли сумарні антитіла до антигена CagA H. pylori, використовуючи тест-систему «ХелікоБест-антитіла» («Вектор-Бест», Росія). Дослідження мікрофлори товстої кишки проводилося відповідно до рекомендацій Р.В. Епштейн-Литвак і Ф.Л. Вільшанської (1977). Використовувався класичний метод посіву фекалій [22], розведених в ізотонічному розчині натрію хлориду (102–109), на диференційно-діагностичні середовища (референтні штами Escherichia coli АТСС25922; Pseudomonas aerugіnosa АТСС27853-(F51); Bacillus subtilis АТСС6633; Staphylococcus aureus АТСС25923-(F-49); Klebsiella pneumoniaе № 43; Proteus mirabilis № 50; Proteus vulgaris № 52; Citrobacter koseri ATCC 27156). Для оцінки ступеня тяжкості дисбактеріозу використовували класифікацію І.В. Куваєвої і К.С. Ладодо (1991). Індекс зустрічання (Р) визначали числом штамів певного виду відносно загальної кількості штамів мікроорганізмів, виділених в обстежених хворих, у вигляді такої формули: Р = А/В, де А — число штамів певного виду; В — загальна кількість штамів. Індекс постійності (С) характеризує відсоток виділення того чи іншого виду мікроорганізмів у патологічному матеріалі (випорожненнях тощо) обстежених пацієнтів і вираховується за формулою: С = р/Р × 100 %, де р — кількість зразків, що містять досліджуваний вид; Р — кількість взятих зразків.
Нормальність розподілу ознаки у варіаційному ряду оцінювали за допомогою критерію Колмогорова — Смирнова. Дані, що відповідають закону нормального розподілу, наведені у вигляді середнього значення і стандартного відхилення. При порівнянні кількісних ознак двох сукупностей, що відповідають закону нормального розподілу, використовували критерій Стьюдента. Критерій Манна — Уїтні застосовували, якщо порівнювані сукупності не відповідали закону нормального розподілу. Для оцінки зв’язку між ознаками застосовували коефіцієнт рангової кореляції Спірмена. Рівень статистичної значущості — р < 0,05. Результати дослідження статистично оброблені за допомогою пакетів комп’ютерних програм Statistiсa for Windows 8.0.0. (SPSSI.N.C.; 1989–1997), StatistiСa V.6.0 (StatSoft Inc.; 1984–1996), табличного редактора Microsoft Ехсеl 2003.
Результати
Ретроспективно проаналізовано 368 медичних карт стаціонарного хворого дітей віком 7–18 років, які перебували на стаціонарному лікуванні в гастроентерологічному відділенні впродовж 2015–2019 рр. Аналіз показав, що серед дітей із ВХДПК інфіковані Н. pylori 90 зі 110 хворих, що становить 81,8 %. Динаміка частоти Н. pylori(+) ВХДПК за п’ятирічний період показала коливання показника: зниження у 2017 (з 83,5 % у 2015 році до 78,1 % у 2017 році) із подальшим зростанням у 2019 році до 85,3 % (рис. 2). Виявлено різницю в частоті інфікування Н. pylori серед дітей із ВХДПК залежно від місця проживання (рис. 3).
/29.jpg)
У хворих на ВХДПК, асоційовану з Н. pylori, суттєво знижується виявлення біфідобактерій та виділення з порожнини товстої кишки пептострептококів — у 3,87 раза, ентерококів — у 7,45 раза. У біотопі дітей, хворих на ВХДПК, асоційовану з Н. pylori, спостерігається тенденція до зниження виявлених лактобактерій та зниження у 2,5 рази ентеробактерій роду Pantotea на фоні підвищення умовно-патогенних анаеробних бактерій роду Clostridium у 10 разів, P. niger — у 6 разів, факультативних анаеробних та аеробних ентеротоксигенних та ентеропатогенних ешерихій, а також більше ніж у 3 рази умовно-патогенних протеїв і стафілококів. Найбільш часто виявляються відхилення в бік зростання дріжджоподібних грибів роду Candida. Такі різноспрямовані виявлення таксонів мікроорганізмів призводять до змін ролі різних груп у мікробіоценозі. Розглядаючи таксономічний склад виділеної мікробіоти з вмісту порожнини товстої кишки хворих на ВХДПК, асоційовану з Н. pylori, можна стверджувати, що до головної мікробіоти порожнини товстої кишки даної когорти хворих входять бактерії роду Lactobacillus, Bacteroides, Escherihia, E. сoli Hly+, Proteus, Peptostreptoccus, Staphylococcus, P. niger та Enterococcus. Додаткова мікробіота біотопу представлена бактеріями роду Bifidobacterium, Clostridium, Enterobacter, Citrobacter, ентеротоксигенними ешерихіями і стафілококами, а випадкова — пептококом, клостридіями, ентеропатогенними ешерихіями, протеями, пантотеями і дріжджоподібними грибами роду Candida (табл. 1, 2).
/30.jpg)
Порівнюючи показники дітей із недеструктивними і деструктивними ураженнями, ми отримали такі результати. У дітей із недеструктивними ураженнями частіше виявлялося зниження кількості біфідобактерій на відміну від пацієнтів із деструктивними ураженнями (27,2 і 8,8 % відповідно), а також молочнокислих мікроорганізмів (22,4 і 8,8 % відповідно). Кількість ентерококів частіше змінювалася в пацієнтів із деструктивними ураженнями (72,1 %) на відміну від пацієнтів із недеструктивними ураженнями (52,7 %). Зменшення кількості ешерихій із нормальною ферментативною активністю виявлялося в 46,9 % дітей при недеструктивних ураженнях і в 24,6 % при деструктивних ураженнях. Різноманітна умовно-патогенна флора частіше висівалася в дітей із деструктивними ураженнями.
Обговорення
Оскільки нормальне функціонування травного каналу передбачає участь симбіонтних мікроорганізмів, особливого значення набуває вивчення мікроекологічних аспектів цієї проблеми [23]. Дослідження мікробіоценозу товстої кишки необхідне для вивчення механізмів хронізації запальних захворювань, їх подальшого прогресування і реалізації запальної реакції по шляху ульцерогенезу [24]. Мікробіота, виявляючи генотоксичну активність, задіюється до пошкодження механізмів клітинної репарації [25].
Гелікобактеріоз супроводжується порушенням імунореактивності, антимікробної резистентності, метаболічними відхиленнями, дисбіотичними змінами в складі мікрофлори [17]. При цьому складні процеси, що відбуваються в організмі, не дозволяють вірогідно судити про первинність або вторинність дисбактеріозу в ґенезі гелікобактерасоційованих хронічних запальних захворювань верхніх відділів травного тракту. Оскільки гелікобактерна інфекція зазвичай пов’язана з певним колом захворювань органів травлення, то в таких хворих слід очікувати розвитку системного дисбіозу, включаючи порушення мікробіоценозу товстої кишки [18]. Так, наприклад, інфікування макроорганізму H. pylori і тривале його персистування в організмі людини як чужорідного агента порушує ендоекологію травної трубки і може розглядатися як фактор, який ініціює та посилює порушення мікробіоценозу шлунково-кишкового тракту, що сприяє пригніченню росту симбіотичної мікрофлори (біфідобактерії, лактобацили, бактероїди, кишкова паличка тощо) і подальшої колонізації слизової оболонки патогенними й умовно-патогенними мікроорганізмами. З іншого боку, гелікобактеріоз можна розглядати як окремий випадок дисбіозу слизової оболонки шлунка. Масивна антигелікобактерна терапія, призначення нераціональних схем лікування, порушення режиму і вкорочення термінів прийому препаратів сприяють появі антибіотикостійких штамів H. pylori і супроводжуються розвитком виражених дисбіотичних явищ, які потребують корекції [26, 27].
Висновки
Поширеність H. pylori в дітей із ВХДПК становить 81,8 %. У більшості дітей із цією патологією реєструються різноманітні порушення кишкової мікрофлори, які можуть ускладнювати перебіг захворювання, посилювати хронізацію процесу, знижувати ефективність антигелікобактерної терапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті та дотримання принципів конфіденційності, концепції інформованої згоди та урахування основних положень GCР ІCH та Гельсінської декларації з біомедичних досліджень.
Отримано/Received 20.12.2020
Рецензовано/Revised 11.01.2021
Прийнято до друку/Accepted 20.01.2021
Список литературы
1. Ихсанов С.Д., Сергиенко Д.Ф. Язвенная болезнь у детей: современный взгляд на проблему. Современные проблемы науки и образования. 2017. URL: http://www.science-education.ru/ru/article/view?id=26286 (дата звернення: 17.12.2020).
2. Бєлоусова О.Ю., Павленко Н.В., Волошин К.В. та ін. Сучасні проблеми лікування хелікобактер-асоційованих захворювань у дітей: можливості ад’ювантної терапії. Здоров’я дитини. 2017. 12(1). 239-248.
3. Kuna L., Jakab J., Smolic R. et al. Peptic Ulcer Disease: A Brief Review of Conventional Therapy and Herbal Treatment Options. J. Clin. Med. 2019. 8(2). 179. doi: 10.3390/jcm8020179.
4. UEG Week 2018 Poster Presentations. United European Gastroenterol. J. 2018. 6(8). 135-747. doi: 10.1177/2050640618792819.
5. Gold B.D., Gilger M.A., Czinn S.J. New Diagnostic Strategies for Detection of Helicobacter pylori Infection in Pediatric Patients. Gastroenterol. Hepatol. 2014. 10(12). 1-19.
6. Kienesberger S., Perez-Perez G., Olivares A.Z. et al. When is Helicobacter pylori acquired in populations in developing countries? A birth-cohort study in Bangladeshi children. Gut Microbes. 2018. 9(3). 252-263. doi: 10.1080/19490976.2017.1421887.
7. Rothenbacher D., Inceoglu J., Bode G., Brenner H. Acquisition of Helicobacter pylori infection in a high-risk population occurs within the first 2 years of life. J. Pediatr. 2000. 136(6). 744-748. doi: 10.3164/jcbn.19-47.
8. Okuda M., Miyashiro E., Booka M., Tsuji T., Nakazawa T. Helicobacter pylori colonization in the first 3 years of life in Japanese children. Helicobacter. 2007 Aug. 12(4). 324-327. doi: 10.1111/j.1523-5378.2007.00510.x.
9. Shin A., Preidis G.A., Shulman R., Kashyap P.C. The Gut Microbiome in Adult and Pediatric Functional Gastrointestinal Disorders. Clinical Gastroenterology and Hepatology. 2019. 17(20). 256-274. doi: 10.1016/j.cgh.2018.08.054Get rights and content.
10. Fujimura K.E., Sitarik A.R., Havstad S. et al. Neonatal gut microbiota associates with childhood multisensitized atopy and T cell differentiation. Nat. Med. 2016. 22(10). 1187-1191. doi: 10.1038/nm.4176.
11. Human Microbiome Project Consortium (2012a). A framework for human microbiome research. Nature. 2012. 486(7402). 215-221.
12. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012. 486(7402). 207-202.
13.Yatsunenko T., Rey F.E., Manary M.J. et al. Human gut microbiome viewed across age and geography. Nature. 2012. 486(7402). 222-227.
14. The Integrative HMP (iHMP) Research Network Consortium. Nature. 2019. 569. 641-648.
15. Lloyd-Price J., Arze C., Huttenhower C. Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases. Nature. 2019. 569. 655-662. doi: 10.1038/s41586-019-1237-9.
16. Huttenhower C., Gevers D., Knight R. The Human Microbiome Project (HMP) Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012. 486. 207-214. doi: 10.1038/nature11234.
17. Frost F., Kacprowski T., Rühlemann M. et al. Helicobacter pylori infection associates with fecal microbiota composition and diversity. Sci. Rep. 2019. 9. 20100. doi: 10.1038/s41598-019-56631-4.
18. Faten A.S., Alsulaimany, Zuhier A.A. et al. Prevalence of Helicobacter pylori Infection and Diagnostic Methods in the Middle East and North Africa Region. Medicina (Kaunas). 2020 Apr. 56(4). 169. doi: 10.3390/medicina56040169.
19. Schulz C., Schütte K., Koch N. et al. The active bacterial assemblages of the upper GI tract in individuals with and without Helicobacter infection. Gut. 2018. 67(2). 216-225. doi: 10.1136/gutjnl-2016-312904.
20. Heimesaat M.M., Fischer A., Plickert R. et al. Helicobacter pylori induced gastric immunopathology is associated with distinct microbiota changes in the large intestines of long-term infected Mongolian gerbils. PLoS One. 2014. 9(6). e100362.
21. Yap T.W., Gan H.M., Lee Y.P. et al. Helicobacter pylori Eradication Causes Perturbation of the Human Gut Microbiome in Young Adults. PLoS One. 2016. 11(3). e0151893. doi: 10.1371/journal.pone.0151893.
22. Волянський Ю.Л., Мироненко Л.Г., Калініченко С.В. Стандартизація приготування мікробних суспензій: інформаційний лист № 163. Київ: МОЗ України: Укрмедпатентінформ, 2006.
23. Гріднєв О.Є., Губська О.Ю. Роль кишкової мікрофлори у підтриманні здоров’я або формуванні певних захворювань та трансплантація фекальної мікробіоти як перспективний метод корекції серйозних патологічних станів. Гастроентерологія. Гепатологія. Колопроктологія. 2019. 4(54). 15-17.
24. Clair V.O., Emeran V., Mayer A. The Gut-Brain Axis and the Microbiome: Mechanisms and Clinical Implications. Clinical Gastroenterology and Hepatology. 2019. 17(2). 322-332. doi: 10.1016/j.cgh.2018.10.002.
25. Friedrich M.J. Genomes of microbes inhabiting the body offer clues to human health and disease. JAMA. 2013. 309(14). 1447-1449. doi: 10.1001/jama.2013.2824.
26. Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clinical Gastroenterology and Hepatology. 2019. 17(2). 333-344. doi: 10.1016/j.cgh.2018.09.028.
27. Jeong S.J., Lee K.H., Kim J.H. et al. Efficacy and Gut Dysbiosis of Gentamicin-Intercalated Smectite as a New Therapeutic Agent against Helicobacter pylori in a Mouse Model. Antibiotics. 2020. 9(8). 502. https://doi.org/10.3390/antibiotics9080502.

/28.jpg)
/29.jpg)
/30.jpg)
/31.jpg)