Вступ
Хондросаркома — гетерогенна група неепітеліальних злоякісних пухлин хрящової тканини. За даними літератури, на частку хондросаркоми припадає близько 20–25 % усіх сарком кісток [1, 2]. Пухлина зустрічається частіше в зрілому віці, переважно в 40–60 років. Чоловіки хворіють в 1,5–2 рази частіше за жінок. Зазвичай страждають плоскі кістки, частіше тазового і плечового поясів, іноді — діафізи довгих трубчастих кісток [3]. За локалізацією хондросаркоми поділяють на центральні та периферичні. Центральні виникають всередині кістки, периферичні — на поверхні кістки. Розрізняють первинну, що виникає в інтактних кістках, і вторинну хондросаркому, остання утворюється на фоні доброякісних хрящових пухлин або хрящових дисплазій [4]. До факторів, що сприяють малігнізації, у першу чергу слід віднести: неадекватне лікування, зокрема проведення економної резекції при хондромі кістки або неповне видалення кістково-хрящового екзостозу; тривале спостереження за виявленим доброякісним хрящовим новоутворенням [5]. Хондросаркома схильна до рецидивів. Метастазування хондросарком зазвичай відбувається гематогенним шляхом в легені, печінку, головний мозок, регіонарні лімфовузли [6]. Більшість хондросарком резистентні до хіміотерапії, тому основним методом лікування хондросарком є видалення первинної пухлини та її метастазів. Однак є винятки: дедиференційована хондросаркома (високодиференційована пухлина, нехрящовий компонент якої може бути представлений тканиною злоякісної фіброзної гістіоцитоми або остеогенної саркоми) — пухлина, чутлива до хіміотерапії, та мезенхімальна хондросаркома (рідкісний дрібноклітинний варіант хондросаркоми), теж чутлива до хіміотерапії, лікується як саркома Юїнга [7]. До 70-х років минулого сторіччя при пухлинному ураженні кісток кінцівки операцією вибору була ампутація або екзартикуляція кінцівки [8, 9]. На даний час світовий стандарт лікування хворих із злоякісними пухлинами кісток — комбінований або комплексний підхід, одним з етапів якого є хірургічне лікування. Завдання ортопеда при виконанні операції полягає в радикальності оперативного втручання. Існує декілька основних методик реконструкцій після проведення сегментарної резекції кістки: алотрансплантація, автотрансплантація та ендопротезування. Аналіз вітчизняної та зарубіжної літератури показав, що авто- й алотрансплантація має право на існування і застосовується низкою клінік [10–12], але на даний час 90 % пацієнтам на злоякісні ураження довгих кісток виконується органозберігаюче хірургічне лікування в обсязі сегментарної резекції з ендопротезуванням [13, 14]. Заміщення дефектів кісток онкологічними ендопротезами стало можливим у другій половині ХХ сторіччя. Це стало можливим завдяки використанню нових технологій лікування і застосуванню нових конструкцій ендопротезів [15]. В онкоортопедії при ендопротезуванні використовуються різні моделі і конструкції ендопротезів, в тому числі як цементні, так і безцементні системи і в більшості випадків нестандартні ендопротези [16, 17]. Перевагою ендопротезування, на відміну від інших методів реконструкції, є одномоментна компенсація імплантатом масивних кісткових дефектів при збереженні опороздатності та рухів в суглобі, що забезпечує відновлення функції кінцівки та покращує якість життя пацієнта [18]. За даними низки авторів, ендопротезування хоча і покращує функціональні, онкологічні та психологічні результати протипухлинного лікування, але не впливає на виживаність пацієнтів і прогноз захворювання [19–21]. У даній статті наводимо результати ендопротезування суглобів при хондросаркомі довгих трубчастих кісток.
Матеріали та методи
За період з 2009 по 2021 рік у клінічному відділі ДУ «Інститут травматології та ортопедії НАМН України» виконано 28 органозберігаючих операцій при хондросаркомі довгої трубчастої кістки в обсязі сегментарної резекції з наступним ендопротезуванням суглоба. Жінок було 17 (60,7 %), чоловіків — 11 (39,3 %). Середній вік хворих становив 46,8 ± 1,5 року, з них віком від 21 до 30 років — 2 хворі, від 31 до 40 років — 11, від 41 до 50 років — 4, від 51 до 60 років — 3, від 61 до 70 років — 7 і від 71 до 80 років — 1 хворий. 22 хворим імплантовані вітчизняні індивідуально виготовлені онкологічні ендопротези НВО «Інмед», 6 хворим імплантовані закордонні модульні ендопротези (3 — фірми «Valdemar Link» (Німеччина), 2 — «Beznoska» (Чехія), 1 — фірми «Stryker» (CША)). У табл. 1 наведені морфологічні форми хондросаркоми, які зустрічалися.
Обсяг хірургічного втручання залежав від локалізації пухлини: хворим винонувалася резекція суглобового сегмента або діафіза кістки з пухлиною та заміщення дефекту ендопротезом або металевим імплантом. У табл. 2 наведена кількість випадків ендопротезування суглобів.
Абластичне видалення пухлини суглобового сегмента спонукало виконувати широку резекцію новоутворення. При ендопротезуванні суглобів дотримувалися основних принципів онкохірургії — футлярності та абластичності, видалення одним блоком зони біопсії, виконували адекватну м’язову пластику, закриваючи ендопротез м’якими тканинами для пониження ризику ускладнень. З метою профілактики металозу та для фіксації м’язів ми використовували полімерні туби фірми «Mutars» (Німеччина), які мають підвищену тропність до м’яких тканин, що сприяє швидкому рубцюванню і відновленню природної точки прикріплення м’язів.
Залежно від конкретних анатомо-функціональних змін застосовувалися спеціальні конструкції імплантів, інструментарій та методичні прийоми, які доповнювали стандартну техніку операцій. При ендопротезуванні використовували цементний тип фіксації ендопротеза.
При дедиференційованій хондросаркомі проводили перед- і післяопераційне хіміотерапевтичне лікування згідно з протоколом лікування остеогенної саркоми: цисплатин, адріабластин, високодозовий іфосфамід, високодозовий метотрексат.
При мезенхімальній хондросаркомі проводили перед- і післяопераційне хіміотерапевтичне лікування згідно з протоколом лікування саркоми Юїнга: вінкристин, адріабластин, етопозид, високодозовий іфосфамід, циклофосфамід, актиноміцин.
Функціональний результат прооперованої кінцівки розраховувався за шкалою MSTS (Musculoskeletal Tumor Society). Оцінку якості життя хворих, яким проведено ендопротезування суглоба, проводили згідно з опитуванням за системою EORTC QLQ-С30 (шкала балів від 0 до 4). Виживаність пацієнтів оцінена за методом Каплана — Меєра.
Результати
У результаті ендопротезування великих суглобів у 28 хворих на хондросаркому ортопедичні ускладнення спостерігалися у 2 (7,1 %) пацієнтів та рецидиви пухлини у 2 (7,1 %) пацієнтів. При інфекційному ускладненні, яке спостерігалися в 1 хворого, виконано видалення ендопротеза та встановлено цементний спейсер, через 6 місяців виконано реендопротезування кульшового суглоба. Асептична нестабільність ніжки ендопротеза спостерігалася в 1 пацієнта після ендопротезування колінного суглоба, виконано реендопротезування суглоба.
При рецидиві хондросаркоми, який виявлено у 2 хворих в строки від 18 до 53 місяців, 1 пацієнту виконано ампутацію нижньої кінцівки на рівні середньої третини стегна, 1 пацієнту виконано ампутацію нижньої кінцівки на рівні нижньої третини стегна, у 3 хворих при дедиференційованій хондросаркомі та 1 хворого при мезенхімальній хондросаркомі з множинними метастазами в легені проводили курси поліхіміотерапії з наступною метастазектомією.
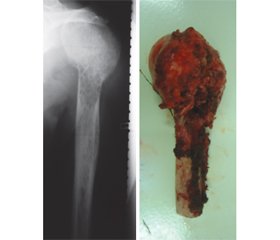
Наводимо перший приклад з нашої практики. Хворий П., 62 років, надійшов у відділення ДУ «Інститут травматології та ортопедії НАМН України» у квітні 2014 року з новоутворенням проксимального відділу лівої великогомілкової кістки (рис. 1). З анамнезу захворювання стало відомо, що у 2013 році хворий отримав травму проксимального відділу лівої великогомілкової кістки, з’явилась припухлість та біль у проксимальному відділі лівої гомілки, лікувався в ортопеда за місцем проживання: фізіопроцедури на колінний суглоб, внутрішньосуглобові ін’єкції гормональних препаратів. У відділенні ДУ «Інститут травматології та ортопедії НАМН України» пацієнту виконана трепанобіосія проксимального відділу лівої великогомілкової кістки. Патогістологічний висновок: хондросаркома високого ступеня злоякісності. З урахуванням патогістологічного висновку хворому в травні 2014 року виконано резекцію проксимального відділу лівої великогомілкової кістки з пухлиною та індивідуальне модульне ендопротезування лівого колінного суглоба ендопротезом «Valdemar Link» (рис. 2). Післяопераційний патогістологічний висновок: хондросаркома високого ступеня злоякісності. Післяопераційний період перебігав без ускладнень. У динаміці спостереження через 7 років даних за рецидив пухлини немає. Пацієнт користується нижньою кінцівкою в повному обсязі.
/58.jpg)
Наводимо другий приклад з нашої практики. Хворий Ж., 43 років, надійшов у відділення ДУ «Інститут травматології та ортопедії НАМН України» у листопаді 2013 року з новоутворенням проксимального відділу лівої плечової кістки (рис. 3А). З анамнезу захворювання: травму заперечує, у 2012 році з’явилися болі та обмеження обсягу рухів в лівому плечовому суглобі. Лікування за місцем проживання: фізіопроцедури на плечовий суглоб, внутрішньосуглобові ін’єкції гормональних препаратів. У 2013 році болі посилились, спостерігалася атрофія м’язів плечового пояса. У відділенні ДУ «Інститут травматології та ортопедії НАМН України» хворому виконано відкриту біопсію проксимального відділу лівої плечової кістки.
/59.jpg)
Патогістологічний висновок: хондросаркома середнього ступеня злоякісності. У січні 2014 року пацієнту виконано резекцію проксимального відділу лівої плечової кістки з пухлиною та індивідуальне ендопротезування лівого плечового суглоба ендопротезом «Inmed» (рис. 4Б). Післяопераційний патогістологічний висновок: хондросаркома середнього ступеня злоякісності. Післяопераційний період перебігав без ускладнень. На сьогодні рентгенологічно та клінічно даних за рецидив пухлини немає. Функціональний результат правої верхньої кінцівки (за шкалою MSTS) у межах 68 %.
Функціональний результат кінцівки (за шкалою MSTS) після ендопротезування кульшового суглоба становив 82,4 %, після резекції дистального відділу стегнової кістки та ендопротезування колінного суглоба — 89,2 %, після резекції проксимального відділу великогомілкової кістки та ендопротезування колінного суглоба — 80,6 %, після ендопротезування гомілковостопного суглоба — 72,3 %, після ендопротезування плечового суглоба — 68,4 %.
Якість життя хворих за опитувальником EORTC QLQ-30 підвищилась з 40–50 балів до ендопротезування і становила в середньому 85–90 балів після ендопротезування.
Загальна трирічна виживаність пацієнтів при хондросаркомі — 95,3 ± 1,7 %, п’ятирічна — 89,7 ± 2,1 %.
Загальна трирічна виживаність пацієнтів при мезенхімальній та дедиференційованій хондросаркомі становила 0 %.
Висновки
1. У результаті ендопротезування великих суглобів у хворих на хондросаркому післяопераційні ускладнення спостерігалися у 2 (7,1 %) пацієнтів та рецидиви пухлини у 2 (7,1 %) пацієнтів.
2. Застосування ендопротезування при хондросаркомі кістки сприяє відновленню функції та опороспроможності кінцівки й покращує якість життя пацієнта.
3. Пацієнтам з мезенхімальною та дедиференційованою хондросаркомою в схемах комбінованого лікування при ендопротезуванні суглобів показано проведення курсів поліхіміотерапії згідно з протоколами лікування остеогенної саркоми та саркоми Юїнга, але, незважаючи на проведення курсів поліхіміотерапії, виживаність пацієнтів при цих формах хондросаркоми низька.
Конфлікт інтересів. Дана публікація не викликає будь-якого конфлікту між авторами, не була і не буде предметом комерційної зацікавленості чи винагороди в жодній формі.
Отримано/Received 22.03.2021
Рецензовано/Revised 05.04.2021
Прийнято до друку/Accepted 16.04.2021
Список литературы
1. Limaiem F., Davis D.D., Sticco K.L. Chondrosarcoma. 2020 Dec 2. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2021 Jan. PMID: 30844159.
2. Chow W.A. Chondrosarcoma: biology, genetics, and epigenetics. F1000Res. 2018 Nov 20. 7. F1000 Faculty Rev-1826. doi: 10.12688/f1000research.15953.1. PMID: 30519452; PMCID: PMC6248264.
3. Karpik M., Reszeć J. Low Grade Chondrosarcoma — Epi-demiology, Diagnosis, Treatment. Ortop. Traumatol. Rehabil. 2018 Feb 27. 20(1). 65-70. doi: 10.5604/01.3001.0011.5879. PMID: 30152763.
4. Ferguson J.L., Turner S.P. Bone Cancer: Diagnosis and Treatment Principles. Am. Fam. Physician. 2018 Aug 15. 98(4). 205-213. PMID: 30215968.
5. Marco R.A., Gitelis S., Brebach G.T., Healey J.H. Cartilage tumors: evaluation and treatment. J. Am. Acad. Orthop. Surg. 2000 Sep-Oct. 8(5). 292-304. doi: 10.5435/00124635-200009000-00003. PMID: 11029557.
6. Ozaki T., Hillmann A., Lindner N., Blasius S., Winkelmann W. Metastasis of chondrosarcoma. J. Cancer Res. Clin. Oncol. 1996. 122(10). 625-8. PMID: 8879261.
7. MacDonald I.J., Lin C.Y., Kuo S.J., Su C.M., Tang C.H. An update on current and future treatment options for chondrosarcoma. Expert Rev. Anticancer Ther. 2019 Sep. 19(9). 773-786. doi: 10.1080/14737140.2019.1659731. Epub 2019 Sep 6. PMID: 31462102.
8. Campbell C.J. Indications and principles of amputation for bone sarcoma. Proc. Natl. Cancer Conf. 1970. 6. 757-67. PMID: 4917736.
9. Immenkamp M., Schilgen L., Hobik H.P. Die Indikation zur Amputation oder Resektion beim Chondrosarkom [Indications for amputation or resection in chondrosarcoma (proceedings)]. Z. Orthop. Ihre Grenzgeb. 1978 Aug. 116(4). 529. German. PMID: 706600.
10. Sanders P.T.J., Spierings J.F., Albergo J.I., Bus M.P.A., Fiocco M., Farfalli G.L., van de Sande M.A.J., Aponte-Tinao L.A., Dijkstra P.D.S. Long-Term Clinical Outcomes of Intercalary Allograft Reconstruction for Lower-Extremity Bone Tumors. J. Bone Joint Surg. Am. 2020 Jun 17. 102(12). 1042-1049. doi: 10.2106/JBJS.18.00893. PMID: 32265356.
11. Albergo J.I., Farfalli Luis G.L., Ayerza M.A., Muscolo D.L., Aponte-Tinao L.A. Proximal humerus chondrosarcoma.Long-term clinical and oncological outcomes. Rev. Esp. Cir. Ortop. Traumatol. 2019 May-Jun. 63(3). 181-186. English, Spanish. doi: 10.1016/j.recot.2019.01.002. Epub 2019 Mar 23. PMID: 30914237.
12. Дедков А.Г., Климнюк Г.И. Реконструкции диафизарных дефектов длинных костей при их поражении опухолями. Вісник ортопедії, травматології та протезування. 2010. 2. 36-42.
13. Климовицкий Ф.В., Бабоша В.А., Гребенюк Ю.А., Хасам Абу-Фаддех, Ютовец Ю.Г., Солоницын Е.А. Показания и противопоказания к эндопротезированию опухолевых дефектов костей коленного сустава. Травма. 2014. 15(4). 42-45.
14. Hardes J., Gosheger G., Budny T. Knochensarkome. Z. Orthop. Unfall. 2018 Feb. 156(1). 105-124. German. doi: 10.1055/s-0043-117905. Epub 2018 Feb 22. PMID: 29471560.
15. Andreou D., Henrichs M.P., Gosheger G., Nottrott M., Streitbürger A., Hardes J. Neue Operationsverfahren bei Knochentumoren [New surgical treatment options for bone tumors]. Pathologe. 2014 Nov. 35(Suppl. 2). 232-6. German. doi: 10.1007/s00292-014-2004-1. PMID: 25394971.
16. Barjaktarović R., Popović Z., Radoicié D. Megaendoprosthesis in the treatment of bone tumors in the knee and hip region. Vojnosanit Pregl. 2011 Jan. 68(1). 62-7. doi: 10.2298/vsp1101062b. PMID: 21417134.
17. Linares-González L.M., Rico-Martínez G., Dominguez-Hernández V.M., Araujo-Monsalvo V., Delgado-Cedillo E.A., León-Hernández S.R. Tratamiento y reconstrucción en tumores óseos del húmero con prótesis no convencional tipo RIMAG [Treatment and reconstruction of bone tumors of the with a RIMAG unconventional prosthesis]. Acta Ortop. Mex. 2014 Jan-Feb. 28(1). 3-11. Spanish. PMID: 26031131.
18. Zheng K., Yu X.C., Hu Y.C., Shao Z.W., Xu M., Wang B.C., Wang F. Outcome of segmental prosthesis reconstruction for diaphyseal bone tumors: a multi-center retrospective study. BMC Cancer. 2019 Jun 28. 19(1). 638. doi: 10.1186/s12885-019-5865-0. PMID: 31253134; PMCID: PMC6599373.
19. Amer K.M., Munn M., Congiusta D., Abraham J.A., Basu Mallick A. Survival and Prognosis of Chondrosarcoma Subtypes: SEER Database Analysis. J. Orthop. Res. 2020 Feb. 38(2). 311-319. doi: 10.1002/jor.24463. Epub 2019 Sep 22. PMID: 31498474.
20. Strotman P.K., Reif T.J., Kliethermes S.A., Sandhu J.K., Nystrom L.M. Dedifferentiated chondrosarcoma: A survival analysis of 159 cases from the SEER database (2001–2011). J. Surg. Oncol. 2017 Aug. 116(2). 252-257. doi: 10.1002/jso.24650. Epub 2017 Apr 18. PMID: 28420036.
21. Fromm J., Klein A., Baur-Melnyk A., Knösel T., Lindner L., Birkenmaier C., Roeder F., Jansson V., Dürr H.R. Survival and prognostic factors in conventional G1 chondrosarcoma. World J. Surg. Oncol. 2019 Sep 3. 17(1). 155. doi: 10.1186/s12957-019-1695-4. PMID: 31481076; PMCID: PMC6724259.
/59.jpg)

/57.jpg)
/58.jpg)
/59_2.jpg)