Международный эндокринологический журнал Том 17, №3, 2021
Вернуться к номеру
Антитиреоїдні антитіла при екстратиреоїдних автоімунних захворюваннях
Авторы: Сорокман Т.В., Гінгуляк М.Г., Макарова О.В.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
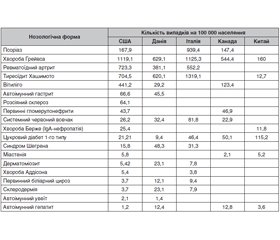
У цьому огляді узагальнені дані про частоту автоімунних захворювань та висвітлена поширеність антитиреоїдних антитіл при екстратиреоїдних автоімунних захворюваннях. У світі близько 5–7 % населення страждають від того чи іншого типу автоімунних хвороб. Серед шести найчастіших автоімунних захворювань переважають хвороби щитоподібної залози й асоційовані з ними захворювання. Висока поширеність автоімунних захворювань щитоподібної залози викликає питання щодо потенційної ролі антитиреоїдних антитіл у перебігу позатиреоїдних автоімунних захворювань. Вважається, що автоімунні захворювання є результатом взаємодії між тригерами, автоантигенами, генетичною схильністю, порушеннями толерантності автоантигенів і механізмами апоптозу. Серед відомих на сьогодні антитиреоїдних автоантитіл варто виділити антитіла до тиреоглобуліну (АТ-ТГ), антитіла до тиреоїдної пероксидази (АТ-ТПО), а також біспецифічні — АТ-ТГ і АТ-ТПО одночасно. До категорій функціонально значущих автоантитіл, що імітують функцію гормона та провокують розвиток автоімунної патології в результаті зв’язування з рецептором та подальшої стимуляції тиреоцитів, відносяться антитіла до рецепторів тиреотропного гормона (АТ-рТТГ). Циркулюючі антитіла проти антигенів щитоподібної залози не обмежуються тільки автоімунними захворюваннями щитоподібної залози, але також виявляються при інших автоімунних захворюваннях. Найчастіше при ревматоїдному артриті, цукровому діабеті типу 1 та целіакії. Зв’язок з іншими імунними патологіями додатково підтверджує те, що АТ-TПO також виявляли в 15 % пацієнтів, які страждали на астму, у 10–29 % пацієнтів з ідіопатичною пурпурою та вітиліго. Поширеність АТ-TПO трохи вища, ніж АТ-ТГ, а АТ-рТТГ рідко реєструються при нетиреоїдних імунологічних захворюваннях.
This review summarizes data on the incidence of autoimmune diseases and examines the prevalence of antithyroid antibodies in extrathyroid autoimmune diseases. In the world, about 5–7 % of the population suffers from one or another type of autoimmune diseases. Among the six most common autoimmune diseases, thyroid and associated diseases predominate. The high prevalence of autoimmune thyroid diseases raises questions about the potential role of antithyroid antibodies in the course of extrathyroid autoimmune diseases. It is believed that autoimmune diseases are the result of interactions between triggers, autoantigens, genetic predisposition, impaired tolerance of autoantigens and mechanisms of apoptosis. Among the currently known antithyroid autoantibodies, antibodies to thyroglobulin (TgAb), thyroid peroxidase (TPO), as well as bispecific autoantibodies to thyroglobulin and thyroid peroxidase are of particular importance. Categories of functionally significant autoantibodies that mimic hormone function and provoke the development of autoimmune pathology as a result of binding to the receptor and subsequent stimulation of thyrocytes include antibodies to thyroid-stimulating hormone receptor (rTSH-Ab). Circulating antibodies against thyroid antigens are not limited to autoimmune diseases of the thyroid gland, but are also found in other autoimmune diseases, most often in rheumatoid arthritis, type 1 diabetes mellitus and celiac disease. The association with other immune pathologies further confirms that TPO antibodies were also detected in 15 % of patients with asthma, in 10–29 % of those with idiopathic purpura and vitiligo. The prevalence of TPO antibodies is slightly higher than TgAb, and rTSH-Ab are rarely registered in non-thyroid immunological diseases.
антитиреоїдні антитіла; автоімунні захворювання; щитоподібна залоза; огляд
antithyroid antibodies; autoimmune diseases; thyroid gland; review
Висновки
- Sardu C., Cocco E., Mereu A., Massa R., Cuccu A., Marrosu M.G., Contu P. Population based study of 12 autoimmune diseases in Sardinia, Italy: prevalence and comorbidity. PLoS One. 2012. 7(3). e32487. doi: 10.1371/journal.pone.0032487.
- Ferrari S.М., Fallahi P., Antonelli A., Benvenga S. Environmental Issues in Thyroid Diseases. Front Endocrinol (Lausanne). 2017. 8. 50. doi: 10.3389/fendo.2017.00050.
- Tolentino Júnior D.S., de Oliveira C.M., de Assis E.M. Population-based Study of 24 Autoimmune Diseases Carried Out in a Brazilian Microregion. J. Epidemiol. Glob. Health. 2019. 9(4). 243-251. doi: 10.2991/jegh.k.190920.001.
- Lerner A. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. Journal of Timely Topics in Clinical Immunology. 2018. 2. 42. doi: 10.12691/ijcd-3-4-8.
- Júnior D.S.T. Environmental and individual factors associated with protection and predisposition to autoimmune diseases. Int. J. Health Sci. (Qassim). 2020. 14(6). 13-23. PMID: 33192227. PMCID: PMC7644454.
- Leso V., Vetrani I., De Cicco L. et al. The Impact of Thyroid Diseases on the Working Life of Patients: A Systematic Review. Int. J. Environ. Res. Public Health. 2020. 17(12). 4295. doi: 10.3390/ijerph17124295.
- Cooper G.S., Bynum M.L., Somers E.C. Recent insights in the epidemiology of autoimmune diseases: improved prevalence estimates and understanding of clustering of diseases. J. Autoimmun. 2009. 33. 197-207. doi: 10.1016/j.jaut. 2009.09.00.
- Sisó-Almirall A., Kostov B., Martínez-Carbonell E. et al. The prevalence of 78 autoimmune diseases in Catalonia (MASCAT-PADRIS Big Data Project). Autoimmun. Rev. 2020. 19(2). 102448. doi: 10.1016/j.autrev.2019.102448.
- Komisarenko Y.І., Bobryk M.I. Vitamin D Deficiency and Immune Disorders in Combined Endocrine Pathology. Front. Endocrinol. (Lausanne). 2018. 9. 600. doi: 10.3389/fendo.2018.00600.
- Tronko M.D., Brenner A.V., Olijnyk V.А. et al. Autoimmune thyroiditis and exposure to iodine 131 in the Ukrainian cohort study of thyroid cancer and other thyroid diseases after the Chornobyl accident: results from the first screening cycle (1998–2000). J. Clin. Endocrinol. Metab. 2006. 91(11). 4344-51. doi: 10.1210/jc.2006-0498.
- Krishna M.T., Subramanian A., Adderley N.J., et al. Allergic diseases and long-term risk of autoimmune disorders: longitudinal cohort study and cluster analysis. Eur. Respir. J. 2019. 54(5). 1900476. doi: 10.1183/13993003.00476-2019.
- Bartalena L., Masiello E., Magri F. et al. The phenotype of newly diagnosed Graves’ disease in Italy in recent years is milder than in the past: results of a large observational longitudinal study. J. Endocrinol. Invest. 2016. 39. 1445-1451. doi: 10.1007/s40618-016-0516-7.
- Seldin M.F. The genetics of human autoimmune disease: A perspective on progress in the field and future directions. J. Autoimmun. 2015. 64. 1-12. doi: 10.1016/j.jaut.2015.08.015.
- De Luca F., Shoenfeld Y. The microbiome in autoimmune diseases. Clin. Exp. Immunol. 2019. 195(1). 74-85. doi: 10.1111/cei.13158.
- Fallahi P., Ferrari S.М., Ruffilli I. et al. The association of other autoimmune diseases in patients with autoimmune thyroiditis: Review of the literature and report of a large series of patients. Autoimmun. Rev. 2016. 15(12). 1125-1128. doi: 10.1016/j.autrev.2016.09.009.
- Fröhlich E., Wahl R. Thyroid Autoimmunity: Role of Anti-thyroid Antibodies in Thyroid and Extra-Thyroidal Diseases. Front. Immunol. 2017. 8. 521. doi: 10.3389/fimmu.2017.00521.
- Gleicher N., Barad D., Weghofer A. Functional autoantibodies, a new paradigm in autoimmunity? Autoimmun. Rev. 2007. 7(1). 42-45. doi: 10.1016/j.autrev.2007.06.001.
- Cárdenas Roldán J., Amaya-Amaya J., Castellanos-de la Hoz J. et al. Autoimmune thyroid disease in rheumatoid arthritis: a global perspective. Arthritis. 2012. 2012. 864907. doi: 10.1155/2012/864907.
- Walsh S.J., Rau L.M. Autoimmune diseases: a leading cause of death among young and middle-aged women in the United States. Am. J. Public Health. 2000. 90. 1463-1466. doi: 10.2105/ajph.90.9.1463.
- Latrofa F., Ricci D., Grasso L. et al. Characterization of thyroglobulin epitopes in patients with autoimmune and non-autoimmune thyroid diseases using recombinant human monoclonal thyroglobulin autoantibodies. J. Clin. Endocrinol. Metab. 2008. 93(2). 591-6. doi: 10.1210/jc.2007-1199.
- Kahaly G.J., Diana T., Olivo P.D. TSH receptor antibodies: relevance & utility. Endocr. Pract. 2020. 26(1). 97-106. doi: 10.4158/EP-2019-0363.
- Subekti I., Boedisantoso A., Moeloek N.D., Waspadji S., Mansyur M. Association of TSH receptor antibody, thyroid stimula–ting antibody, and thyroid blocking antibody with clinical activity score and degree of severity of Graves ophthalmopathy. Acta Med. Indones. 2012. 44(2). 114-21. PMID: 22745141.
- Diana T., Kahaly G.J. Thyroid Stimulating Hormone Receptor Antibodies in Thyroid Eye Disease-Methodology and Clinical Applications. Ophthalmic. Plast. Reconstr. Surg. 2018. 34(4S Suppl. 1). S13-S19. doi: 10.1097/IOP.0000000000001053.
- Xie L.D., Gao Y., Li M.R., Lu G.Z., Guo X.H. Distribution of immunoglobulin G subclasses of anti-thyroid peroxidase antibody in sera from patients with Hashimoto’s thyroiditis with different thyroid functional status. Clin. Exp. Immunol. 2008. 154. 172-6. doi: 10.1111/j.1365-2249.2008.03756.x.
- Liu C., Hermsen D., Domberg J. et al. Comparison of M22-based ELISA and human-TSH-receptor-based luminescence assay for the measurement of thyrotropin receptor antibodies in patients with thyroid diseases. Horm. Metab. Res. 2008. 40(7). 479-83. doi: 10.1055/s-2008-1077051.
- Li Y., Teng D., Guan H. et al. Dynamic Changes in Antithyroperoxidase and Antithyroglobulin Antibodies Suggest an Increased Risk for Abnormal Thyrotropin Levels. Front. Endocrinol. (Lausanne). 2020. 11. 521. doi: 10.3389/fendo.2020.00521.
- Hutfless S., Matos P., Talor M.V., Caturegli P., Rose N.R. Significance of prediagnostic thyroid antibodies in women with autoimmune thyroid disease. J. Clin. Endocrinol. Metab. 2011. 96(9). E1466-71. doi: 10.1210/jc.2011-0228.
- Li L., Liu S., Yu J. Autoimmune thyroid disease and type 1 diabetes mellitus: same pathogenesis: new perspective? Ther. Adv. Endocrinol. Metab. 2020. 11. 2042018820958329. doi: 10.1177/2042018820958329.
- Kyritsi E.М., Kanaka-Gantenbein C. Autoimmune Thyroid Disease in Specific Genetic Syndromes in Childhood and Adolescence. Front. Endocrinol. (Lausanne). 2020. 11. 543. doi: 10.3389/fendo.2020.00543.
- Hatzioannou A., Kanistras I., Mantzou E. et al. Effect of Advanced Glycation End Products on Human Thyroglobulin’s Antigenicity as Identified by the Use of Sera from Patients with Hashimoto’s Thyroiditis and Gestational Diabetes Mellitus. Int. J. Endocrinol. 2015. 2015. 849615. doi: 10.1155/2015/849615.
- Kalyoncu D., Urganci N. Antithyroid antibodies and thyroid function in pediatric patients with celiac disease. Int. J. Endocrinol. 2015. 276575. doi: 10.1155/2015/276575.
- Mihailova S., Ivanova M., Mihaylova A. et al. Pro- and anti-inflammatory cytokine gene polymorphism profiles in Bulgarian multiple sclerosis patients. J. Neuroimmunol. 2005. 168(1-2). 138-43. doi: 10.1016/j.jneuroim.2005.06.020.
- Harel L., Prais D., Uziel Y. et al. Increased prevalence of antithyroid antibodies and subclinical hypothyroidism in children with juvenile idiopathic arthritis. J. Rheumatol. 2006. 33(1). 164-6. PMID: 16395764.
- Fekri M., Shokoohi M., Gozashti M. et al. Association between anti-thyroid peroxidase antibody and asthma in women. Iran J. Allergy Asthma Immunol. 2012. 11. 241-5. doi: 10.1016/j.ejcdt.2015.08.018.
- Ruggeri R.M., Imbesi S., Saitta S. et al. Chronic idiopa–thic urticaria and Graves’ disease. J. Endocrinol. Invest. 2013. 36(7). 531-6. doi: 10.3275/8940.
- Biondi B., Kahaly G.J., Robertson R.P. Thyroid Dysfunction and Diabetes Mellitus: Two Closely Associated Disorders. Endocr. Rev. 2019. 40(3). 789-824. doi: 10.1210/er.2018-00163.
- Bartalena L., Fatourechi V. Extrathyroidal manifestations of Graves’ disease: 2014 update. J. Endocrinol. Invest. 2014. 37. 691-700. doi: 10.1007/ s40618-014-0097-2.
- Pankiv I. The Impact of Vitamin D Status and Supplementation on Thyroid Autoimmunity. International journal of endocrinology (Ukraine). 2020. 16(8). doi: 10.22141/2224-0721.16.8.2020.222889.
- Woo Y.J., Jang S.Y., Lim T.Н., Yoon J.S. Clinical association of thyroid stimulating hormone receptor antibody levels with disease severity in the chronic inactive stage of Graves’ orbitopathy. Korean J. Ophthalmol. 2015. 29. 213-9. doi: 10.3341/kjo.2015.29.4.213 118.
- Chiarella G., Tognini S., Nacci A. et al. Vestibular disorders in euthyroid patients with Hashimoto’s thyroiditis: role of thyroid autoimmunity. Clin. Endocrinol. (Oxf). 2014. 81(4). 600-5. doi: 10.1111/cen.12471.
- Plowden T.С., Schisterman E.F., Sjaarda L.А. et al. Subclinical Hypothyroidism and Thyroid Autoimmunity Are Not Associated With Fecundity, Pregnancy Loss, or Live Birth. J. Clin. Endocrinol. Metab. 2016. 101(6). 2358-65. doi: 10.1210/jc.2016-1049.
- Busnelli A., Paffoni A., Fedele L., Somigliana E. The impact of thyroid autoimmunity on IVF/ICSI outcome: a systematic review and meta-analysis. Hum Reprod. 2016. 22(6). 775-90. doi: 10.1093/humupd/dmw03.

/51.jpg)
/52.jpg)
/53.jpg)