Журнал «Почки» Том 10, №2, 2021
Вернуться к номеру
Клініко-морфологічна характеристика ураження нирок при коінфекції ВІЛ/ВГС у пацієнтів, які не отримували антиретровірусну терапію
Авторы: Городецька А.І.(1), Дядик О.О.(2), Іванова М.Д.(2)
(1) — Комунальне некомерційне підприємство «Київська міська клінічна лікарня № 5», м. Київ, Україна
(2) — Національний університет охорони здоров’я України імені П.Л. Шупика МОЗ України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
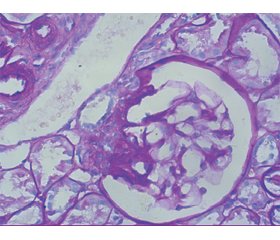
В епоху антиретровірусної терапії (АРТ) розвиток хронічної хвороби нирок (ХХН) серед ВІЛ-інфікованих пацієнтів є значним ускладненням, не пов’язаним безпосередньо з синдромом набутого імунодефіциту, ризик появи якого значно підвищується при коінфекції вірусом гепатиту С (ВГС). Патогенетичні шляхи розвитку уражень тканини нирки та формування морфологічного субстрату для кожного з вірусів є різними, але імуноопосередковані механізми є спільною ланкою для розвитку імунокомплексних захворювань. Для оцінки та прогнозування їх морфогенезу ми досліджували автопсію нирок 20 пацієнтів з коінфекцією ВІЛ/ВГС, які не отримували АРТ, та залежність виявленого морфологічного субстрату від рівня CD4+ у крові. Ми спостерігали переважно сегментарну мезангіальну проліферацію з розширенням мезангіального матриксу з ураженням клубочків ≥ 50 % у 15 (75 %) випадках та з залученням < 50 % клубочків у 3 (15 %) випадках. Ендокапілярна проліферація, інфільтрація клубочків моноцитами, нейтрофільними лейкоцитами, сегментарними макрофагами виявлена в 2 (10 %) випадках при залученні ≥ 50 % клубочків, що було розцінено як ексудативний компонент запальної реакції. У всіх випадках верифіковані склероз капілярних петель, що переважно супроводжувався їх спадінням/колапсом, потовщення стінок капілярів, а саме базальних мембран капілярів, і сегментарний склероз капілярних петель клубочка різного ступеня вираженості. Початковий інтерстиціальний фіброз строми був виявлений у 5 (25 %) випадках, дегенеративні зміни звивистих канальців — у 9 (45 %), переважно за показником Т0–Т1. Позитивна експресія IgA, IgМ та IgG, С3 фракції комплементу у вигляді лінійних і гранулярних депозитів вздовж ендотелію капілярів мала інтенсивність від «+» до «++». При зіставленні морфологічного патерна та рівня CD4+ у крові виявлено, що пацієнти з вираженою імуносупресією демонструють меншу кількість знайдених змін, переважно склеротичного характеру, а з підвищенням рівня CD4+ морфологічний субстрат збагачується проліферативним компонентом. Експресія імуноглобулінів і компонентів системи комплементу при імуногістохімічному дослідженні, зокрема в зонах склеротичних змін, верифікує наявність пролонгованих імунокомплексних уражень. Для визначення детального морфогенезу доцільно в подальшому провести кореляційний аналіз отриманих результатів із контрольними групами.
В эпоху антиретровирусной терапии (АРТ) развитие хронической болезни почек (ХБП) у ВИЧ-инфицированных пациентов является весомым осложнением, непосредственно не связанным с синдромом приобретенного иммунодефицита, риск развития которого значительно увеличивается при коинфекции вирусом гепатита С (ВГС). Патогенетические пути развития поражения тканей почки и формирования морфологического субстрата для каждого из вирусов разные, но иммуноопосредованные механизмы являются общим звеном для развития иммунокомплексных заболеваний. Для оценки и прогнозирования их морфогенеза мы исследовали некропсию почек 20 пациентов с коинфекцией ВИЧ/ВГС, которые не получали АРТ, и зависимость выявленного морфологического субстрата от уровня CD4+ в крови. Мы наблюдали преимущественно сегментарную мезангиальную пролиферацию с расширением мезангиального матрикса и поражением клубочков ≥ 50 % в 15 (75 %) случаях, а также с вовлечением < 50 % клубочков в 3 (15 %) случаях. Эндокапиллярная пролиферация, инфильтрация клубочков моноцитами, нейтрофильными лейкоцитами, сегментарными макрофагами обнаружены в 2 (10 %) случаях при вовлечении ≥ 50 % клубочков, что было расценено как экссудативный компонент воспалительной реакции. Во всех случаях верифицированы склероз капиллярных петель, который преимущественно сопровождался их спадением/коллапсом, утолщение стенок капилляров, а именно базальных мембран капилляров, и сегментарный склероз капиллярных петель клубочка разной степени выраженности. Начальный интерстициальный фиброз стромы был обнаружен в 5 (25 %) случаях, дегенеративные изменения извитых канальцев — в 9 (45 %), преимущественно с показателем Т0–Т1. Позитивная экспрессия IgA, IgM, IgG и С3 фракции комплемента в виде линейных и гранулярных депозитов вдоль эндотелия капилляров имела интенсивность от «+» до «++». При сопоставлении морфологического паттерна и уровня CD4+ в крови обнаружено, что пациенты с выраженной иммуносупрессией демонстрируют меньшее количество изменений, преимущественно склеротического характера, а с ростом уровня CD4+ морфологический субстрат обогащается пролиферативным компонентом. Экспрессия иммуноглобулинов и компонентов системы комплемента при иммуногистохимическом исследовании, в частности в зонах склеротических изменений, верифицирует наличие пролонгированных иммунокомплексных повреждений. Для определения детального морфогенеза является целесообразным проведение в дальнейшем корреляционного анализа полученных данных с контрольными группами.
In the era of antiretroviral therapy (ART), the development of chronic kidney disease in HIV-infected patients is a significant complication not directly related to acquired immunodeficiency syndrome (AIDS), the risk of which is increased with co-infection with hepatitis C virus (HCV). The pathogenetic pathways of the development of kidney tissue damage and the formation of a morphological substrate for each of the viruses are different, but the immune-mediated mechanisms are a common link for the development of immune complex diseases. We studied renal necropsy samples in 20 patients with HIV/HCV co-infection who did not receive ART, and the dependence of the identified morphological substrate on the level of CD4+ in the blood, to assess and predict their morphogenesis. We observed predominantly segmental mesangial proliferation with an expansion of the mesangial matrix and glomerular involvement ≥ 50 % in 15 (75 %) cases and glomerular involvement < 50 % in 3 (15 %) cases. Endocapillary proliferation (E), infiltration of glomeruli with monocytes, neutrophil leukocytes, segmental macrophages were found in 2 (10 %) cases with the involvement of ≥ 50 % of glomeruli, which was regarded as an exudative component of the inflammatory response. In all cases, sclerosis of capillary loops was verified, which was mainly accompanied by their collapse, thickening of the capillary walls, namely the basement membranes of capillaries and segmental sclerosis of capillary loops of the glomeruli of varying severity. Initial interstitial stromal fibrosis was found in 5 (25 %) cases, degenerative changes in the convoluted tubules — in 9 (45 %), mainly with the T0–T1 level. Positive expression of IgA, IgM, IgG, and C3 complement fractions in the form of linear and granular deposits along the capillary endothelium was detected with an intensity of “+” to “++”. We compared the verified morphological pattern and the level of CD4+ in the blood and found that patients with deeper immunosuppression show fewer changes, mainly characterized as sclerotic. Moreover, with an increase in the level of CD4+, the morphological substrate is enriched with a proliferative component. Expression of immunoglobulins and components of the complement system in immonohistochemical assay, in particular in areas of sclerotic changes, verifies the presence of prolonged immune complex associated lesions. To determine the detailed morphogenesis, it is advisable to perform a further correlation analysis of the data obtained with the control.
ВІЛ-інфекція; вірусний гепатит С; хронічна хвороба нирок; гломерулонефрит; CD4+; ВІЛ-асоційована нефропатія; імунокомплексне ураження нирок; морфогенез
ВИЧ; вирусный гепатит С; хроническая болезнь почек; гломерулонефрит; CD4+; ВИЧ-ассоциированная нефропатия; иммунокомплексное поражение почек; морфогенез
HIV; viral hepatitis C; chronic kidney disease; glomerulonephritis; CD4+; HIV-associated nephropathy; immune complex kidney damage; morphogenesis
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Wyatt C.M., Malvestutto C.D. et al. The impact of hepatitis C virus coinfection on HIV-related kidney disease: a systematic review and meta-analysis. AIDS. 2008 Sep 12. № 22(14). Р. 1799-1807. doi: 10.1097/QAD.0b013e32830e0152.
- Wyatt C.M. Kidney Disease and HIV Infection. Top Antivir. Med. 2017 Feb/Mar. № 25(1). Р. 13-16. PMID: 28402929. PMCID: PMC5677039.
- Rossi C., Raboud J., Walmsley S. et al. Canadian Observational Cohort (CANOC) Collaboration. Hepatitis C co-infection is associated with an increased risk of incident chronic kidney disease in HIV-infected patients initiating combination antiretroviral therapy. BMC Infect. Dis. 2017 Apr 4. № 17(1). Р. 246. doi: 10.1186/s12879-017-2350-8.
- Izzedine H., Sene D. et al. Kidney diseases in HIV/HCV-co-infected patients. AIDS. 2009 June 19. Vol. 23. Issue 10. Р. 1219-1226.
- Bruggeman L.A., Nelson P.J. Controversies in the pathogenesis of HIV-associated renal diseases. Nature reviews. Nephrology. 2009. № 5(10). Р. 574-581. https://doi.org/10.1038/nrneph.2009.139
- Cohen S.D., Kopp J.B., Kimmel P.L. et al. Kidney Diseases Associated with Human Immunodeficiency Virus Infection. The New England Journal of Medicine. 2017 Dec 14. doi: 10.1056/NEJMra1508467.
- Shmagel K.V., Shmagel N.G., Chereshnev V.A. et al. Immunity activation in HIV infection. Medical Immunology (Russia).2017. Vol. 19. № 5. Р. 489-504. doi: 10.15789/1563-0625-2017-5-489-504.
- Ketlinsky S.A. Humoral immune response to HIV-1 infection and altered function of B lymphocytes. Medical Immunology (Russia). 2012. № 14(3). Р. 183-188. doi.org/10.15789/1563-0625-2012-3-183-188.
- Sansonno D., Lauletta G., Montrone M. et al. Hepatitis C virus RNA and core protein in kidney glomerular and tubular structures isolated with laser capture microdissection. Clinical and experimental immunology. 2005. № 140(3). Р. 498-506. doi.org/10.1111/j.1365-2249.2005.02778.
- André P., Komurian-Pradel F., Deforges S. et al. Characterization of low- and very-low-density hepatitis C virus RNA-contai–ning particles. J. Virol. 2002 Jul. № 76(14). Р. 6919-28. doi: 10.1128/jvi.76.14.6919-6928.2002.
- Morphological classification of renal diseases. Available from: https://eurecamed.com.ua/services/morphological_classification_of_renal_diseases
- Kidney Disease: Improving Global Outcomes (KDIGO). Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter. 2012. Suppl. 2. Р. 1-138.
- Haas M., Rastaldi M.P., Fervenza F.C. Histologic classification of glomerular diseases: clinicopathologic correlations, limitations exposed by validation studies, and suggestions for modification. Kidney Int. 2014 Apr. № 85(4). Р. 779-93. doi: 10.1038/ki.2013.375.
- Huang X., Ma L., Ren P. et al. Updated Oxford classification and the international study of kidney disease in children classification: application in predicting outcome of Henoch-Schönlein purpura nephritis. Diagn. Pathol. 2019 May 10. № 14(1). Р. 40. doi: 10.1186/s13000-019-0818-0.
- Wang M., Wang R., He X. et al. Using MEST-C Scores and the International Study of Kidney Disease in Children Classification to Predict Outcomes of Henoch-Schönlein Purpura Nephritis in Children. Front. Pediatr. 2021 Apr 14. № 9. Р. 658845. doi: 10.3389/fped.2021.658845.
- Alamartine E., Sauron C., Laurent B. et al. The use of the Oxford classification of IgA nephropathy to predict renal survival. Clin. J. Am. Soc. Nephrol. 2011 Oct. № 6(10). Р. 2384-8. doi: 10.2215/CJN.01170211.
- What is the MEST-C score for immunoglobulin A (IgA) nephropathy? Available from: https://www.medscape.com/answers/239927-81336/what-is-the-mest-c-score-for-immunoglobulin-a-iga-nephropathy. Accessed May 19, 2020.
- Saidakova E.V., Shmagel K.V., Korolevskaya L.B. et all. СD4+ T-cell cycling in HIV-infected patiens with the discordant immunologic response to the antiretroviral therapy. Cytology (Russia). 2018. Vol. 20. № 12. doi: 10 4311./S0041377118120160.
- Shmagel K.V., Shmagel N.G., Chereshnev V.A. Immunity activation in HIV infection. Medical Immunology (Russia). Meditsinskaya Immunologiya. 2017. Vol. 19. № 5. Р. 489-504. doi: 10.15789/1563-0625-2017-5-489-504.
- Alter G., Moody M.A. The humoral response to HIV-1: new insights, renewed focus. The Journal of infectious diseases. 2010. № 202 (suppl. 2). S315-S322. https://doi.org/10.1086/655654

/15.jpg)
/16.jpg)