Очне дно є єдиним місцем в організмі, дослідження якого дозволяє без дорогої апаратури безпосередньо досліджувати мікроциркуляторне русло. Саме цей факт послужив основою рекомендацій Європейського товариства кардіологів щодо практичного застосування ретиноскопії при артеріальній гіпертензії (АГ). Однак докази на підтримку даних рекомендацій засновані на ранніх дослідженнях, що можуть не мати прямого відношення до сучасної клінічної практики [1, 2].
Метою даної роботи було надання оновленої інформації, що стосується виявлення, значущості та клінічного застосування змін судин очного дна, пов’язаних з АГ.
Визначення. Ретинопатія — ураження сітківки очного яблука будь-якого походження. Найбільш часто ретинопатія виявляється у пацієнтів з цукровим діабетом (ЦД), АГ, рідше — при ревматологічних захворюваннях, деяких інших станах, а також у практично здорових осіб. Найбільше клінічне значення має ретинопатія при діабеті, оскільки відносно швидко призводить до втрати зору. У пацієнтів з АГ сучасними посібниками гіпертонічна ретинопатія (ГР) розглядається з двох позицій: як ознака ураження органа-мішені — судин та як прогностичний критерій несприятливого перебігу АГ [3, 4].
Нерідко «судинну дисфункцію» внаслідок АГ розглядають як ранній етап в патогенезі атеросклерозу, що свідчить про підвищений ризик серцево-судинного захворювання [5, 6].
Поширеність ретинопатії. Ознаки мінімально або слабо вираженої ретинопатії зустрічаються в осіб без діабету в 5,4–6,0–7,7 % випадків [6–8], досягаючи в осіб старше 67 років 10,7 % [9]. Поширеність ретинопатії залежить від расової приналежності [10]. Серед пацієнтів з вперше діагностованою АГ поширеність ізольованої ГР досягає 31 % [11], а при довгостроково перебігаючій АГ — 66,3–75,95 % (1-й ступінь ГР — 33,6–37 %; 2-й ступінь — 32,7–42 %) [12–14].
Запропоновано модель розвитку ретинальної хвороби сітківки, яка пов’язує цю патологію з активацією ренін-ангіотензинової системи [15]. Справедливість цієї моделі підтверджіють дослідження, які виявили, що делеція алелі ангіотензинпере-творюючого ферменту має більш високий ризик, пов’язаний з розвитком ГР [16, 17].
Ризик розвитку ГР найбільшою мірою визначається тривалістю АГ, а також статусом тютюнопаління, обтяженою спадковістю з АГ, рівнем артеріального тиску (АТ) [18, 19].
Морфологічно на мікросудинному рівні ГР характеризується внутрішнім еу- або гіпертрофічним артеріолярним ремоделюванням і капілярним розрідженням. Ці відхилення частково залежать від передачі високо пульсуючого АТ в мікросудинні мережі, особливо в органи, що сильно перфузуються й мають низький судинний опір, такі як нирки, серце і мозок, що сприяє пошкодженню органів-мішеней.
Патофізіологічні стадії розвитку ГР [20]. Спочатку, у відповідь на тривале підвищення АТ, спостерігається спазм судин і підвищення тонусу артеріол сітківки (генералізоване звуження артеріол). Далі відбувається потовщення інтими, гіперплазія та гіалинова дегенерація стінок судин. Ця стадія відповідає більш вираженим генералізованим і вогнищевим звуженням артеріол, змінам артеріолярного і венулярного з’єднань і змінам артеріолярного рефлексу на світло. Далі розвивається некроз гладких м’язів і ендотеліальних клітин, ексудація крові і ліпідів, ішемія сітківки, що проявляється у вигляді мікроаневризм, крововиливів, твердих ексудатів і «плям вати». У цей час може статися набряк диска зорового нерва. Оскільки в наш час доступні ефективні методи контролю АТ, така патологія зустрічається рідко. Навпаки, у пацієнтів з АГ в даний час нерідкі макроаневризми й оклюзія гілок вени. Стадії ГР можуть бути непослідовними. Ознаки ексудативної стадії ГР неспецифічні, спостерігаються при діабеті та інших захворюваннях.
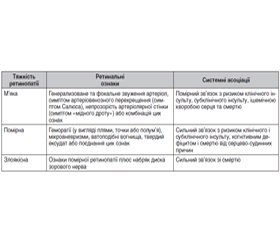
Класифікація. На сьогодні найбільш поширеною в Україні залишається класифікація Keith, Wagener і Baker (KWB) [21] (табл. 1).
Недоліками класифікації KWB є складність розділення ознак 1-го і 2-го ступеня ГР [22]. Щоб подолати обмеження класифікації KWB, запропоновані спрощені градації ГР на основі трьох ступенів [23]. Показано [24], що спрощена класифікація, наприклад Mitchell-Wong, в якій 1-ша та 2-га стадії KWB об’єднані в одну, при оцінці фотографій очного дна двома незалежними експертами демонструє подібні результати. Однак автори вважають, що в клінічній практиці може бути краще класифікація KWB, оскільки вона є більш спрощеною.
Методи дослідження очного дна. В даний час пряма ретиноскопія визнається не досить точною. Цей метод виявився ненадійним в осіб з помірною АГ з високою варіабельністю між дослідниками (20–42 %) і в одних і тих же дослідників (10–33 %) [25]. З кінця ХХ століття стало прийнятим, що наукові дослідження ГР повинні базуватися як мінімум на оцінці оцифрованих фотографій, при якій коефіцієнт внутрикласової кореляції становить 0,80–0,99. У цьому столітті впроваджені нові технології: флуоресцентна ангіографія, скануюча лазерна допплерівська флоуметрія, вимірювання співвідношення діаметра судин до його просвіту (коефіцієнт варіації всередині між дослідниками < 13 %) [5, 26].
Новим підходом до діагностики ГР є аналіз товщини шару центральної макули і нервових волокон сітківки, комплексу гангліозних клітин [27].
Паралелізм змін судин очного дна та інших регіонів. Ретинальний кровообіг має анатомічні, фізіологічні й ембріологічні зв’язки з церебральним кровообігом, і, можливо, процеси ураження ретинальних судин можуть відрізнятися від таких в інших регіонах. Більшість дослідників вважають, що порушення мікроциркуляції на очному дні та інших регіонах (доступно в шкірі, серці, підшкірній клітковині, нігтьовому ложі) в цілому перебігають паралельно [26, 28, 29]. Однак частина досліджень, що в цілому не суперечать вищесказаному, вказують на певні відмінності. Так, [30] показали, що порушення шкірної мікроциркуляції виявляються у хворих на ЦД з ретинопатію або без неї. При цьому автори роблять висновок, що більша частина показників мікроциркуляції шкіри корелювали з тяжкістю ретинопатії у цих пацієнтів. У пацієнтів зі склеродермією при проведенні капіляроскопії показано, що зміни сітківки можуть відрізнятися за якістю від змін капілярів нігтьового ложа [31].
Несподівані результати отримані при вивченні ретинопатії у пацієнтів із ЦД без АГ і з АГ методом ангіографії ретинальних судин за допомогою флуоресцеїну [32]. Встановлено, що АГ не призводить до більшого ураження макулярних судин, ніж ЦД без АГ. Автори пояснюють це тим, що більшості пацієнтів проводилася ефективна антигіпертензивна терапія.
Прогностичне значення ГР. Одним з фундаментальних досліджень на цю тему є робота [23]. Автори на основі аналізу популяційних досліджень узагальнили відомі дані (табл. 2).
Дослідження останніх років підтверджують висновки [23]. Не виявлено відмінностей між 1-ю і 2-ю стадіями ГР щодо ураження органів-мішеней з урахуванням швидкості пульсової хвилі, гіпертрофії лівого шлуночка (ГЛШ) і наявності бляшок сонних артерій. Також не виявлено залежності ГР від статі, індексу маси тіла, рутинних біохімічних тестів і супутніх захворювань [14, 24].
Легка ретинопатія не корелює з будь-якими маркерами ураження органів, обумовленого гіпертензією (УООГ), після поправки на вік, сімейний анамнез, ішемічну хворобу серця, індекс маси тіла, гіпотензивне лікування і лікування статинами [25].
Наведені в табл. 2 дані слід доповнити положеннями про взаємозв’язок ГР і хвороби дрібних судин (мозку). Так, слід вважати встановленим взаємозв’язок ГР з розвитком і прогресуванням лейкоареозу, що може передбачати розвиток лакунарних інфарктів [33]. ГР є незалежним чинником ризику розвитку лейкоареозу, і цей ризик значно збільшується в поєднанні з віком, з урахуванням ішемічної хвороби серця, наявністю бляшки в сонній артерії, підвищеним С-реактивним білком або АГ [34]. Особи з 2–3-м ступенями ГР за KWB мають майже в чотири рази частіше підкіркове пошкодження, пов’язане з захворюванням судин головного мозку, ніж ті, у кого немає ГР або є ГР 1-го ступеня [13].
Виявлення ознак ГР в осіб без АГ (генералізоване й осередкове звуження артеріол сітківки) передбачає, що ці ознаки можуть бути маркерами «передгіпертензії», вказувати на проміжні патологічні зміни на шляху до серцево-судинного захворювання [6, 35].
Ретинопатія 3–4-го ступеня за KWB демонструє значний зв’язок з патерном деформації ЛШ і збільшенням лівого передсердя за даними електрокардіографії (ЕКГ), ГЛШ і зниженням фракції викиду ЛШ при ехокардіографії, а також із серцевою недостатністю [36].
Паралелі розвитку ГР у часі та ушкодження інших органів-мішеней. Ознаки УООГ можуть виявлятися й у відносно здорових осіб, проте у пацієнтів з АГ їх число значно більше [37]. Визнано, що ГР є найбільш поширеним УООГ, що рано виявляється. Наприклад, за даними нідерландського дослідження, УООГ було виявлено у 44 % пацієнтів з АГ, направлених в клініку гіпертонії. При цьому ізольована ГР виявлена у 31 % пацієнтів, ГЛШ — у 15 %, мікроальбумінурія — в 11 % [11]. Ознаки ГЛШ практично були відсутні у пацієнтів без ГР і рідко зустрічалися при ГР 1–2-го ступеня [36]. Ознаки ГР 4-го ступеня (набряк зорового нерва) у даний час зустрічаються рідко, що пов’язують з ефективною антигіпертензивною терапією [20].
ГР і АТ. Визнано, що ознаки ГР тісно пов’язані з тривалістю і ступенем АТ, але непослідовно пов’язані з рівнем холестерину та іншими традиційними факторами серцево-судинного ризику [19, 38].
Результати добового моніторування АТ щодо ГР суперечливі. Так, показано [39], що поширеність і тяжкість ГР пов’язані з більш високим нічним систолічним АТ. Автори не відзначили зв’язку між нічним профілем АТ і наявністю ГР. У той же час [40] показали, що нічний профіль АТ non-dipping пов’язаний з ознаками ГР і рівнем мікроальбумінурії. Такий стан ми можемо пояснити низькою відтворюваністю цієї методики [41].
Піонерським за своїм підходом є швейцарське когортне дослідження [42], мета якого полягала в аналізі відмінностей між групами УООГ щодо систолічного і діастолічного офісного АТ (САТ, ДАТ). Це дослідження включало 1004 пацієнтів в середньому 64 років, 55,6 % були чоловіки, проводилося в період 2006–2013 років. УООГ визначалося як наявність інфаркту міокарда, ішемічної хвороби серця, проведення реваскуляризації, перенесені інсульт/транзіторна ішемічна атака, серцева недостатність, захворювання периферичних артерій, стеноз сонних артерій, швидкість клубочкової фільтрації (ШКФ) < 30 мл/хв і ретинопатії. Безсимптомне УООГ визначали як наявність ГЛШ за даними ЕКГ або ехокардіографії, хронічної хвороби нирок зі ШКФ 30–60 мл/хв, мікроальбумінурії, рівень глюкози > 6,9 ммоль/л або стеноз сонної артерії. На початку дослідження 49 % пацієнтів не мали УООГ, 30 % — безсимптомне УООГ і 21 % — симптоматичне. За час спостереження у 32 пацієнтів розвинулось нове симптоматичне УООГ. Авторами виявлено, що ДАТ значно відрізнявся за групами УООГ в різні моменти часу, і що важливо — більш низький ДАТ пов’язано зі збільшенням числа УООГ. Крім того, у пацієнтів, у яких розвинулось симптоматичне УООГ, був нижчий рівень холестерину ліпопротеїнів високої щільності, більш високий креатинін і більш низький ДАТ (медіана 78 проти 86 мм рт.ст., p < 0,001) на початку дослідження порівнянно з пацієнтами без УООГ або з безсимптомним УООГ. Автори дійшли висновку, що низький ДАТ є предиктором УООГ.
Ставлення до ГР в сучасних рекомендаціях. Експерти Європейського товариства кардіологів визнають, що наявність ознак ГР є критерієм УООГ судин [4, 43–45]. Однак серед факторів, що визначають серцево-судинний ризик у хворих на АГ (підрозділ «Безсимптомне ураження органів, опосередковане гіпертензією»), пропонується використовувати тільки ознаки вираженої ГР з ексудатами і геморагіями, набряк зорового нерва. Такий же підхід рекомендується і для підтвердження діагнозу АГ.
Практичні рекомендації щодо проведення фундоскопії звучать досить обережно:
— Дослідження сітківки доцільно у хворих з тяжко контрольованою або резистентною АГ, для виявлення крововиливів, ексудатів і набряку сосків зорового нерва, які супроводжуються підвищенням серцево-судинного ризику (IIa С).
— Дослідження сітківки не рекомендується хворим з м’якою і помірною АГ, які не страждають від діабету, за винятком молодих пацієнтів (III С).
Досить широко застосовується практика в Україні, коли всіх пацієнтів з АГ, особливо в стаціонарах, направляють на консультацію до окуліста для ретиноскопії. Існує недостатньо доказів, щоб рекомендувати звичайну офтальмоскопічну консультацію для всіх пацієнтів з АГ [5, 23].
Лікування ГР у рутинній практиці передбачає тільки одне — контроль АГ. Антигіпертензивне лікування призводить до зменшення ознак ГР, наприклад артеріолярного звуження та розрідження [46]. При цьому допускається, що поліпшення мікросудинної структури може сприяти позитивному ефекту антигіпертензивного лікування.
Слід зазначити, що деякі дослідники робили спроби лікування тяжких форм ГР за допомогою бевацизумабу. Однак таке лікування не можна вважати загальновизнаним, воно продовжує обговорюватися [47].
Прогноз. У більшості пацієнтів ГР не викликає втрати зору до тих пір, поки адекватно контролюється АГ. Однак у тих пацієнтів, які не лікуються, це може призвести до втрати зору протягом короткого часу. Причиною втрати зору є або пігментні зміни сітківки, або вторинна атрофія зорового нерва, кожна з яких необоротна [48].
Висновки. Таким чином, виявлення ознак ГР залишається визнаним проявом УООГ. Найбільш часті причини ретинопатії — діабет, АГ, проте вона нерідко виявляється й у відносно здорових осіб. Нерідко ретинопатію розглядають як прояв атеросклерозу, що свідчить про підвищений серцево-судинний ризик. Ретинопатія досить поширена в популяції. При АГ виявляється від 33 % пацієнтів на початкових стадіях захворювання до 76 % зі збільшенням тривалості і ступеня АГ.
Поширена класифікація ГР Keith, Wagener і Baker піддається критиці, проте продовжує застосовуватися. Для клініцистів важливо, щоб у висновку офтальмолога відбивалася стадія ГР. Рутинна пряма ретиноскопія визнається недостатньо точним методом дослідження очного дна, наполегливо рекомендується застосовувати сучасні інструментальні методи дослідження.
Визнано, що ГР є найбільш поширеним УООГ і виявляється вже на ранніх стадіях захворювання. Наявна на сьогодні доказова база свідчить про помірний зв’язок початкових стадій ретинопатії з УООГ при АГ; такий зв’язок з’являється при помірній ГР і виражений — за злоякісної АГ. Визнано, що прогностичне значення ГР 1–2-ї стадії мінімально, і тому рутинна фундоскопія не рекомендується хворим з м’якою і помірною АГ, які не страждають від діабету, за винятком молодих пацієнтів. Фундоскопія є обов’язковою у хворих з тяжко контрольованою або резистентною АГ, за високої варіабельності АТ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів у роботу над статтею: концепція та дизайн роботи — М.Я. Доценко; збір матеріалу — І.О. Шехунова, Л.В. Герасименко; написання тексту — М.Я. Доценко, С.С. Боєв; редагування тексту — О.В. Молодан, О.Я. Малиновська.
Отримано/Received 26.04.2021
Рецензовано/Revised 06.05.2021
Прийнято до друку/Accepted 13.05.2021
Список литературы
1. Breslin D.J., Gifford R.W., Fairbairn J.F., Kearns T.P. Prognostic im portance of ophthalmoscopic findings in essential hypertension. JAMA. 1966. № 195. Р. 335-338.
2. Gunn R.M. Ophthalmoscopic evidence of (1) arterial changes associated with chronic renal diseases and (2) of increased arterial tension. Trans. Ophthalmol. Soc. U. K. 1992. Vol. 12. P. 124-125.
3. Сіренко Ю.М., Міщенко Л.А., Єна Л.М. та ін. Класифікація та стандарти надання медичної допомоги хворим на артеріальну гіпертензію Асоціації кардіологів України. Проект. Артериальная гипертензия. 2018. № 4(60). С. 32-53. doi: http://dx.doi.org/10.22141/2224-1485.4.60.2018.141955.
4. Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur. Heart J. 2018. Vol. 39(33). P. 3021-3104. doi: 10.1093/eurheartj/ehy339.
5. Lehmann M.V. Remodeling of Retinal Small Arteries in Hypertension. American Journal of Hypertension. 2011. Vol. 24(12). P. 1267-1273. doi.org/10.1038/ajh.2011.166.
6. Jeganathan S.V.E., Cheung N., Tayan T., Wang J.J., Mitchell P., Wong T.Y. Prevalence and Risk Factors of Retinopathy in an Asian Population Without Diabetes The Singapore Malay Eye Study. Arch. Ophthalmol. 2010. № 128(1). Р. 40-45. doi: 10.1001/archophthalmol.2009.330.
7. Hirai F., Moss S.E., Knudtson M.D., Klein B.E.K., Klein R. Retinopathy and Survival in a Population with out Diabetes:The Beaver Dam Eye Study. American Journal of Epidemiology. 2007. Vol. 166(6). P. 724-730. https://doi.org/10.1093/aje/kwm126.
8. Klein R., Klein B.E.K., Moss S.E., Wong T.Y. The relationship of retinopathy in persons without diabetes to the 15-year incidence of diabetes and hypertension: beaver dam eye study. Trans. Am. Ophthalmol. Soc. 2006. № 104. Р. 98-107.
9. Gunnlaugsdottir E., Halldorsdottir S., Klein R. et al. Retinopathy in old persons with and without diabetes mellitus: the Age, Gene/Environment Susceptibility-Reykjavik Study (AGES-R). Diabetologia. 2012. Vol. 55(3). Р. 671-680. doi: 10.1007/s00125-011-2395-y.
10. Ojaimi E., Nguyen Th.T., Klein R. et al. Retinopathy Signs in People with out Diabetes. The Multi-Ethnic Study of Atherosclerosis. Ophthalmology. 2011. Vol. 118(4). P. 656-662. DOI: https://doi.org/10.1016/j.ophtha.2010.08.007.
11. Kolman S.A.M., van Sijl A.M., van der Sluijs F.A., van de Ree M.A. Consideration of hypertensive retinopathy as an important end-organ damage in patients with hypertension. J. Hum. Hypertens. 2017. № 31(2). Р. 121-125. DOI: 10.1038/jhh.2016.49.
12. Chen X., Meng Y., Li J. et al. Serum uric acid concentration is associated with hypertensive retinopathy in hypertensive chinese adults. BMC Ophthalmology. 2017. Vol. 17. P. 83. doi.org/10.1186/s12886-017-0470.
13. Del Brutto O.H., Mera R.M., Viteri E.M. et al. Hypertensive retinopathy and cerebral small vessel disease in Amerindians living in rural Ecuador: The Atahualpa Project. Int. J. Cardiol. 2016. № 218. P. 65-68. doi: 10.1016/j.ijcard.2016.05.020.
14. Erden S., Bicakci E. Hypertensive Retinopathy: Incidence, Risk Factors, and Comorbidities. Clinical and Experimental Hypertension. 2012. Vol. 34(6). P. 397-401. doi.org/10.3109/10641963.2012.663028.
15. Reichhart N., Haase N., Crespo-Garcia S. et al. Hypertensive retinopathy in a transgenic angiotensin-based model. Clinical Science. 2016. № 130(13). Р. 1075-1088. DOI: 10.1042/CS20160092.
16. Fraser-Bell S., Symes R., Vaze A. Hypertensive eye di-sease: a review. Clin. Experiment. Ophthalmol. 2017. № 45(1). Р. 45-53. DOI: 10,1111/ceo.12905.
17. Qiao Y.-C., Pan Y.-H., Xu Y., Zhang X.-X., Zhao H.-L. Interaction of renin-angiotensin system gene polymorphisms with hypertension in Chinese patients with type 1 diabetes and retinopathy. Oncotarget. 2018. № 9. Р. 7582-7589. https://doi.org/10.18632/oncotarget.24100.
18. Konstantinidis L., Guex-Crosier Konstantinidis Y.L. Hypertension and the eye. Current Opinion in Ophthalmology. 2016. Vol. 27(6). Р. 514-521. doi: 10.1097/ICU.0000000000000307.
19. Zhang Y., Zhao L., Li H., Wang Y. Risk factors for hypertensive retinopathy in a Chinese population with hypertension: The Beijing Eye study. Exp. Ther. Med. 2019. № 17(1). Р. 453-458. doi: 10.3892/etm.2018.6967.
20. Pache M., Kube T., Wolf S., Kutschbach P. Do angiographic data support a detailed classification of hypertensive fundus changes? J. Hum. Hypertens. 2002. № 16. Р. 405-410. DOI: 10.1038/sj.jhh.1001402.
21. Курс лекцій з клінічної кардіології. За ред. В.Й. Целуйко. Х.: Гриф, 2004. 576 с.
22. Chatterjee S., Chattopadhyay S., Hope-Ross M., Lip P.L. Hypertension and the eye: changing perspectives. J. Hum. Hypertens. 2002. № 16. Р. 667-675. DOI: 10.1038/sj.jhh.1001472.
23. Wong T.Y., Mitchell P. Hypertensive retinopathy. N. Engl. J. Med. 2004. № 351. Р. 2310-2317. DOI: 10.1056/NEJMra032865.
24. Aissopou E.K., Papathanassiou M., Nasothimiou E.G. et al. The Keith-Wagener-Barker and Mitchell-Wong grading systems for hypertensive retinopathy:association with target organ damage in individuals below 55 years. Journal of Hypertension. 2015. Vol. 33(11). Р. 2303-2309. doi: 10.1097/HJH.0000000000000702.
25. Dimmitt S.B., West J.N., Eames S.M., Gibson J.M., Gosling P., Littler W.A. Usefulness of ophthalmoscopy in mild to moderate hypertension. Lancet. 1989. № 1. Р. 1103-1106. DOI: 10.1016/s0140-6736(89)92384-2.
26. Rizzoni D., Porteri E., Duse S. et al. Relationship between media-to-lumen ratio of subcutaneous small arteries and wall-to-lumen ratio of retinal arterioles evaluated noninvasively by scanning laser Doppler flowmetry. J. Hypertens. 2012. № 30. Р. 1169-1175. doi: 10.1097/HJH.0b013e328352f81d.
27. Lee H.M., Lee W.H., Kim K.N., Jo Y.J., Kim J.Y. Changes in thickness of central macula and retinal nerve fibre layer in severe hypertensive retinopathy: a 1-year longitudinal study. Acta Ophthalmologica. 2018. Vol. 96(3). Р. 386-392. https://doi.org/10.1111/aos.13521.
28. Perrone-Filardi P., Coca A., Galderisi M. et al. Noninvasive cardiovascular imaging for evaluating subclinical target organ damage in hypertensive patients: a consensus article from the European Association of Cardiovascular Imaging, the European Society of Cardiology Council on Hypertension and the European Society of Hypertension. J. Hypertens. 2017. № 35(9). Р. 1727-1741. doi: 10.1097/HJH.0000000000001396.
29. Struijker-Boudier H.A.J., Agabiti Rosei E. The microcirculation and the haemodynamics of hypertension. European Society of Hypertension Scientific Newsletter: Update on Hypertension Management. 2011. 12. № 34. Р. 67-68.
30. Chang C.-H., Tsai R.-K., Wu W. C., Kuo S.-L., Yu H.-S. Use of Dynamic Capillaroscopy for Studying Cutaneous Microcirculation in Patients with Diabetes Mellitus. Microvascular Research. 1996. Vol. 53(2). Р. 121-127. https://doi.org/10.1006/mvre.1996.2003.
31. Ushiyama O., Ushiyama K., Yamada T. et al. Retinal findings in systemic sclerosis:a comparison with nailfold capillaroscopic patterns. Ann. Rheum. Dis. 2003. № 62(3). Р. 204-207. https://doi.org/10.1136/ard.62.3.204.
32. Arend O., Rüffer M., Remky A. Macular circulation in patients with diabetes mellitus with and without arterial hypertension . Br. J. Ophthalmol. 2000. № 84. Р. 1392-1396. dx.doi.org/10.1136/bjo.84.12.1392.
33. Thomas C.H., Richey Sharrett A., Mosle T.H. et al. Gottesman Retinal Microvascular Abnormalities Predict Progression of Brain Microvascular Disease An Atherosclerosis Risk in Communities Magnetic Resonance Imaging Stud. Stroke. 2014. № 45. Р. 1012-1017. DOI: 10.1161/STROKEAHA.113.004166.
34. Wei W., Xia Z., Gao H. et al. Correlation of retinopathy with leukoaraiosis in patients with anterior circulation infarcts. Journal of Clinical Neuroscience. 2016. Vol. 33. Р. 105-110. doi.org/10.1016/j.jocn.2016.02.042.
35. Wong T.Y., Klein R., Sharrett A.R. et al. Retinal arteriolar diameters and risk for hypertension. Ann. Intern. Med. 2004. № 140. Р. 248-255. DOI: 10.7326/0003-4819-140-4-200402170-00006.
36. Varghese M., Srilakshmi M.A., Tinku T., Sunder M., Varghese K. The association of severity of retinal vascular changes and cardiac remodeling in systemic hypertension. Ther. Adv. Cardiovasc. Dis. 2016. Vol. 10(4). Р. 224-230. DOI: 10.1177/1753944716630869.
37. Triantafyllou A., Anyfanti P., Zabulis X. et al. Accumulation of microvascular target organ damage in newly diagnosed hypertensive patients. Journal of the American Society of Hypertension. 2014. Vol. 8(8). Р. 542-549. https://doi.org/10.1016/j.jash.2014.04.008.
38. Wong T.Y., McIntosh R. Hypertensive retinopathy signs as risk indicators of cardiovascular morbidity and mortality. Br. Med. Bull. 2005. № 73–74. Р. 57-70. DOI: 10.1093/bmb/ldh050.
39. Duartea T., Gonçalvesa S., Britob R. et al. Relationship between nocturnal blood pressure profiles and the presence and severity of hypertensive retinopathyRelação entre o perfil tensional noturno e a prevalência e gravidade da retinopatia hipertensiva. Revista Portuguesa de Cardiologia. 2018. Vol. 37(2). Р. 169-173. https://doi.org/10.1016/j.repc.2017.06.009.
40. Karadag B., Ozyigit T., Serindag Z., Ilhan A., Ozben B. Blood pressure profile is associated with microalbuminuria and retinopathy in hypertensive nondiabetic patients. Wien. Klin. Wochenschr. 2018. № 130(5–6). Р. 204-210. https://doi.org/10.1007/s00508-017-1270-3.
41. Боєв С.С., Доценко М.Я., Герасименко Л.В., Шехунова І.О. Актуальні аспекти варіабельності артеріального тиску при артеріальній гіпертензії. Артериальная гипертензия. 2018. № 2(58). С. 44-51. doi: http://dx.doi.org/10.22141/2224-1485.1.63.2019.162953.
42. Janisch B., Giezendanner S., K. Henny-Fullin et al. The relation of arterial hypertension and target organ damage in the swiss hypertension cohort study. Journal of Hypertension. 2017. Vol. 35. Р. 271. DOI: 10.1097/01.hjh.0000523786.70737.00.
43. Mancia G., Fagard R., Narkiewicz K. et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Hypertens. 2013. № 31(7). Р. 1281-357. doi: 10.1097/01.hjh.0000431740.32696.cc.
44. Roy P.K., Nguyen U.T., Bhuiyan A., Ramamohanarao K. An effective automated system for grading severity of retinal arteriovenous nicking in colour retinal images. Eng. Med. Biol. Soc. 2014. Р. 6324-6327. DOI: 10.1109/EMBC.2014.6945075.
45. Van den Born B.J., Hulsman C.A., Hoekstra J.B., Schlingemann R.O., van Montfrans G.A. Value of routine funduscopy in patients with hypertension: systematic review. BMJ. 2005. Vol. 331. Р. 73-76. DOI: 10.1136/bmj.331.7508.73.
46. Hughes A., Stanton A., Jabbar A., Chapman N., Martinez-Perez M.E., McG Thom S.A. Effect of antihypertensive treatment on retinal microvascular changes in hypertension. Journal of Hypertension. 2008. № 26(8). Р. 1703-1707. DOI: 10.1097/HJH.0b013e328304b072.
47. Tripathy K., Chaudhuri A. Comment on: Dramatic response to intravitreal bevacizumab in hypertensive retinopathy. Indian. J. Ophthalmol. 2019. Vol. 67(1). Р. 180. doi: 10.4103/ijo.IJO_1654_18.
48. Do D.V., Wang X., Vedula S.S. et al. Blood pressure control for diabetic retinopathy. Sao Paulo Medical Journal. 2015. № 133(3). Р. 278-279. http://dx.doi.org/10.1590/1516-3180.20151333T1.

/23.jpg)
/24.jpg)