Международный эндокринологический журнал Том 17, №4, 2021
Вернуться к номеру
Геометрія серця при клімактеричному синдромі на тлі цукрового діабету 1-го типу
Авторы: Гончарова О.А.
Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
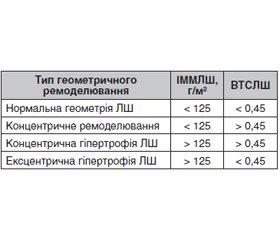
Актуальність. Клімактеричний період у жінок із цукровим діабетом 1-го типу (ЦД1) ініціює додатковий пошкоджуючий вплив на існуючу пов’язану з ЦД кардіальну патологію. Мета: встановити особливості геометричного ремоделювання лівого шлуночка серця в жінок із ЦД1 клімактеричного періоду. Матеріали та методи. Обстежені 60 жінок із ЦД1 віком 48,74 ± 0,65 року, у тому числі 41 — у перименопаузі та 19 — у постменопаузі. Контрольну групу становили 20 жінок без ЦД віком 50,02 ± 0,71 року. За даними ехокардіографії, з урахуванням стадії клімактерію, проаналізовані показники кінцевого діастолічного об’єму (КДО) і кінцевого діастолічного розміру (КДР), товщини задньої стінки лівого шлуночка (ТЗСЛШ) і міжшлуночкової перегородки (ТМШП). За формулою Penn Сonvention проаналізовано частоту різних типів геометричного ремоделювання лівого шлуночка (ЛШ) серця. Для цього за формулами розраховані: 1) індекс маси міокарда ЛШ (ІММЛШ): ІММЛШ = 1,04 • [(КДР + ТЗСЛШ + ТМШП)3 – КДР3] – 13,6 (ІММЛШ розраховували як співвідношення ММЛШ до площини поверхні тіла (А) у м2; Ам2 = 1 + вага + ∆h/100, де ∆h — різниця між ростом жінки та 160 см); 2) відносна товщина стінок ЛШ (ВТСЛШ): ВТСЛШ = 2 • ТЗСЛШ/КДР. За цими даними встановлено частоту різних типів геометричного ремоделювання: нормальна геометрія, концентричне ремоделювання, концентрична або ексцентрична гіпертрофія ЛШ. Результати. Отримані дані свідчать, що в жінок постменопаузального періоду вірогідно зменшується частота нормальної геометрії серця щодо жінок у перименопаузальному періоді (26,4 % проти 75,6 %, р < 0,001), збільшується в 3,5 раза частота концентричного ремоделювання ЛШ (26,3 % проти 7,3 % відповідно) і у 2,5 раза — частота концентричної та ексцентричної гіпертрофії (31,6 % проти 12,1 % та 12,7 % проти 4,9 % відповідно). Висновки. У жінок із цукровим діабетом 1-го типу вже в перименопаузальному періоді майже в чверті випадків відмічається геометричне ремоделювання лівого шлуночка серця. У постменопаузальному періоді на тлі естрогенного дефіциту частота патологічних форм геометрії серця перевищує 75 %. Стратегія терапії кардіальної патології в жінок менопаузального періоду, хворих на ЦД1, повинна враховувати патогенетичні механізми патології, пов’язані з порушенням вуглеводного обміну й атеросклеротичними змінами на тлі естрогенного дефіциту, і водночас обмежувати поліпрагмазію.
Background. The climacteric period in women with type 1 diabetes mellitus (DM1) initiates an additional damaging effect on the existing cardinal pathology associated with DM. The purpose was to establish the features of geometric remodeling of the left ventricle (LV) of the heart in women with DM1 during the climacteric period. Materials and methods. The study involved 60 women with type 1 diabetes at the age of 48.74 ± 0.65 years, including 41 perimenopausal and 19 postmenopausal ones. The control group consisted of 20 women without diabetes mellitus at the age of 50.02 ± 0.71 years. According to echocardiography, taking into account the stage of menopause, the indicators of the end-diastolic volume (EDV) and size (EDS), the posterior wall thickness of the LV (LVPWT) and the interventricular septum (IVST) were analyzed. The frequency of various types of geometric remodeling of the left ventricle of the heart was analyzed using the Penn Convention formula; for this, the LV myocardial mass index (LVMI) was calculated according to the formulas LVMI = 1.04 [(EDS + LVPWT + IVST)3 – EDS3] – 13.6 (LVMI = ratio LVMI to the plane of the body surface (A) in m2; AM2 = 1 + Weight + Δh / 100, where Δh is the difference between the height of a woman and 160 cm) and the relative wall thickness of the LV (LVRWT) LVRWT = 2LVPWT / EDS. Based on these data, the frequency of various types of geometric remodeling was established: normal geometry, concentric remodeling, concentric or eccentric LV hypertrophy. Results. The data obtained indicate that postmenopausal women present a significant decrease in the frequency of normal heart geometry compared to perimenopausal women (26.4 versus 75.6 %, p < 0.001) and the frequency of concentric LV remodeling 3.5 times increases (26.3 versus 7.3 %, respectively). Concentric hypertrophy and eccentric LV hypertrophy prevailed 2.5 times in postmenopausal women (31.6 versus 12.1 % and 12.7 versus 4.9 %). Conclusions. In perimenopausal women with type 1 diabetes mellitus, in almost a quarter of cases, geometric remodeling of the left ventricle of the heart takes place. In postmenopausal women with estrogen deficiency, the frequency of pathological forms of heart geometry exceeds 75 %. The strategy of therapy for cardiac pathology in menopausal women against the background of DM1 should take into account the pathogenetic mechanisms of pathology associated with impaired carbohydrate metabolism and atherogenic measurements against the background of estrogen deficiency as well as limit polypharmacy.
клімактеричний синдром; цукровий діабет 1-го типу; геометрія серця
climacteric syndrome; type 1 diabetes mellitus; heart geometry
Вступ
Матеріали та методи
/47.jpg)
Результати
Обговорення
Висновки
- Brand J.S., Onland-Moret N.C., Eijkemans M.J., Tjonneland A., Roswall N., Overvad K. et al. Diabetes and onset of natural menopause: results from the European Prospective Investigation into Cancer and Nutrition. Hum. Reprod. 2015. 30(6). 1491-1498. doi: 10.1093/humrep/dev054.
- Gottschalk M.S., Eskild A., Hofvind S., Gran J.M., Bjelland E.K. Temporal trends in age at menarche and age at menopause: a population study of 312 656 women in Norway. Human Reproduction. 2020. 35(2). 464-471. doi: 10.1093/humrep/dez288.
- Rawshani A., Sattar N., Franzén S., Rawshani A., Hattersley A.T., Svensson A.M., Eliasson B., Gudbjörnsdottir S. Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, register-based cohort study. Lancet. 2018. 392(10146). 477-486. doi: 10.1016/S0140-6736(18)31506-X.
- Serhiyenko V.O., Serhiyenko O.O. Diabetes mellitus and arterial hypertension. International Journal of Endocrinology (Ukraine). 2021. 17(2). 175-188. doi: 10.22141/2224-0721.17.2.2021.230573.
- Price M.A., Alvarado B.E., Rosendaal N.T.A., Câmara S.M.A., Pirkle C.M., Velez M.P. Early and surgical menopause associated with higher Framingham Risk Scores for cardiovascular disease in the Canadian Longitudinal Study on Aging. Menopause. 2021, Jan 4. 28(5). 484-490. doi: 10.1097/GME.0000000000001729.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. doi: 10.21856/j-PEP.2019.2.07.
- Chupin A.V., Katorkin S.E., Katelnitsky I.I., Katelnitskaya O.V., Prostov I.I., Petrikov A.S., Koshevoi A.P., Lyudkova L.F. Sulodexide in the Treatment of Chronic Venous Insufficiency: Results of the All-Russian Multicenter ACVEDUCT Program. Adv. Ther. 2020. 37(5). 2071-2082. doi: 10.1007/s12325-020-01270-9.
- Raffetto J.D., Calanni F., Mattana P., Khalil R.A. Sulodexide promotes arterial relaxation via endothelium-dependent nitric oxide-mediated pathway. Biochem. Pharmacol. 2019. 166. 347-356. doi: 10.1016/j.bcp.2019.04.021.
- Frati Munari A.C. Medical significance of endothelial glycocalyx. Part 2: Its role in vascular diseases and in diabetic complications. Arch. Cardiol. Mex. Apr. 2014. 84(2). 110-116.
- Bignamini A.A., Chebil A., Gambaro G. et al. Sulodexide for Diabetic-Induced Disabilities: A Systematic Review and Meta-Analysis. Adv. Ther. 2021. 38. 1483-1513. doi: 10.1007/s12325-021-01620-1.
- Liu Y.N., Zhou J., Li T., et al. Sulodexide protects renal tubular epithelial cells from oxidative stress-induced injury via upregulating klotho expression at an early stage of diabetic kidney disease. J. Diabetes Res. 2017. 2017. 10 p. Article ID 4989847. doi: 10.1155/2017/4989847.

/47_2.jpg)
/48.jpg)