Резюме
Актуальність. Останнім часом, в умовах появи нових різновидів патогенних вірусів, увагу привертає стан функціонування компонентів вродженого імунітету, що здатні знешкоджувати незнайомі мікроорганізми на ранніх етапах зараження. Тому дослідження порушень фагоцитозу у дітей з частими повторними інфекційними захворюваннями респіраторного тракту доповнить наукові дані щодо процесів вікового становлення протимікробного захисту. Мета дослідження: удосконалення діагностики порушень вродженого імунітету у дітей дошкільного віку з повторними інфекційними захворюваннями респіраторного тракту на підставі встановлення нових даних щодо параметрів фагоцитозу. Матеріали та методи. Під спостереженням знаходилося 60 дітей віком від 2 до 5 років, які були розподілені на 2 групи: 1-ша група — діти, які хворіють на гострі інфекційні захворювання респіраторного тракту понад 6 разів на рік (n = 30); 2-га група — діти, які хворіють на гострі інфекційні захворювання респіраторного тракту 6 разів і менше на рік (n = 30). Результати. Серед дітей, які хворіють на гострі респіраторні захворювання понад 6 разів на рік, статистично значимо збільшується частота реєстрації низьких показників фагоцитарного числа (на 60 %, р < 0,05), фагоцитарного індексу (на 56 %, р < 0,05), індексу завершеності фагоцитозу (на 70 %, р < 0,05), стимульованого стафілококом НСТ-тесту (на 50 %, р < 0,05) та високих показників спонтанного НСТ-тесту (на 43,3 %, р < 0,05), збільшеного вмісту у сироватці крові інтерлейкіну-1β (на 46,7 %, р < 0,05), інтерлейкіну-6 (на 43,3 %, р < 0,05), інтерлейкіну-10 (на 30 %, р < 0,05), фактора некрозу пухлини (на 46,7 %, р < 0,05). Висновки. У дітей 2–5 років, які хворіли на гострі респіраторні захворювання понад 6 разів на рік, має місце фагоцитарна дисфункція. Вона проявляється у зниженні поглинальних характеристик фагоцитозу та стимульованої метаболічної активності на тлі збільшення сироваткового вмісту про- й протизапальних цитокінів, тобто цитокіновим дисбалансом.
Background. Recently, with the emergence of new pathogenic viruses’ variants, attention is drawn to the functioning status of innate immunity components, which are able to neutralize unknown microorganisms at the early stages of infection. Therefore, the study of phagocytosis disorders in children with respiratory recurrent infectious diseases will supply the scientific data on the processes of age-dependent formation of antimicrobial protection. The purpose: to improve the diagnosis of innate immune disorders in preschool children with respiratory recurrent infectious on the background of new data on phagocytosis parameters. Materials and methods. Sixty children aged from 2 to 5 years were observed. Two groups were formed: 1) children with respiratory tract acute infectious more than 6 times per year (n = 30); 2) children with respiratory acute infectious 6 or fewer times per year (n = 30). Results. The children of group 1 presented with statistically significantly increased cases of low phagocytic counts (by 60.0 %, p < 0.05), phagocytic index (by 56.0 %, p < 0.05), index of phagocytosis completeness (70.0 %, p < 0.05), neutrophil phagocytic activity stimulated by Staphylococcus (50.0 %, p < 0.05) and high rates of spontaneous neutrophil phagocytic activity (43.3 %, p < 0.05), increased serum level of interleukin-1β (46.7 %, p < 0 05), interleukin-6 (43.3 %, p < 0.05), interleukin-10 (by 30.0 %, p < 0.05), TNF (by 46.7 %, p < 0.05). Conclusions. In children aged 2–5 years with respiratory acute infectious diseases more than 6 times per year, phagocytic dysfunction was established. It is manifested itself in a decrease of phagocytosis absorption and stimulated metabolic activity on the background of increased pro- and anti-inflammatory cytokines serum level, ie cytokine imbalance.
Вступ
Первинна зустріч імунної системи дитини з будь-яким мікроорганізмом завжди активує системи вродженого імунітету, що повинні швидко локалізувати та елімінувати «чужорідну істоту», паралельно створюючи умови для формування імунологічної пам’яті, тобто функціонування набутого, адаптивного захисту, який є найбільш специфічним та ефективним [1].
У перші роки життя дитини дані процеси відбуваються постійно, але, за умов вікової фізіологічної недостатності імунологічної пам’яті, головну роль у видаленні патогенів відіграють ранні захисні механізми, зокрема фагоцитоз із залученням мікро- та макрофагальних клітин [2], які повинні компенсувати тимчасову незрілість адаптивних реакцій [3] та сприяти їх своєчасному повноцінному становленню із залученням лімфоцитарних клітин пам’яті. Це яскраво проявляється в існуванні фізіологічних кількісних змін імунних клітин у крові — нейтрофільних гранулоцитів і лімфоцитів, так званого вікового лейкоцитарного перехресту. Але нейтропенія, що розпочинається на 5-ту добу життя дитини та триває до 5 років, з одного боку, допомагає компенсаторно збільшити напрацювання лімфоцитів для формування адаптивного імунітету [4], а з іншого — є причиною більш частої захворюваності дітей раннього віку на інфекційну патологію різної тяжкості.
У процесі збільшення кількості контактів дитини з факторами навколишнього середовища фізіологічна транзиторна нездатність імунної системи зростаючого організму забезпечувати механізми імунного виключення і очищення на тлі відсутності повноцінної імунологічної пам’яті нерідко призводить до частих гострих респіраторних захворювань (ГРЗ) з тяжким перебігом і формуванням ускладнень [5]. У цих умовах важливо розуміти, які компоненти фагоцитарних механізмів є недостатніми у дітей, які часто хворіють, та яка їх корекція може бути ефективною та безпечною.
Саме тому дослідження порушень фагоцитозу у дітей з частими повторними інфекційними захворюваннями респіраторного тракту допоможе більшому розумінню процесів вікового становлення протиінфекційного захисту у дітей.
Мета дослідження: удосконалення діагностики порушень вродженого імунітету у дітей дошкільного віку з повторними інфекційними захворюваннями респіраторного тракту на підставі встановлення нових даних щодо параметрів фагоцитозу.
Матеріали та методи
Під спостереженням знаходилося 60 дітей віком від 2 до 5 років, які були розподілені на 2 групи: 1-ша група — діти, які хворіють на гострі інфекційні захворювання респіраторного тракту понад 6 разів на рік (n = 30); 2-га група — діти, які хворіють на гострі інфекційні захворювання респіраторного тракту 6 разів та менше на рік (n = 30).
Визначення частих повторних респіраторних інфекцій у дітей базувалося на таких міжнародних критеріях: 1) понад 6 епізодів інфекцій дихальних шляхів протягом 1 року; 2) більше 1 епізоду інфекції верхніх дихальних шляхів на місяць у період з вересня по квітень; 3) понад 3 епізоди інфекції нижніх дихальних шляхів протягом 1 року [6].
Критерії включення: підписання інформованої згоди батьками; діти обох статей віком від 2 до 5 років включно; відсутність потреби в призначенні системної антибіотикотерапії, а також відсутність антибіотикотерапії протягом 14 попередніх включенню у дослідження днів; відсутність терапії імуномодулюючими препаратами, такими як препарати інтерферону та його індуктори, внутрішньовенні імуноглобуліни, свіжозаморожена плазма протягом 14 попередніх включенню у дослідження днів; відсутність терапії противірусними препаратами (наприклад, синтетичні аналоги пуринових нуклеозидів і т.п.) протягом 14 попередніх включенню днів; відсутність потреби в системному призначенні глюкокортикостероїдів, відсутність системної планової терапії глюкокортикостероїдами і цитостатиками протягом 14 попередніх включенню днів; відсутність показань до призначення інших лікарських засобів з імуномодулюючою та/або противірусною дією.
Критерії виключення: наявність гострого періоду або ускладнень ГРЗ на момент включення в дослідження; встановлений або підозрюваний діагноз первинного імунодефіциту; наявність тяжкого органічного захворювання центральної або периферичної нервової системи, що обмежує, на думку дослідника, участь в дослідженні; наявність соматичних захворювань в стадії декомпенсації; проведення вакцинації менш ніж за 21 день до скринінг-візиту; будь-які документально підтверджені автоімунні захворювання незалежно від фази процесу; злоякісні новоутворення будь-якої локалізації; встановлений діагноз туберкульозу будь-якої локалізації; наявність будь-яких супутніх захворювань, які, на думку дослідника, можуть вплинути на оцінку результатів; одночасна участь пацієнта в інших клінічних дослідженнях.
Діти в групах спостереження були зіставлені за віком, статтю, тривалістю та тяжкістю хвороби, супутньою патологією. Клінічний метод складався з оцінки анамнезу, фенотипової характеристики дитини, загальноклінічних методів обстеження.
Кров для дослідження стану імунної системи брали з кубітальної вени вранці натще. Обстеження проводилось у міській лабораторії клінічної імунології КНП «Міська дитяча лікарня № 1» Запорізької міської ради (свідоцтво про атестацію № 004313 від 21.08.2015). Вивчення показників фагоцитозу здійснювалося методом відновлення нітросинього тетразолію (НСТ-тест) — спонтанного та стимульованого (антигеном Staphylococcus), розрахунком фагоцитарного числа, індексу завершеності фагоцитозу. Референтні показники визначалися за сертифікованими нормативами лабораторії, де проводилися дослідження, та викладені у локальних протоколах з імунодіагностики у дітей КНП «Міська дитяча лікарня № 1» Запорізької міської ради.
Кількісне визначення концентрації інтерлейкіну-1β, -6, -10 та фактора некрозу пухлини (ФНП) в сироватці крові проводилося методом імуноферментного аналізу на фотометрі-аналізаторі «Humareader SINGLE» (Німеччина).
Для статистичної обробки отриманих результатів використовувався кутовий критерій Фішера ϕ (для зіставлення двох вибірок за частотою виявлення відхилень показників фагоцитозу).
Для оцінки відношення ймовірності того, що збільшення частоти захворюваності на ГРЗ залежить від наявності відхилень показників фагоцитозу від нормативних значень, використовувався розрахунок показника відношення шансів (ВШ). При оцінці враховувалося, що значення ВШ від 0 до 1 відповідало зниженню ймовірності, більше 1 — підвищенню ймовірності, ВШ = 1 означало відсутність відмінностей.
Дослідження було проведено відповідно до етичних принципів медичного дослідження, проведеного на людях, що були прийняті Гельсінською декларацією і Належною клінічною практикою (GCP).
Результати
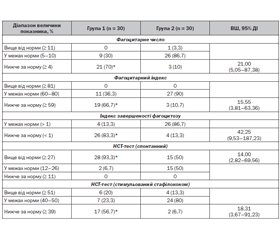
Для оцінки частоти виникнення відхилень параметрів фагоцитозу в сироватці крові було встановлено кількість дітей, у яких вони реєструвалися. Дані наведені в табл. 1.
Наведені в табл. 1 дані щодо частоти виникнення відхилень параметрів фагоцитозу демонструють, що серед дітей, які хворіють на ГРЗ понад 6 разів на рік, статистично значимо збільшується частота реєстрації низьких показників фагоцитарного числа (на 60 %, р < 0,05), фагоцитарного індексу (на 56 %, р < 0,05), індексу завершеності фагоцитозу (на 70 %, р < 0,05), стимульованого стафілококом НСТ-тесту (на 50 %, р < 0,05) та високих показників спонтанного НСТ-тесту (на 43,3 %, р < 0,05). Отримані результати продемонстрували існування високої ймовірності (відношення шансів) того, що збільшення частоти захворюваності на ГРЗ асоційоване з наявністю відхилень показників фагоцитозу від референтних значень.
Результати дослідження рівня цитокінів, що синтезуються макро- та мікрофагоцитарними клітинами, у дітей груп спостереження наведені у табл. 2.
Дані, наведені у табл. 2, вказують, що серед дітей, які хворіють на ГРЗ понад 6 разів на рік, статистично значимо збільшується частота реєстрації високих показників вмісту у сироватці крові інтерлейкіну-1β (на 46,7 %, р < 0,05), інтерлейкіну-6 (на 43,3 %, р < 0,05), інтерлейкіну-10 (на 30 %, р < 0,05), ФНП (на 46,7 %, р < 0,05). Було встановлено існування високої ймовірності (відношення шансів) того, що збільшення частоти захворюваності на ГРЗ у дітей асоційоване з наявністю збільшення сироваткового вмісту досліджуваних цитокінів від референтних значень.
Обговорення
Останнім часом, в умовах появи нових різновидів патогенних вірусів, велику увагу привертає стан функціонування компонентів вродженого імунітету, тобто того захисту, який здатний чинити опір ще незнайомим представникам мікробного світу на ранніх етапах зараження [7].
Але слід враховувати, що для дітей перших років життя переважна більшість «старих знайомих» мікроорганізмів є новими та невідомими. Це потребує чіткої та злагодженої роботи всіх ланок вродженого імунного захисту, особливо фагоцитозу, який здатний не тільки локалізувати та знешкодити патоген, а й видалити його, з одночасним цитокіновим забезпеченням запуску процесів формування адаптивного імунітету та майбутньої імунологічної пам’яті [8]. Саме тому дослідження та порівняння поглинальної, метаболічної та цитокінсинтетичної функції фагоцитуючих клітин у дітей залежно від частоти захворюваності на респіраторні інфекції було важливим та актуальним.
У процесі роботи було виявлено, що у дітей віком від 2 до 5 років, які хворіють на ГРЗ понад 6 разів на рік, мали місце три особливості вродженого імунного захисту: 1) зниження поглинальних характеристик фагоцитозу (фагоцитарного числа, фагоцитарного індексу, індексу завершеності фагоцитозу) та стимульованої метаболічної активності; 2) підвищення спонтанної метаболічної активності (НСТ-тест) та 3) збільшення цитокініндукуючої спроможності (інтерлейкіну-1β, -6, -10 та ФНП).
Зменшення показників поглинальної здатності фагоцитуючих клітин, імовірно, призводило до більш легкої фіксації патогенних мікроорганізмів на слизових оболонках дитини з подальшим розвитком інфекційного запального процесу. Це є однією з суттєвих причин рекурентних інфекційних захворювань у дітей [9] й обумовлювало збільшення частоти захворюваності на ГРЗ 1-ї групи спостереження.
При цьому реєструвалося підвищення спонтанної метаболічної активності мікрофагів (НСТ-тест) як прояв патологічної компенсації недостатності поглинальних характеристик. Такий ефект був здатний призводити до локального хімічного пошкодження тканин місця фіксації збудника та клітин мікрооточення [10], що могло додатково знижувати захисний потенціал уражених слизових оболонок.
Негативним був факт того, що у разі стимуляції нейтрофільних гранулоцитів стафілококом показники НСТ-тесту не зростали. Не можна виключити те, що вони були виснажені тривалою підтримкою високого спонтанного рівня, що могло стати передумовою для більш легкої бактеріальної колонізації, тобто формування бактеріальних ускладнень та більш тривалого перебігу ГРЗ [11].
У таких умовах ще одним компенсаторним елементом протимікробного захисту у дітей 2–5 років, які хворіли на ГРЗ понад 6 разів на рік, було збільшення вмісту у сироватці крові цитокінів, причому як прозапальних — інтерлейкіну-1β, -6 та ФНП, так і протизапального інтерлейкіну-10. Такий дисбаланс свідчить про те, що неспроможна до ранньої та швидкої ерадикації патогенів фагоцитарна система намагається максимально залучити до захисного процесу лімфоцитарні клітини, тобто прискорити активацію елементів адаптивного імунітету. Таку ж тенденцію відмічали J.R. Grunwell et al. (2019) у дітей, у яких спостерігалась висока кількість нейтрофілів у слизовій дихальних шляхів. Ці нейтрофіли мали високозапальний фенотип, підвищені маркери активації/дегрануляції нейтрофілів та більший ступінь вивільнення цитокінів і хемокінів у вогнищах запалення [12]. Таке збільшення сироваткової концентрації цитокінів, можливо, було необхідно для активації лімфоцитів, залучених до становлення адекватного адаптивного захисту.
Але, враховуючи той факт, що безпосередньо самі цитокіни — фактор некрозу пухлини, інтерлейкіни-1β, -6, -10 — контролюють функцію макрофагів із здатністю фагоцитувати мікроорганізми [13], встановлене збільшення вмісту могло бути проявом своєрідної авторегуляції, спрямованої на посилення зниженої поглинальної спроможності самих фагоцитарних клітин. Не виключено, що має місце й поєднання обох ефектів виявленого посилення цитокінового синтезу. Тобто генез виявленої особливості є дискусійним і потребує подальших досліджень.
Висновки
Таким чином, дослідженням встановлено, що у дітей 2–5 років, які хворіли на ГРЗ понад 6 разів на рік, має місце фагоцитарна дисфункція. Вона проявляється у зниженні поглинальних характеристик фагоцитозу та стимульованої метаболічної активності на тлі підвищення спонтанної метаболічної активності з компенсаторним збільшенням синтезу як про-, так і протизапальних цитокінів, тобто цитокіновим дисбалансом. Такі особливості характеризують недостатність і повільність ранньої імунної відповіді, яка навіть зі збереженням певних компенсаторних можливостей не здатна повноцінно локалізувати інфекційний процес, що проявляється у дітей у вигляді частої захворюваності на ГРЗ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Дослідження не має окремого додаткового фінансування та проведено в рамках науково-дослідної роботи кафедри педіатрії та неонатології Державного закладу «Запорізька медична академія післядипломної освіти МОЗ України» «Клінічні та імунно-ендокринні особливості формування й перебігу запальних захворювань органів дихання у дітей з дисбалансом центральних та автономних механізмів нейрогенної регуляції» (№ державної реєстрації 0117U004385).
Отримано/Received 20.06.2021
Рецензовано/Revised 05.07.2021
Прийнято до друку/Accepted 18.07.2021

/11.jpg)
/12.jpg)