Журнал «Медицина неотложных состояний» Том 17, №5, 2021
Вернуться к номеру
Аналіз впливу комбінації дексмедетомідину з регіонарною анестезією на когнітивний стан у постнаркозному періоді в офтальмохірургії
Авторы: Дорофєєва Г.С.
КП «Дніпропетровська обласна клінічна офтальмологічна лікарня», м. Дніпро, Україна
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
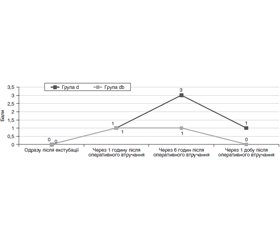
Актуальність. Враховуючи знижений початковий когнітивний резерв у пацієнтів в офтальмохірургії, лікарю-анестезіологу потрібно звернути особливу увагу при виборі методу анестезії на запобігання розвитку післяопераційних когнітивних дисфункцій (ПОКД). Концепція мультимодального знеболювання дає змогу знизити загальну кількість використаних під час оперативного втручання наркотичних анальгетиків та атарактиків зі збереженням адекватного рівня анестезії та седації як інтраопераційно, так і в післяопераційному періоді. В офтальмохірургії використовується регіонарна анестезія (блокада крилопіднебінної ямки) в поєднанні з інфузією дексмедетомідину до оперативного втручання. Матеріали та методи. Дослідження проведено на базі КП «Дніпропетровська обласна клінічна офтальмологічна лікарня», обстежено 61 пацієнт після операції з наскрізної кератопластики. Вік обстежених коливався від 18 до 60 років (середній вік — 52,1 ± 2,0 року). Пацієнти були рандомізовані на дві групи. Група d (n = 30) — це пацієнти, яким анестезіологічне забезпечення було виконано за такою схемою: премедикація за 40 хв — інфузійно дексмедетомідин, ондансетрон 4 мг, дексаметазон 4 мг, кеторолак 30 мг внутрішньовенно; індукція — пропофол 2–2,5 мг/кг фракційно до досягнення клінічних симптомів наркозу, фентаніл 0,005% 0,1 мг; релаксації на тлі атракурію безилату 0,3–0,6 мг/кг, інтубація трахеї; підтримка анестезії — киснево-севофлуранова суміш FiO2 50–55 %, севофлуран 1,4–1,8 об.% на видиху (1–1,5 МАС), використання методики низьких потоків. У другій групі (db, n = 31) анестезіологічне забезпечення було виконано, як і в групі d, з додаванням блокади крилопіднебінної ямки. У групі d було 18 (60 %) чоловіків і 12 (40 %) жінок, середній вік — 49,5 ± 2,5 року; у групі db — 16 (51,6 %) чоловіків і 15 (48,38 %) жінок (р = 0,583 за критерієм χ2), середній вік — 55,5 ± 3,2 року (р = 0,142 за t-критерієм). Результати. При проведенні порівняльного аналізу змін когнітивного стану між групами db та d за шкалою оцінки психічного статусу (MMSE) та за краткою шкалою оцінювання лобної дисфункції (FAB) отримали результат без суттєвих відмінностей (p < 0,05) на різних етапах нейропсихологічного тестування. При розгляді результатів тестування для оцінювання короткострокової вербальної пам’яті в групах db та d відмічається зниження показників на 25 % в перші 6 годин після оперативного втручання. У групі d показники залишалися зниженими порівняно з вихідним рівнем до 7-ї доби післяопераційного періоду. У той час як у групі db відновлення показників короткострокової пам’яті відбулося через 1 добу після перенесеного оперативного втручання. В обох групах результат тесту Лурія на 21-шу добу перевищив вихідний рівень на 12,5 %. При оцінюванні за візуально-аналоговою шкалою пацієнти групи db почували себе краще, ніж в групі d. Висновки. Таким чином, бачимо, що поєднання дексмедетомідину з регіонарним знеболюванням, окрім меншого впливу на когнітивний стан пацієнтів, покращує суб’єктивне самопочуття в післяопераційному періоді у пацієнтів в офтальмохірургії, завдяки чому утворюється ще одна ланка впливу на етіологічні фактори формування ПОКД.
Given a reduced cognitive reserve in patients in ophthalmic surgery, an anesthesiologist should pay special attention when choosing a method of anesthesia to prevent the development of postoperative cognitive dysfunction. The concept of multimodal anesthesia makes it possible to reduce the total number of narcotic analgesics and ataractics used intraoperatively while maintaining an adequate level of anesthesia and sedation, both intraoperatively and in the postoperative period. In ophthalmic surgery, regional anesthesia (pterygopalatine fossa blockade) is used before surgery in combination with infusion of dexmedetomidine. Materials and methods. The study was conducted at the premises of Dnipropetrovsk Regional Clinical Ophthalmologic Hospital, 61 patients were examined after penetrating keratoplasty. The age of the subjects ranged from 18 to 60 years (mean age of 52.1 ± 2.0 years). Patients were randomized into two groups. Group d (n = 30) are patients who received anesthesia according to the following scheme: premedication for 40 min — infusion of dexmedetomidine, ondansetron 4 mg, dexamethasone 4 mg, ketorolac 30 mg intravenously; induction — propofol 2–2.5 mg/kg fractionally until the onset of the clinical signs of anesthesia, fentanyl 0.005% 0.1 mg; relaxation on the background of atracurium besylate 0.3–0.6 mg/kg, tracheal intubation; maintenance of anesthesia: oxygen — sevoflurane mixture with FiO2 50–55 %, end-expired sevoflurane 1.4–1.8 vol.% (1–1.5 minimum alveolar concentration), use of low-flow technique. In the second group (db, n = 31), anesthesia was performed as in group d with the addition of pterygopalatine fossa blockade. Group d included 18 (60 %) men and 12 (40 %) women, mean age of 49.5 ± 2.5 years; db group — 16 (51.61 %) men and 15 (48.39 %) women (p = 0.583 according to the chi-square), mean age of 55.5 ± 3.2 years (p = 0.142 according to the t-test). Results. A comparative analysis of changes in cognitive status between db and d groups has shown no significant changes (p < 0.05) at different stages of neuropsychological testing. When considering the results of testing to assess short-term verbal memory in db and d groups, there was a 25 % decrease in the first 6 hours after surgery. After all, in d group, the indicators remained low compared to baseline until the 7th day of the postoperative period, while in the db group the recovery of short-term memory occurred one day after surgery. In both groups, the result of the Luria test on day 21 exceeded the baseline by 12.5 % in both groups. Examination using visual analogue scale has demonstrated that patients in db group felt better than those in d group. Conclusions. Thus, we see that the combination of dexmedetomidine with regional anesthesia in addition to less impact on the cognitive state improves the subjective well-being in the postoperative period in patients in ophthalmic surgery. Due to this, another link of influence on the etiological factors of postoperative cognitive dysfunction formation seems to appear.
післяопераційна когнітивна дисфункція; дексмедетомідин; MMSE; FAB; блокада крилопіднебінної ямки
postoperative cognitive dysfunction; dexmedetomidine; Mini-Mental State Examination; Frontal Assessment Battery; pterygopalatine fossa blockade
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Новицкая-Усенко Л.В., Криштафор А.А., Тютюнник А.Г. Послеоперационные когнитивные расстройства как осложнение общей анестезии. Значение ранней фармакологической нейропротекции. Медицина неотложных состояний. 2017. 2(65). 24-31.
- Новицкая-Усенко Л.В. Послеоперационная когнитивная дисфункция в практике врача анестезиолога. Медицина неотложных состояний. 2017. 4(83).
- Шнайдер Н.А., Шпрах В.В., Салмина А.Б. Послеоперационная когнитивная дисфункция (диагностика, профилактика, лечение). Методическое пособие для врачей. Красноярск, 2005. 95 с.
- Ray T., Tobias J.D. Dexmedetomidine for sedation during electroencephalographic analysis in children with autism, pervasive developmental disorders, and seizure disorders. J. Clin. Anesth. 2008 Aug. 20(5). 364-368.
- Hu J., Vacas S., Feng X., Lutrin D., Uchida Y., Lai I.K., Maze M. Dexmedetomidine Prevents Cognitive Decline by Enhancing Resolution of High Mobility Group Box 1 Protein-induced Inflammation through a Vagomimetic Action in Mice. Anesthesiology. 2018 May. 128(5). 921-931.
- Овезов А.М., Пантелеева М.В., Князев А.В. и др. Когнитивная дисфункция и общая анестезия: от патогенеза к профилактике и коррекции. Неврология, нейропсихиатрия, психосоматика. 2016. 8(3). 101-105.
- Онегин М.А., Махлай А.В., Теплякова А.Н., Липин И.Е., Пасечник И.Н., Губайдуллин Р.Р. Комплексный нейромониторинг как фактор минимизации потерь времени при проведении анестезиологического пособия. Материалы XIV сессии МНОАР. М., 2013. С. 34.
- Щуко А.Г., Юрьева Т.Н., Олещенко И.Г. Роль крылонебной блокады в программе ранней реабилитации детей после хирургии врожденной катаракты. Офтальмологические ведомости. 2017. 10(4). 18-23. doi: 10.17816/OV10418-23.
- Ayvardgi A.A., Kobeliatskyy Yu.Yu. ANI-monitoring in assessing the effectiveness of the anesthetic management for plastic surgery of the nose. Emergency medicine. 2018. 1(88). 103-107. DOI: https://doi.org/10.22141/2224-0586.1.88.2018.124975.
- Криштафор А.А., Йовенко И.А., Черненко В.Г., Клименко К.А., Криштафор Д.А. Особенности когнитивных нарушений при ранениях, полученных в условиях боевых действий. Медицина неотложных состояний. 2018. 2(81). http://dx.doi.org/10.22141/2224-0586.2.81.2017.99701.
- Антомонов М.Ю. Математическая обработка и анализ медико-биологических данных. К., 2017. 578 с.

/87.jpg)
/88.jpg)