Международный эндокринологический журнал Том 17, №5, 2021
Вернуться к номеру
Фактор роста фибробластов 23 и белок Klotho: оценка роли в формировании вторичного гиперпаратиреоза у пациентов с различными стадиями снижения функции почек
Авторы: Карлович Н.В., Мохорт Т.В.
Белорусский государственный медицинский университет, г. Минск, Республика Беларусь
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Вторинний гіперпаратиреоз (ВГПТ) — універсальне ускладнення хронічної хвороби нирок (ХХН), імовірність розвитку якого зростає в міру зниження ниркової функції. В даний час ВГПТ розглядається в контексті мінеральних і кісткових порушень, асоційованих із ХХН (МКП-ХХН). МКП-ХХН містять, крім ВГПТ, порушення фосфорно-кальцієвого обміну, кісткову патологію і метастатичну кальцифікацію, які визначають несприятливі наслідки захворювання. Мета дослідження — оцінити сироваткові концентрації FGF-23 і Klotho в пацієнтів із різними стадіями ХХН і їх взаємозв’язок із ВГПТ, рівнем вітаміну D і показниками фосфорно-кальцієвого обміну в пацієнтів із різним ступенем зниження функції нирок. Матеріали та методи. У 229 пацієнтів із різними стадіями хронічної хвороби нирок і 40 осіб без ознак ХХН оцінені сироваткові концентрації: FGF-23, білка Кlotho, ПТГ, 25(ОН)D, кальцію і фосфору. Результати. Для пацієнтів із ХХН характерні гіперпродукція гуморального фосфатоніна FGF-23 і дефіцит білка Klotho, які зростають у міру збільшення ниркової недостатності. Встановлено значущий взаємозв’язок FGF-23 з рівнями ПТГ і фосфору крові; білка Klotho — з віком пацієнта і сироватковим рівнем вітаміну D. Раннім маркером порушень у системі FGF-23 — Klotho є зниження концентрації білка Klotho, що виникає на ранніх стадіях ХХН і посилюється при прогресуванні ниркової недостатності. Статистично значуща й асоційована зі вторинним гіперпаратиреозом гіперпродукція FGF-23 зареєстрована ув пацієнтів зі швидкістю клубочкової фільтрації (ШКФ) менше 35 мл/хв. Висновки. Раннім маркером порушень у системі FGF-23 — Klotho є зниження концентрації білка Klotho, що виникає на ранніх стадіях ХХН і посилюється при прогресуванні ниркової недостатності. Не встановлено взаємозв’язку дефіциту Klotho і формування ВГПТ. У міру зниження функції нирок виникає і зростає надлишкова продукція ПТГ і FGF-23, прогресує гіперфосфатемія. Це підтверджує патогенетичний взаємозв’язок формування ВГПТ з гіперпродукцією гуморального фосфатоніну FGF-23, оскільки саме цей рівень ШКФ визначає зростання ПТГ вище верхньої межі загальнопопуляційного референтного інтервалу.
Актуальность. Вторичный гиперпаратиреоз (ВГПТ) — универсальное осложнение хронической болезни почек (ХБП), вероятность развития которого нарастает по мере снижения почечной функции. В настоящее время ВГПТ рассматривается в контексте минеральных и костных нарушений, ассоциированных с ХБП (МКН-ХБП). МКН-ХБП включают, помимо ВГПТ, нарушения фосфорно-кальциевого обмена, костную патологию и метастатическую кальцификацию, которые определяют неблагоприятные исходы заболевания. Цель исследования — оценить сывороточные концентрации фактора роста фибробластов (FGF-23) и Klotho у пациентов с различными стадиями ХБП и их взаимосвязь с ВГПТ, уровнем витамина D и показателями фосфорно-кальциевого обмена у пациентов с различной степенью снижения функции почек. Материалы и методы. У 229 пациентов с различными стадиями хронической болезни почек и 40 человек без признаков ХБП оценены сывороточные концентрации: FGF-23, белка Кlotho, паратгормона (ПТГ), 25(ОН)D, кальция и фосфора. Результаты. Для пациентов с ХБП характерны гиперпродукция гуморального фосфатонина FGF-23 и дефицит белка Klotho, которые нарастают по мере усугубления почечной недостаточности. Установлена значимая взаимосвязь FGF-23 с уровнями ПТГ и фосфора крови; белка Klotho — с возрастом пациента и сывороточным уровнем витамина D. Ранним маркером нарушений в системе FGF-23 — Klotho является снижение концентрации белка Klotho, которое возникает на ранних стадиях ХБП и усугубляется при прогрессировании почечной недостаточности. Статистически значимая и ассоциированная со вторичным гиперпаратиреозом гиперпродукция FGF-23 зарегистрирована у пациентов со скоростью клубочковой фильтрации (СКФ) менее 35 мл/мин. Выводы. Ранним маркером нарушений в системе FGF-23 — Klotho является снижение концентрации белка Klotho, которое возникает на ранних стадиях ХБП и усугубляется при прогрессировании почечной недостаточности. Не установлено взаимосвязи дефицита Klotho и формирования ВГПТ. По мере снижения функции почек появляется и нарастает избыточная продукция ПТГ и FGF-23, прогрессирует гиперфосфатемия. Это доказывает патогенетическую взаимосвязь формирования ВГПТ с гиперпродукцией гуморального фосфатонина FGF-23, поскольку именно данный уровень СКФ определяет рост ПТГ выше верхней границы общепопуляционного референтного интервала.
Background. Secondary hyperparathyroidism (SHPT) is universal complication of chronic kidney disease (CKD), the likelihood of which increases as renal function decreases. Currently, SHPT is considered in the context of mineral and bone disorders associated with CKD. Mineral and bone disorders associated with CKD include, in addition to SHPT, disorders of calcium-phosphorus metabolism, bone pathology and metastatic calcification, which determine poor outcomes of the disease. The purpose of the study was to evaluate the serum concentrations of fibroblast growth factor (FGF) 23 and Klotho protein in patients with various stages of CKD and their relationship with SHPT, vitamin D levels, and calcium-phosphorus metabolism in patients with varying degrees of decreased renal function. Materials and methods. Serum concentrations of FGF 23, Klotho protein, parathyroid hormone (PTH), 25(OH)D, calcium and phosphorus were evaluated in 229 patients with various stages of chronic kidney disease and in 40 people without signs of CKD. Results. It has been shown that individuals with CKD are characterized by overproduction of humoral phosphatonin FGF 23 and Klotho deficiency, which increase as renal failure worsens. A significant relationship was established between FGF 23 and the levels of PTH and blood phosphorus; Klotho protein — with the patient’s age and serum vitamin D. An early marker of disorders in the FGF 23-Klotho system is a decrease in the Klotho protein concentration, which occurs in the early stages of CKD and is aggravated with the progression of renal failure. A statistically significant overproduction of FGF 23 associated with secon-dary hyperparathyroidism was registered in patients with glomerular filtration rate less than 35 ml/min/1.73 m2. Conclusions. An early marker of disorders in the FGF 23-Klotho system is a decrease in the concentration of the Klotho protein, which occurs in the early stages of CKD and is aggravated with the progression of renal failure. The relationship between Klotho deficiency and the formation of SHPT has not been found. As kidney function decreases, excess production of PTH and FGF 23 appears and increases, hyperphosphatemia progresses. This proves the pathogenetic relationship between the formation of SHPT and the overproduction of humoral phosphatonin FGF 23, since it is this glomerular filtration rate that determines the growth of PTH above the upper limit of the general population reference interval.
фактор росту фібробластів 23; Klotho; хронічна хвороба нирок; вторинний гіперпаратиреоз
фактор роста фибробластов 23; Klotho; хроническая болезнь почек; вторичный гиперпаратиреоз
fibroblast growth factor 23; Klotho; chronic kidney disease; secondary hyperparathyroidism
Введение
Материалы и методы
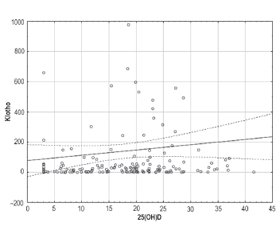
Результаты
Обсуждение
Выводы
- Mizobuchi M., Ogata H., Koiwa F. Secondary Hyperparathyroidism: Pathogenesis and Latest Treatment. Ther. Apher. Dial. 2019 Aug. 23(4). 309-318. doi: 10.1111/1744-9987.12772.
- Saliba W., El-Haddad B. Secondary hyperparathyroidism: pathophysiology and treatment. J. Am. Board Fam. Med. 2009. 22(5). 574-81. doi: 10.3122/jabfm.2009.05.090026. PMID: 19734404.
- Karlovych N.V., Mokhort T.V. Secondary hyperparathyroidism and chronic kidney disease. Minsk, 2021. 177 p. (in Russian).
- Ornitz D.M., Itoh N. The Fibroblast Growth Factor signaling pathway. Wiley Interdiscip Rev. Dev. Biol. 2015. 4(3). 215-66. doi: 10.1002/wdev.176.
- Haussler M.R., Whitfield G.K., Kaneko I. et al. The role of vitamin D in the FGF23, klotho, and phosphate bone-kidney endocrine axis. Rev. Endocr. Metab. Disord. 2012. 13. 57-69. DOI: 10.1007/s11154-011-9199-8.
- Isakova T., Wahl P., Vargas G.S. et al. Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease. Kidney Int. 2011. 79(12). 1370-8. doi: 10.1038/ki.2011.47.
- Kovesdy C.P., Quarles L.D. FGF23 from bench to bedside. Am. J. Physiol. Renal. Physiol. 2016. 310(11). F1168-74. doi: 10.1152/ajprenal.00606.2015.
- Wolf M. Forging forward with 10 burning questions on FGF23 in kidney disease. J. Am. Soc. Nephrol. 2010. 21(9). 1427-35. doi: 10.1681/ASN.2009121293.
- Alvarez-Cienfuegos A., Cantero-Nieto L., Garcia-Gomez J.A., Robledo G., González-Gay M.A., Ortego-Centeno N. FGF23-Klotho axis in patients with rheumatoid arthritis. Clin. Exp. Rheumatol. 2020. 38(1). 50-57. PMID: 31025926.
- Ribeiro A.L., Mendes F., Carias E., Rato F., Santos N., Neves P.L., Silva A.P. FGF23-klotho axis as predictive factors of fractures in type 2 diabetics with early chronic kidney disease. J. Diabetes Complications. 2020. 34(1). 107476. doi: 10.1016/j.jdiacomp.2019.107476.
- Canney M., Djurdjev O., Tang M. GFR-Specific versus GFR-Agnostic Cutoffs for Parathyroid Hormone and Fibroblast Growth Factor-23 in Advanced Chronic Kidney Disease. Am. J. Nephrol. 2019. 50(2). 105-114. https://doi.org/10.1159/000501189.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011. 96(7). 1911-30. https://doi.org/10.1210/jc.2011-0385.
- Obi Y., Hamano T., Isaka Y. Prevalence and prognostic implications of vitamin D deficiency in chronic kidney disease. Dis. Markers. 2015. 2015. 868961. doi: 10.1155/2015/868961.
- Kopple J.D. National kidney foundation K/DOQI clinical practice guidelines for nutrition in chronic renal failure. Am. J. Kidney Dis. 2001. 37(1 Suppl. 2). S66-70. doi: 10.1053/ajkd.2001.20748.
- Chadban S.J., Ahn C., Axelrod D.A. et al. Summary of the Kidney Disease: Improving Global Outcomes (KDIGO) Clinical Practice Guideline on the Evaluation and Management of Candidates for Kidney Transplantation. Transplantation. 2020. 104(4). 708-714. doi: 10.1097/TP.0000000000003137.
- Karlovich N.V., Spiridonova O.S., Sazonova E.G., Mokhort T.V. Determination of the parathyroid hormone reference interval in patients with different stages of the chronic kidney disease. Proceedings of the National Academy of Sciences of Belarus, Medical series. 2021. 18(2). 186-195. (in Russian). https://doi.org/10.29235/1814-6023-2021-18-2-186-195.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. Doi: 10.21856/j-PEP.2019.2.07.
- Cherenko S.M., Dinets A., Bandura G.V., Sheptuha S.A., Larin O.S. Multiglandular parathyroid gland disease: an incidental discovery in normocalcemic patients during thyroid surgery. Acta Endocrinol. (Buchar). 2017. 13(3). 349-355. doi: 10.4183/aeb.2017.349.
- Pankiv I.V. Vitamin D: new aspects of application, effective doses. The current state of the problem. International Journal of Endocrinology (Ukraine). 2021. 17(1). 50-54. DOI: 10.22141/2224-0721.17.1.2021.226430

/21.jpg)
/22.jpg)
/23.jpg)
/23_2.jpg)
/24.jpg)