Международный эндокринологический журнал Том 17, №5, 2021
Вернуться к номеру
Ефекти вітаміну D при автоімунних захворюваннях щитоподібної залози: огляд літератури і власні дослідження
Авторы: Булдигіна Ю.В.(1), Соколова Л.К.(1), Пушкарьов В.М.(1), Шляхтич С.Л.(2), Тронько М.Д.(1)
(1) — ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
(2) — Київський центр ендокринної хірургії, КМКЛ № 3, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Вітамін D (VD) — універсальний стероїдний гормон, що регулює активність декількох тисяч генів. За останні десятиліття були зареєстровані численні захворювання, асоційовані з дефіцитом VD, у тому числі рак та автоімунні захворювання щитоподібної залози (ЩЗ). Дослідження показали, що VD може впливати на розвиток і перебіг цих захворювань. Показана участь VD у модуляції осі «гіпоталамус — гіпофіз — ЩЗ» як на рівні гіпофіза, так і на рівні ЩЗ. Вплив вітаміну D на автоімунні захворювання, у тому числі автоімунні захворювання ЩЗ, широко досліджується. Більшість існуючих даних підтверджують взаємозв’язок між дефіцитом вітаміну D і більш значною тенденцією до розвитку тиреоїдиту Хашимото, хвороби Грейвса (ХГ) і післяпологового тиреоїдиту і вищими титрами антитіл, пов’язаних із цими захворюваннями. Важливим фактом є те, що епідеміологічні дослідження продемонстрували високий рівень поширеності дефіциту або недостатності VD у всьому світі. Недостатність VD є сильним дієтичним пусковим механізмом, наслідком якого є тяжкі хронічні захворювання. Виникає питання, наскільки надійним є зв’язок між VD та автоімунними захворюваннями ЩЗ (АЗЩЗ). Хоча результати проведених досліджень є дещо суперечливими, переважна більшість даних вказують на зв’язок між дефіцитом VD і підвищеним ризиком розвитку захворювання, вищими титрами антитіл, труднощами в лікуванні. Поліморфізми в генах, пов’язані з функцією і метаболізмом VD, також мають певний вплив на ризик АЗЩЗ. Щодо точного характеру відносин між VD та АЗЩЗ, то вважається, що VD відіграє невелику, але суттєву роль у патогенезі AЗЩЗ. Після розвитку AЗЩЗ його наслідком може бути посилення дефіциту VD. Безпосередньо для клінічної практики є необхідність визначення ефекту добавок VD у профілактиці й лікуванні AЗЩЗ і його оптимального рівня. У ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» було проведено дослідження, метою якого було вивчення вмісту VD, а саме 25(OH)D, у 176 пацієнтів із ХГ, ускладненою автоімунною офтальмопатією (АО), і визначення його кореляційних зв’язків з антитиреоїдними антитілами (антитіла до тиреопероксидази (АТПО), антитіла до рецепторів тиреотропного гормону (АТ рТТГ)). Матеріали та методи. Визначення 25(OH)D, ТТГ, АТ рТТГ, АТПО проводилось методом імуноферментного аналізу за допомогою стандартних наборів фірми Siemens. Під час дослідження 176 осіб були розподілені на дві групи залежно від наявності АО: перша група — пацієнти з ХГ без АО (62 особи), друга група — пацієнти з ХГ з АО (114 осіб). Результати. Серед пацієнтів із ХГ 91,78 % (161 особа) мають недостатній рівень 25(ОН)D: субоптимальний рівень зафіксовано у 42 осіб (23,86 %), а дефіцит — у 119 осіб (67,61 %). Вірогідний від’ємний кореляційний зв’язок між АТ рТТГ і 25(OH)D виявлено в групі хворих із ХГ і АО — з меншим рівнем 25(OH)D корелюють вищі значення АТ рТТГ. Компенсація нестачі 25(ОН)D призводить до вірогідного (Р < 0,05) зменшення рівнів АТ рТТГ та АТПО у пацієнтів із ХГ. Висновки. З перехресних досліджень і спостережень доступний великий обсяг даних, що пов’язують вітамін D з автоімунними захворюваннями ЩЗ. Усе ще існує нагальна потреба у великих багатоцентрових дослідженнях для оцінки впливу добавок вітаміну D на значущі довгострокові клінічні кінцеві точки при AЗЩЗ.
Background. Vitamin D (VD) is a versatile steroid hormone that regulates the activity of several thousand genes. Over the past decades, numerous diseases associated with VD deficiency have been reported, including cancer and autoimmune thyroid disorders. Researches revealed that VD can influence the development and course of these diseases. The VD participation in modulation of the hypothalamus-pituitary-thyroid gland axis, both at the level of the pituitary gland and at that of the thyroid, has been shown. The effect of VD on autoimmune diseases, including thyroid autoimmune diseases, is widely studied. Most of the existing data support the relationship between VD deficiency and a greater tendency to develop and higher antibody titers associated with Hashimoto’s thyroiditis, Graves’ disease (GD) and postpartum thyroiditis. An important fact is that epidemiological studies have demonstrated a high prevalence of VD deficiency or insufficiency throughout the world. VD insufficiency is a potent dietary trigger that results in severe, chronic diseases. The question arises how reliable is the relationship between VD and autoimmune thyroid diseases (AITD). Although the results of the studies performed are somewhat contradictory, the vast majority of data indicates a link between VD deficiency and an increased risk of developing the disease, high antibody titers, and difficulties in treatment. Genetic polymorphisms associated with VD function and metabolism also have some influence on the risk of ATD. With regard to the precise nature of the relationship between VD and AITD, it is believed that VD plays a small but significant role in the AITD pathogenesis. After the AITD development, its consequence may be an increase in VD deficiency. It is the need to determine the effect of VD supplementation in the prevention and treatment of AITD and its optimal level directly for clinical practice. It is necessary for clinical practice to determine the effect of VD supplements in the prevention and treatment of AITD and its optimal level. A study, the purpose of which was to study the content of VD, namely 25(OH)D in 176 patients with GD complicated by autoimmune ophthalmopathy (AO) and to identify a correlation relationship with antithyroid antibodies (TPO, TSHR-Ab) was carried out at the State Institution “V.P. Komissarenko Institute of Endocrinology and Metabolism of the National Academy of Medical Sciences of Ukraine”. Materials and methods. The levels of 25(OH)D, TSH, TSHR-Ab, TPO were determined by enzyme immunoassay using standard kits from Siemens firm. During the study, 176 patients were divided into two groups, depending on the presence of AO: the first group consisted of patients with GD without AO (62 people), the second group included patients with GD and AO (114 people). Results. In GD, 91.78 % of patients (161 people) have an insufficient level of 25(OH)D content: a suboptimal level was recorded in 42 patients (23.86 %), and a deficit — in 119 patients (67.61 %). A significant negative correlation relationship was revealed between TSHR-Ab and 25(OH)D in the group of patients with GD and AO — with a lower level of 25(OH)D, the higher values of TSHR-Ab correlate. Compensation of the 25(OH)D deficiency leads to a significant (P < 0.05) decrease in the levels of TSHR-Ab and TPO in patients with GD. Besides, there is a large body of literature available lin-king vitamin D to thyroid autoimmunity as a result of cross-sectional studies and observations. Conclusions. Thus, there is still an urgent need for large multicenter studies to evaluate the effect of vitamin D supplementation on meaningful long-term clinical endpoints in AITD.
вітамін D; щитоподібна залоза; автоімунні захворювання; імунна система
vitamin D; thyroid gland; autoimmune diseases; immune system
Загальна характеристика вітаміну D
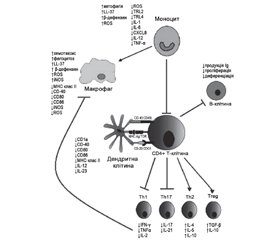
Імуномодулюючі властивості VD
/36.jpg)
Вітамін D і функція щитоподібної залози
Вітамін D і автоімунні захворювання щитоподібної залози
Матеріали та методи
Результати
Висновки
- Sokolova L.K., Pushkarev V.M., Tronko N.D. Effects of vitamin D in various pathologies. Endokrynologia. 2021. 26(2). 67-85. DOI: 10.31793/1680-1466.2021.26-2.67.
- Aslan M.T., Aslan İ.Ö., Özdemir Ö. Letter to the Editor: Is vitamin D one of the key elements in COVID-19 days? J. Nutr. Health Aging. 2020. 24(9). 1038-9. doi: 10.1007/s12603-020-1413-5.
- Тронько Н.Д., Пушкарев В.М., Соколова Л.К., Пушкарев В.М., Ковзун Е.И. Молекулярные механизмы патогенеза сахарного диабета и его осложнений. Киев: Медкнига, 2018. 264 с.
- Saponaro F., Saba A., Zucchi R. An update on vitamin D metabolism. Int. J. Mol. Sci. 2020 Sep 8. 21(18). 6573. doi: 10.3390/ijms21186573.
- Latic N., Erben R.G. Vitamin D and cardiovascular disease, with emphasis on hypertension, atherosclerosis, and heart failure. Int. J. Mol. Sci. 2020 Sep 4. 21(18). 6483. doi: 10.3390/ijms21186483.
- Silver J., Naveh-Many T. FGF-23 and secondary hyperparathyroidism in chronic kidney disease. Nat. Rev. Nephrol. 2013 Nov. 9(11). 641-9. doi: 10.1038/ nrneph.2013.147.
- Mele C., Caputo M., Bisceglia A., Samà M.T., Zavattaro M., Aimaretti G. et al. Immunomodulatory effects of vitamin D in thyroid diseases. Nutrients. 2020 May 16. 12(5). 1444. doi: 10.3390/nu12051444.
- Balla M., Merugu G.P., Konala V.M., Sangani V., Kondakindi H., Pokal M. et al. Back to basics: review on vitamin D and respiratory viral infections including COVID-19. J. Community Hosp. Intern. Med. Perspect. 2020 Oct 29. 10(6). 529-36. doi: 10.1080/20009666.2020.1811074.
- Zhao R., Zhang W., Ma C., Zhao Y., Xiong R., Wang H., Chen W., Zheng S.G. Immunomodulatory function of vitamin D and its role in autoimmune thyroid disease. Front. Immunol. 2021 Feb 19. 12. 574967. doi: 10.3389/fimmu.2021.574967.
- Norman P.E., Powell J.T. Vitamin D and cardiovascular disease. Circ. Res. 2014 Jan 17. 114(2). 379-93. doi: 10.1161/CIRCRESAHA.113.301241.
- Kumar R., Rathi H., Haq A., Wimalawansa S.J., Sharma A. Putative roles of vitamin D in modulating immune response and immunopathology associated with COVID-19. Virus Res. 2021 Jan 15. 292. 198235. doi: 10.1016/j.virusres.2020. 198235.
- Ferreira G.B., Vanherwegen A.S., Eelen G., Gutiérrez A.C.F., Van Lommel L., Marchal K. et al. Vitamin D3 induces tolerance in human dendritic cells by activation of intracellular metabolic pathways. Cell. Rep. 2015 Feb 10. 10(5). 711-25. doi: 10.1016/j.celrep.2015.01.013.
- Zhang X., Zhou M., Guo Y., Song Z., Liu B. 1,25-dihydroxyvitamin D3 promotes high glucose-induced M1 macrophage switching to M2 via the VDR-PPAR gamma signaling pathway. Biomed. Res. Int. 2015. 2015. 157834. doi: 10.1155/2015/157834.
- Rak K., Bronkowska M. Immunomodulatory effect of vitamin D and its potential role in the prevention and treatment of type 1 diabetes mellitus — a narrative review. Molecules. 2018 Dec 24. 24(1). 53. doi: 10.3390/molecules24010053.
- Piantoni S., Andreoli L., Scarsi M., Zanola A., Dall’Ara F., Pizzorni C. et al. Phenotype modifications of T-cells and their shift toward a Th2 response in patients with systemic lupus erythematosus supplemented with different monthly regimens of vitamin D. Lupus. 2015 Apr. 24(4-5). 490-8. doi: 10.1177/0961203314559090.
- Singh S.K., Jain R., Singh S. Vitamin D deficiency in patients with diabetes and COVID-19 infection. Diabetes Metab. Syndr. 2020 Sep-Oct. 14(5). 1033-5. doi: 10.1016/j.dsx.2020.06.071.
- Barchetta I., Baroni M., Leonetti F., De Bernardinis M., Bertoccini L., Fontana M. et al. TSH levels are associated with vitamin D status and seasonality in an adult population of euthyroid adults. Clin. Exp. Med. 2015 Aug. 15(3). 389-96. doi: 10.1007/s10238-014-0290-9.
- Vieira I.H., Rodrigues D., Paiva I. Vitamin D and autoimmune thyroid disease-cause, consequence, or a vicious cycle? Nutrients. 2020 Sep 11. 12(9). 2791. doi: 10.3390/nu12092791.
- Muscogiuri G., Tirabassi G., Bizzaro G., Orio F., Paschou S.A., Vryonidou A. et al. Vitamin D and thyroid disease: To D or not to D? Eur. J. Clin. Nutr. 2015 Mar. 69(3). 291-6. doi: 10.1038/ejcn.2014.265.
- Kim M., Song E., Oh H.S., Park S., Kwon H., Jeon M.J. et al. Vitamin D deficiency affects thyroid autoimmunity and dysfunction in iodine-replete area: Korea national health and nutrition examination survey. Endocrine. 2017 Nov. 58(2). 332-9. doi: 10.1007/s12020-017-1425-z.
- Vondra K., Bílek R., Matucha P., Salátová M., Vosát-ková M., Stárka L., Hampl R. Vitamin D supplementation changed relationships, not levels of metabolic-hormonal parameters in autoimmune thyroiditis. Physiol. Res. 2017 Sep 26. 66 (Suppl. 3). S409-17. doi: 10.33549/physiolres.933727.
- Kim D. The role of vitamin D in thyroid diseases. Int. J. Mol. Sci. 2017 Sep 12. 18(9). 1949. doi: 10.3390/ijms18091949.
- Orgiazzi J. Thyroid autoimmunity. Presse Med. 2012 Dec. 41(12 P 2). e611-25. doi: 10.1016/j.lpm.2012.10.002.
- Merrill S.J., Minucci S.B. Thyroid autoimmunity: an interplay of factors. Vitam. Horm. 2018. 106. 129-45. doi: 10.1016/bs.vh.2017.07.001.
- Wiersinga W.M. Thyroid autoimmunity. Paediatric thyroidology. Karger Publishers: Basel, Switzerland, 2014. 26. 139-57. https://doi.org/10.1159/ 000363161.
- Zhao F., Feng J., Li J., Zhao L., Liu Y., Chen H. et al. Alterations of the gut microbiota in Hashimoto’s thyroiditis patients. Thyroid. 2018 Feb. 28(2). 175-186. doi: 10.1089/thy.2017.0395.
- Dutta D., Sharma M., Aggarwal S., Mohindra R., Bhattacharya S., Kalra S. Vitamin D, thyroid autoimmunity and cancer: an interplay of different factors. Indian J. Endocrinol. Metab. 2019 Sep-Oct. 23(5). 507-13. doi: 10.4103/ijem.IJEM_526_19.
- Muscogiuri G., Palomba S., Caggiano M., Tafuri D., Colao A., Orio F. Low 25 (OH) vitamin D levels are associated with autoimmune thyroid disease in polycystic ovary syndrome. Endocrine. 2016 Aug. 53(2). 538-42. doi: 10.1007/s12020-015-0745-0.
- Wang J., Lv S., Chen G., Gao C., He J., Zhong H., Xu Y. Meta-analysis of the association between vitamin D and autoimmune thyroid disease. Nutrients. 2015 Apr 3. 7(4). 2485-98. doi: 10.3390/nu7042485.
- Effraimidis G., Badenhoop K., Tijssen J.G., Wiersinga W.M. Vitamin D deficiency is not associated with early stages of thyroid autoimmunity. Eur. J. Endocrinol. 2012 Jul. 167(1). 43-8. doi: 10.1530/EJE-12-0048.
- D’Aurizio F., Villalta D., Metus P., Doretto P., Tozzoli R. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases? Autoimmun. Rev. 2015 May. 14(5). 363-9. doi: 10.1016/j.autrev.2014.10.008.
- Chahardoli R., Saboor-Yaraghi A.A., Amouzegar A., Khalili D., Vakili A.Z., Azizi F. Can supplementation with vitamin D modify thyroid autoantibodies (Anti-TPO Ab, Anti-Tg Ab) and thyroid profile (T3, T4, TSH) in Hashimoto’s thyroiditis? A Double Blind, Randomized Clinical Trial. Horm. Metab. Res. 2019 May. 51(5). 296-301. doi: 10.1055/a-0856-1044.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018 Dec. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451.
- Komisarenko Y.I., Bobryk M.I. Vitamin D Deficiency and Immune Disorders in Combined Endocrine Pathology. Front. Endocrinol. (Lausanne). 2018. 9. 600. doi: 10.3389/fendo.2018.00600.
- Поворознюк В.В., Паньків І.В. Взаємозв’язок дефіциту вітаміну D зі зниженою функцією щитоподібної залози. Клінічна ендокринологія і ендокринна хірургія. 2014. 12-16. doi: 10.24026/1818-1384.3-4(48).2014.75353.
- Pankiv I. Impact of cholecalciferol supplementation on thyroid peroxidase antibody titers in patients with hypothyroidism. Osteoporosis International. 2017. 38 (Suppl. 1). 628-629.
- Goswami R., Marwaha R.K., Gupta N., Tandon N., Sreenivas V., Tomar N. et al. Prevalence of vitamin D deficiency and its relationship with thyroid autoimmunity in Asian Indians: a community-based survey. Br. J. Nutr. 2009 Aug. 102(3). 382-6. doi: 10.1017/S0007114509220824.
- Yasuda T., Okamoto Y., Hamada N., Miyashita K., Takahara M., Sakamoto F. et al. Serum vitamin D levels are decreased and associated with thyroid volume in female patients with newly onset Graves’ disease. Endocrine. 2012 Dec. 42(3). 739-41. doi: 10.1007/s12020-012-9679-y.
- Zhang H., Liang L., Xie Z. Low vitamin D status is associated with increased thyrotropin-receptor antibody titer in Graves’s disease. Endocr. Pract. 2015 Mar. 21(3). 258-63. doi: 10.4158/EP14191.OR.
- Mangaraj S., Choudhury A.K., Swain B.M., Sarangi P.K., Mohanty B.K., Baliarsinha A.K. Evaluation of vitamin D status and its impact on thyroid related parameters in new onset Graves’ dsease — A cross-sectional observational study. Indian J. Endocrinol. Metab. 2019 Jan-Feb. 23(1). 35-9. doi: 10.4103/ijem.IJEM_183_18.
- Xu M.Y., Cao B., Yin J., Wang D.F., Chen K.L., Lu Q.B. Vitamin D and Graves’ disease: a meta-analysis update. Nutrients. 2015 May 21. 7(5). 3813-27. doi: 10.3390/nu7053813.
- Ahn H.Y., Chung Y.J., Cho B.Y. Serum 25-hydroxyvitamin D might be an independent prognostic factor for Graves disease recurrence. Medicine (Baltimore). 2017 Aug. 96(31). e7700. doi: 10.1097/MD.0000000000007700.
- Li X., Wang G., Lu Z., Chen M., Tan J., Fang X. Serum 25-hydroxyvitamin D predict prognosis in radioiodine therapy of Graves’ disease. J. Endocrinol. Invest. 2015 Jul. 38(7). 753-9. doi: 10.1007/s40618-015-0252-4.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. Doi 10.21856/j-PEP.2019.2.07.
- Pankiv V., Pankiv I. Association of vitamin D status with body mass index in adolescents in Ukraine. Romanian Journal of Diabetes Nutrition and Metabolic Diseases. 22 Dec 2018 [cited 4 Nov 2020]. 25(4). 377-81. http://www.rjdnmd.org/index.php/RJDNMD/article/view/530.
- Gao X.R., Yu Y.G. Meta-Analysis of the Association between Vitamin D Receptor Polymorphisms and the Risk of Autoimmune Thyroid Disease. Int. J. Endocrinol. 2018 Mar 22. 2018. 2846943. doi: 10.1155/2018/2846943.
- Giovinazzo S., Vicchio T.M., Certo R., Alibrandi A., Palmieri O., Campennì A. et al. Vitamin D receptor gene polymorphisms/haplotypes and serum 25(OH)D3 levels in Hashimoto’s thyroiditis. Endocrine. 2017 Feb. 55(2). 599-606. doi: 10.1007/s12020-016-0942-5.
- Veneti S., Anagnostis Р., Adamidou F., Artzouchaltzi A.M., Boboridis K., Kita M. Association between vitamin D receptor gene polymorphisms and Graves’ disease: a systematic review and meta-analysis. Endocrine. 2019 Aug. 65(2). 244-251. doi: 10.1007/s12020-019-01902-3.
- Inoue N., Watanabe M., Ishido N., Katsumata Y., Kagawa T., Hidaka Y., Iwatani Y. The functional polymorphisms of VDR, GC and CYP2R1 are involved in the pathogenesis of autoimmune thyroid diseases. Clin. Exp. Immunol. 2014 Nov. 178(2). 262-9. doi: 10.1111/cei.12420.
- Wang S., Wu Y., Zuo Z., Zhao Y., Wang K. The effect of vitamin D supplementation on thyroid autoantibody levels in the treatment of autoimmune thyroiditis: a systematic review and a meta-analysis. Endocrine. 2018 Mar. 59(3). 499-505. doi: 10.1007/s12020-018-1532-5.
- Koehler V.F., Filmann N., Mann W.A. Vitamin D Status and Thyroid Autoantibodies in Autoimmune Thyroiditis. Horm. Metab. Res. 2019 Dec. 51(12). 792-797. doi: 10.1055/a-1023-4181.
- Krysiak R., Kowalcze K., Okopień B. The effect of vitamin D on thyroid autoimmunity in euthyroid men with autoimmune thyroiditis and testosterone deficiency. Pharmacol. Rep. 2019 Oct. 71(5). 798-803. doi: 10.1016/j.pharep.2019.04.010.
- Krysiak R., Kowalcze K., Okopień B. Selenomethionine potentiates the impact of vitamin D on thyroid autoimmunity in euthyroid women with Hashimoto’s thyroiditis and low vitamin D status. Pharmacol. Rep. 2019 Apr. 71(2). 367-373. doi: 10.1016/j.pharep.2018.12.006.
- Mirhosseini N., Brunel L., Muscogiuri G., Kimball S. Physiological serum 25-hydroxyvitamin D concentrations are associated with improved thyroid function-observations from a community-based program. Endocrine. 2017 Dec. 58(3). 563-573. doi: 10.1007/s12020-017-1450-y.
- Cho Y.Y., Chung Y.J. Vitamin D supplementation does not prevent the recurrence of Graves’ disease. Sci Rep. 2020 Jan 8. 10(1). 16. doi: 10.1038/s41598-019-55107-9.
- Grove-Laugesen D., Malmstroem S., Ebbehoj E., Riis A.L., Watt T., Hansen K.W., Rejnmark L. Effect of 9 months of vitamin D supplementation on arterial stiffness and blood pressure in Graves’ disease: a randomized clinical trial. Endocrine. 2019 Nov. 66(2). 386-97. doi: 10.1007/s12020-019-01997-8.
- Simsek Y., Cakır I., Yetmis M., Dizdar O.S., Baspinar O., Gokay F. Effects of vitamin D treatment on thyroid autoimmunity. J. Res Med. Sci. 2016 Oct 18. 21. 85. doi: 10.4103/1735-1995.192501.
- Krysiak R., Szkróbka W., Okopień B. The effect of vitamin D on thyroid autoimmunity in levothyroxine-treated women with Hashimoto’s thyroiditis and normal vitamin D Status. Exp. Clin. Endocrinol. Diabetes. 2017 Apr. 125(4). 229-33. doi: 10.1055/s-0042-123038.
- Kozai M., Yamamoto H., Ishiguro M., Harada N., Masuda M., Kagawa T. et al. Thyroid hormones decrease plasma 1α,25-dihydroxyvitamin D levels through transcriptional repression of the renal 25-hydroxyvitamin D3 1α-hydroxylase gene (CYP27B1). Endocrinology. 2013 Feb. 154(2). 609-22. doi: 10.1210/en.2012-1647.
- Hu S., Rayman M.P. Multiple nutritional factors and the risk of Hashimoto’s thyroiditis. Thyroid. 2017 May. 27(5). 597-610. doi: 10.1089/thy.2016.0635.
- Botelho I.M.B., Moura Neto A., Silva C.A., Tambascia M.A., Alegre S.M., Zantut-Wittmann D.E. Vitamin D in Hashimoto’s thyroiditis and its relationship with thyroid function and inflammatory status. Endocr. J. 2018 Oct 29. 65(10). 1029-37. doi: 10.1507/endocrj.EJ18-0166.
- Jyotsna V.P., Sahoo A., Ksh S.A., Sreenivas V., Gupta N. Bone mineral density in patients of Graves disease pre- & post-treatment in a predominantly vitamin D deficient population. Indian J. Med. Res. 2012. 135(1). 36-41. doi: 10.4103/0971-5916.93422.
- Proal A.D., Albert P.J., Marshall T.G. Dysregulation of the vitamin D nuclear receptor may contribute to the higher prevalence of some autoimmune diseases in women. Ann. N. Y. Acad. Sci. 2009 Sep. 1173. 252-9. doi: 10.1111/j.1749-6632.2009.04672.x.

/40.jpg)