Вступ
Ювенільний ідіопатичний артрит (ЮІА) — група хронічних деструктивно-запальних захворювань суглобів з автоімунним патогенезом у дітей до 16 років, що за поширеністю та інвалідизацією посідає перше місце серед ревматичних хвороб у світовій дитячій популяції. Незважаючи на сучасні досягнення у визначенні етіології та патогенезу ЮІА, численні питання, що стосуються розвитку захворювання, залишаються нез’ясованими. Центральною ланкою патогенезу на сьогодні вважаються активація та дисбаланс клітинного і гуморального імунітету та, як наслідок, надлишковий синтез прозапальних цитокінів.
У науковій літературі останнім часом накопичено великий обсяг інформації про роль вітаміну D, зокрема його активного метаболіту 1,25-дигідроксивітаміну D (1,25(OH)2D3) у регуляції процесів імуногенезу, клітинної проліферації, диференціювання та апоптозу імунокомпетентних клітин [1]. Молекулярний механізм дії даного метаболіту реалізується при взаємодії з рецепторами вітаміну D (VDR) [2], які експресуються на різних клітинах, у тому числі імунологічних (макрофаги, дендритні клітини, Т-лімфоцити), а також на хондроцитах, синовіоцитах [4, 13, 16]. Доведено, що 1,25(OH)2D3 (кацьцитріол) моделює проліферацію T-лімфоцитів, пригнічує розвиток Т-лімфоцитів хелперів 17 (Th17), диференціювання дендритних клітин (DС), В-клітин, пригнічує продукцію Тh1-асоційованих цитокінів –(IL-2, If-γ, TNF-α), Th9 (IL-9) і Th22 (IL-22) та кістковостимулюючих молекул (СD-40, СD-80 і СD-86), які стимулюють продукцію Тh2-асоційованих протизапальних цитокінів (IL-3, IL-4, IL-5, IL-10) [7]. Припускають, що достатній рівень забезпеченості організму ВD призводить до переходу від прозапального до більш толерантного імунного статусу [9]. Саме імунорегуляторними ефектами кальцитріолу обумовлена актуальність вивчення забезпеченості ВD при багатьох патологічних станах, у тому числі автоімунних хворобах.
Результати аналізу даних вітчизняних та зарубіжних досліджень свідчать, що в більшості дітей з ЮІА наявні дефіцит або недостатність вітаміну D [14]. Дослідження, проведені в ДУ «Інститут ПАГ ім. акад. О.М. Лук’янової» за останнє десятиріччя, показали, що в переважної більшості хворих на ЮІА (82,6 %) відмічаються зниження забезпеченості вітаміном D, а дефіцит ВD (ДВD) діагностували в 39,1 % випадків (25ОНD нижче 20 нг/мл) і лише у 17,4 % хворих концентрація 25ОНD у сироватці крові була достатньою (у межах 30–50 нг/мл) [7].
Разом із тим результати існуючих досліджень щодо значимості низької забезпеченості ВD у дебюті ЮІА в активації автоімунного процесу, подальшому перебігу захворювання, ризику розвитку ускладнень і коморбідної патології та у ефективності терапії базисними та протизапальними препаратами на сьогодні є суперечливими. Актуальність також зберігають і питання щодо додаткового прийому препаратів ВD, його добових доз та тривалості курсів у хворих на ЮІА з урахуванням активності та перебігу захворювання, особливостей медикаментозної терапії, залежно від сезону року [10–12, 15].
Незважаючи на існуючі дослідження з визначення причин, що сприяють зниженню забезпеченості організму ВD, не всі тригерні фактори, які визначають розвиток недостатності або дефіциту даного вітаміну, особливо в дітей із ревматичними хворобами, на сьогодні доведені.
Для швидкої ідентифікації пацієнтів з ЮІА, які потребують визначення та моніторингу концентрацій ВD у сироватці крові, доцільними є оцінка значимості окремих факторів ризику дефіциту вітаміну D та створення опитувальника для застосування в практичній діяльності дитячих ревматологів, педіатрів і сімейних лікарів.
Мета: визначити фактори ризику зниження забезпеченості вітаміном D (ВD) у хворих на ювенільний ідіопатичний артрит і розробити опитувальник для швидкої ідентифікації пацієнтів, яким доцільно моніторувати концентрацію даного вітаміну в крові.
Матеріали та методи
Для вивчення тригерних факторів зниження забезпеченості ВD проведено клініко-лабораторне обстеження 78 дітей віком 2–17 років з ЮІА, які перебували на стаціонарному лікуванні в ДУ «Інститут ПАГ ім. акад. О.М. Лук’янової НАМН України», із них хлопчики становили 46,96 %, дівчатка — 53,0 %. Для верифікації діагнозу ЮІА використовувались загальновизнані критерії (ILAR, 2019). Середній вік дітей становив 11,3 ± 2,5 року, а середня тривалість хвороби — 3,5 ± 1,4 року. Усі хворі перебували в активному періоді хвороби (у 23 хворих визначений II–III ступінь активності, у 52 — І ступінь) й одержували медикаментозну терапію, що включала базисні препарати (метотрексат), нестероїдні протизапальні засоби (вольтарен, ібупрофен, мелоксикам), що отримували 15,4 % дітей, середня тривалість застосування ГК — 2,5 ± 1,5 року.
Для визначення можливих причин зниження забезпеченості організму вітаміном D дітей, хворих на ЮІА, використовували анкету, що включала детальне вивчення анамнестичних даних, результатів клінічного обстеження пацієнтів, зокрема особливу увагу звернено на загальновизнані чинники, які є предикторами розвитку ДВD (недостатнє перебування дитини в умовах природного освітлення та під прямим сонячним опроміненням, використання сонцезахисних засобів, систематичне використання закритого одягу, незбалансоване харчування, прийом препаратів, які погіршують метаболізм вітаміну D, ожиріння, хвороби шлунково-кишкового тракту (ШКТ), печінки, нирок, порушення процесів всмоктування) [8]. В анкеті враховували особливості перинатального анамнезу пацієнтів, наявність інфекційних та хронічних соматичних захворювань протягом життя, тривалість та особливості перебігу ЮІА, частоту загострень та тривалість стаціонарного лікування, дози і тривалість протизапальної та імуносупресивної терапії основного захворювання — глюкокортикоїдів (ГК), метотрексату, генно-інженерних імунобіологічних препаратів, особливості харчування (регулярність вживання молочних продуктів, риби, морепродуктів), неконтрольований прийом полівітамінів, препаратів риб’ячого жиру, кальцію, ВD.
Всім дітям визначалась концентрація 25OHD у сиворотці крові з використанням комерційних наборів Vitamin D3 — Skreeningkit (Швейцарія) відповідно до інструкції фірми-виробника.
Рівень забезпеченності оцінювали згідно з рекомендаціями експертів із країн Центральної Європи, якими у 2013 році прийняті граничні діагностичні рівні 25(OH)D у сироватці крові: рівень < 20 нг/мл відповідає дефіциту, 21–30 нг/мл — недостатності, 30–50 нг/мл — достатній концентрації вітаміну [4].
Отримані цифрові дані опрацьовані статистично за допомогою комп’ютерного пакета програм Microsoft Excel. Як кількісна міра ефекту при порівнянні відносних показників використовувався показник відношення шансів (ВШ) із 95% довірчим інтервалом, який дозволяє порівняти групи досліджуваних за частотою виявлення певного фактора ризику.
Порівняння даних проводилося за допомогою критеріїв χ2 Пірсона, χ2 Пірсона — Єйтса, точного критерію Фішера, що дозволяють оцінити значимість відмінностей у фактичній кількості якісних характеристик вибірки.
Було використано стандартизований критеріальний метод тестування, що має комплексну характеристику, що визначається його властивостями, процедурою вимірювання і процедурою шкалювання, а також чіткою регламентацією процедури та логістики (організації) процесу тестування.
Стандартизації тесту передувало пілотне тестування. Воно здійснювалось на репрезентативній вибірці з метою визначення параметрів тесту та уточнення процедур тестування. Тест, визначаючи індивідуальні результати, передбачає оцінювання взаємозв’язку даних результатів із попередньо встановленими критеріями. Процедура розроблення передбачає встановлення норм виконання через попереднє тестування дітей, для яких дані тести призначені.
Результати та обговорення
Аналіз результатів клініко-лабораторного обстеження показав, що в переважної більшості (84,6 %) хворих на ЮІА дітей спостерігалося зниження забезпеченості організму вітаміном D.
Проведений порівняльний аналіз впливу несприятливих ризик-факторів щодо зниження забезпеченості організму вітаміном D у дітей із концентраціями 25OHD у сироватці крові (табл. 1). Для цього обстежених пацієнтів розподілено на 2 групи: перша — мала на момент обстеження зниження концентрації 25OHD (n = 47 дітей), друга — 25OHD у межах 30–50 нг/мл (n = 31 дитина). Результати досліджень показали, що діти старшого віку та чоловічої статі мали більше відношення шансів на дефіцит ВD. Вік і стать, як відомо, характеризують значення, які асоціюються з ростовими стрибками, режимом дня, харчовими та сонцезахисними звичками.
/14.jpg)
/15.jpg)
При аналізі отриманих даних вірогідна різниця визначена за такими показниками: часті (більше 8 разів на рік) гострі респіраторні захворювання (ВШ = 0,18, 95% ДІ (0,04–0,8), р = 0,02), які потребували лікування антибактеріальними препаратами більше ніж вісім разів на рік (ВШ = 7,9, 95% ДІ (1,1–69,4), р = 0,05), що визначало тяжкість їх перебігу в дітей на імуносупресивній терапії.
За результатами проведених досліджень, частка дітей із дефіцитом ВD була статистично значима в групі пацієнтів, які мали загострення ЮІА протягом останніх 6 місяців (ВШ = 13,5, 95% ДІ (2,5–66,5), р = 0,001) та перебували на стаціонарному лікуванні з приводу загострення основного захворювання або супутньої патології (ВШ = 8,6, 95% ДІ (1,9–40,0), р = 0,005).
Кількість дітей, які отримували довготривалу ГК-терапію в анамнезі, вірогідно вища в групі з ДВD (р = 0,0002), а кількість дітей із дефіцитом ВD, які отримували ГК-терапію під час обстеження, вірогідно не відрізнялась від кількості хворих, які не отримували ГК, найімовірніше, тому, що дані пацієнти були в дебюті ЮІА, отримували ГК-терапію нетривалий час, що не встигало позначитись на метаболізмі кальцію та вітаміну D в організмі.
Діти, які перебували на свіжому повітрі під непрямим сонячним опроміненням менше двох годин протягом дня, мали більшу частоту ДВD (р ≤ 0,02). При цьому всі діти з нормальними концентраціями вітаміну проводили щоденно на вулиці більше двох годин (р ≤ 0,001).
Потенційний внесок дієти до постачання вітаміну D в організм є предметом дискусії, однак загальна думка полягає в тому, що складно отримати адекватні концентрації вітаміну D у сироватці крові в дітей за рахунок продуктів харчування. Близько 30,0 % осіб в усьому світі недостатньо отримують вітаміну D із продуктів харчування. В Україні понад 80,0 % населення мають нестачу вітаміну D, що несе потенційні ризики для кістково-м’язової тканини та серцево-судинної системи. Тому вже в 75 країнах світу діють програми обов’язкового збагачення мікроелементами борошна, олії та ін. В Україні фортифікація продуктів харчування вітаміном D, насамперед таких як олійно-жирові, молочні продукти, борошно, цукор, сіль, не має системної підтримки на державному рівні.
Взагалі не отримують щодня молоко (стакан/день) 54,8 % дітей із ДВD (ВШ = 6,1, 95% ДІ (1,1–32,4), р = 0,02). Діти, які щоденно вживають в їжу дві порції або більше молока, рідше були D-дефіцитними (ВШ = 0,07, 95% ДІ (0,02–0,37), р = 0,001).
Дефіцит ВD вірогідно частіше розвивався в дітей, які вживають рибу та морепродукти менше двох-трьох разів на тиждень (ВШ = 10,0, 95% ДІ (1,9–108,3), р = 0,05).
Значима статистична різниця між порівнювальними показниками встановлена за наявності в дитини з ДВD скарг на болі у суглобах, кістках, м’язах поза загостренням основної хвороби (ВШ = 8,7, 95% ДІ (3,4–101,2), р = 0,0004) та болів у спині (ВШ = 150, 95% ДІ (12,2–1836), р = 0,0001).
Значно частіше в дітей із ДВD відмічені також ознаки вегетативних порушень нервової системи (ВШ = 29,0, 95% ДІ (4,5–188,0), р = 0,0001).
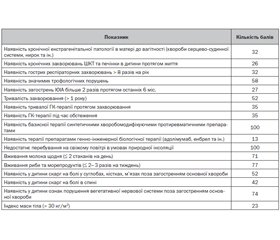
На підставі визначення несприятливих факторів у дітей з ЮІА розроблений опитувальник, за допомогою якого можливо виявляти осіб, які мають високий ризик ДвD, що сигналізує про необхідність проведення їм лабораторного визначення та моніторингу концентрації вітаміну D в крові і своєчасного призначення препаратів ВD.
Наведений опитувальник (табл. 2) містить запитання, націлені на визначення факторів ризику виникнення дефіциту вітаміну D у дітей, що дозволяє відокремити групи пацієнтів для визначення концентрації ВD та подальшого її моніторування, що є необхідним у клінічній практиці дитячого ревматолога, сімейного лікаря та педіатра.
У результаті тестування в 46 хворих на ЮІА визначалась загальна кількість отриманих балів, та проведене їх пробне тестування. У дітей, які під час тестування отримали більше ніж 264 бали, лабораторно підтверджені недостатність або дефіцит вітаміну D. Отже, дану кількість балів можна вважати граничною для ідентифікації дітей, які підлягають обстеженню.
При цьому частка дітей, які набрали достатню (> 246) кількість балів, але на момент тестування пройшли лікувальний курс препаратами вітаміну D, мали достатній рівень вітаміну D у сироватці крові. Це свідчить про ефективність проведених лікувальних заходів та про те, що запропонований опитувальник не може бути використаним для діагностики недостатності або дефіциту ВD, а рекомендується лише для виявлення груп пацієнтів, які підлягають лабораторній діагностиці.
На основі розробленого опитувальника створено також електронну версію в онлайн-сервісі для проведення тестувань — Google Forms. Це частина офісного інструментарію Google Drive достатньо зручна і надає можливість дистанційного тестування пацієнтів. У результаті тестування надається можливість не лише переглянути результати по кожному респонденту окремо, але й визначити загальну статистику розподілу серед когорти опитаних. Сервіс формує таблицю у форматі Excel, в яку автоматично заносяться всі отримані результати анкетування, що значно полегшує статистичну обробку даних та звітність.
Анкетування є найбільш зручним, легкодоступним, швидким методом дослідження для проведення скринінгу під час профілактичних та диспансерних оглядів дітей. Наведений опитувальник дозволяє відокремити групи пацієнтів із ризиком недостатності або дефіциту вітаміну D для визначення в них концентрації 25ОНD та подальшого моніторування, що є корисним у клінічній практиці дитячого ревматолога, сімейного лікаря та педіатра і дозволяє вирішити питання необхідності призначення препаратів вітаміну D.
Висновки
1. У дітей з ЮІА необхідним є визначення наявності факторів ризику зниження забезпеченості організму вітаміном D для ідентифікації пацієнтів, які потребують дослідження концентрації 25OHD у сироватці крові з подальшим моніторуванням.
2. Розроблений опитувальник дозволяє зібрати інформацію, оцінити ризики розвитку недостатності вітаміну D та визначити базову когорту для проведення лабораторних досліджень. Тестування надає можливість дистанційного опитування пацієнта, перегляду результатів по кожному респонденту окремо і визначення загальної статистики розподілу дітей за рівнем забезпеченості вітаміном D серед когорти опитаних.
3. Використання опитувальника не може бути рекомендоване для діагностики недостатності або дефіциту ВD, а лише для відбору груп дітей, які потребують лабораторної ідентифікації ступеня забезпеченості організму вітаміном D.
4. Своєчасне призначення препаратів вітаміну D пацієнтам зі зниженим рівнем 25OHD у сироватці крові сприятиме підвищенню ефективності комплексного лікування ЮІА, профілактиці загострень основного захворювання і запобіганню розвитку коморбідних станів, пов’язаних із недостатнім забезпеченням організму вітаміном D.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 27.08.2021
Рецензовано/Revised 13.09.2021
Прийнято до друку/Accepted 16.09.2021

/14.jpg)
/15.jpg)
/16.jpg)