Журнал «Медицина неотложных состояний» Том 17, №6, 2021
Вернуться к номеру
Синдром острого повреждения почек сепсис-ассоциированного генеза
Авторы: Мальцева Л.А. (1), Новицкая-Усенко Л.В. (1), Никонов В.В. (2), Канчура Т.В. (1)
(1) — Днепропетровский государственный медицинский университет, г. Днепр, Украина
(2) — Харьковская медицинская академия последипломного образования, г. Харьков, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Мета дослідження — надати огляд даних, які стосуються гострого пошкодження нирок сепсис-асоційованого генезу, що ґрунтується на аналізі літературних даних, отриманих при бібліографічному пошуку в PubMed, «Клінічних практичних рекомендаціях KDIGO щодо гострого ниркового пошкодження», в окремих зарубіжних і вітчизняних авторів, на основі багаторічного особистого досвіду. Наведено концепцію стадійного перебігу гострого пошкодження нирок (ГПН), що надає можливість потенційного подолання і зворотного розвитку його ранніх стадій, у зв’язку з цим важливого значення набуває рання діагностика для початку раннього лікування ГПН. Проблема розглянута зважаючи на появу нових даних щодо діагностики, факторів ризику розвитку, патогенезу ГПН сепсис-асоційованого генезу; термінологічно окреслена його клінічна форма: парадигма зміщується від ішемії та вазоконстрикції до гіперемії та вазодилатації, від гострого канальцевого некрозу до гострого канальцевого апоптозу. Сепсис сприяє розвитку ГПН: при сепсисі ГПН зустрічається у 19 % пацієнтів, при септичному шоці — у 45 %, летальність при ГПН у септичних пацієнтів становить 73 %, у несептичних — 45 %. Для ефективної діагностики функціонального стану нирок і проведення нефропротекторної терапії застосовуються стратифікаційні шкали оцінки тяжкості гострого пошкодження нирок, засновані на визначенні креатиніну плазми крові та обсягу відокремлюваної сечі: RIFLE, AKIN, KDIGO; найбільш сучасною та досконалою вважається шкала KDIGO. Встановлено, що креатинін плазми крові не є раннім біомаркером ГПН, що свідчить про доцільність використання інших інтегральних показників. Біомаркери ГПН — це речовини, які або беруть участь у патологічному процесі, або є його свідками, виконуючи діагностику ГПН ще до підвищення рівня креатиніну плазми крові. Надана характеристика структури, ролі функцій таких біомаркерів, як NGAL, Cistatin C, IL-18, KIM-1. Інтенсивна терапія ГПН сепсис-асоційованого генезу включає стандартну терапію згідно з Surviving Sepsis Campaing 2016 і клінічними практичними рекомендаціями KDIGO. Велику увагу приділено замісній нирковій терапії (ЗНТ): показанням до початку, факторам, що впливають на початок ЗНТ, термінам початку, шляхам оптимізації, термінам припинення ЗНТ, рекомендаціям щодо дози ЗНТ, дозі замісної ниркової терапії саме при сепсис-асоційованому ГПН; вибору методу, перевагам і недолікам постійної ЗНТ та інтермітуючого гемодіалізу; медикаментозному супроводу постійної ЗНТ.
Цель работы — представить обзор данных, касающихся острого повреждения почек сепсис-ассоциированного генеза, основанный на анализе литературных данных, полученных при библиографическом поиске в PubMed, «Клинических практических рекомендациях KDIGO по острому почечному повреждению», у отдельных зарубежных и отечественных авторов, на основе многолетнего личного опыта. Приведена концепция стадийного протекания острого повреждения почек (ОПП), которая создает возможность потенциальной преодолимости и обратимости его ранних стадий, в связи с чем большое значение приобретает диагностика для начала своевременного лечения ОПП. Проблема рассмотрена в ключе появления новых данных о диагностике, факторах риска развития, патогенезе ОПП сепсис-ассоциированного генеза; терминологически очерчена его клиническая форма: парадигма смещается от ишемии и вазоконстрикции к гиперемии и вазодилатации, от острого канальцевого некроза к острому канальцевому апоптозу. Сепсис способствует развитию ОПП: при сепсисе ОПП встречается у 19 % пациентов, при септическом шоке — у 45 %, летальность при ОПП у септических пациентов составляет 73 %, у несептических — 45 %. Для эффективной диагностики функционального состояния почек и проведения нефропротективной терапии применяются стратификационные шкалы оценки тяжести острого повреждения почек, основанные на определении креатинина плазмы крови и объема отделяемой мочи: RIFLE, AKIN, KDIGO; наиболее современной и совершенной считается шкала KDIGO. Установлено, что креатинин плазмы крови не является ранним биомаркером ОПП, что свидетельствует о целесообразности использования других интегральных показателей. Биомаркеры ОПП — это вещества, которые либо участвуют в патологическом процессе, либо являются его свидетелями, осуществляя диагностику ОПП еще до повышения уровня креатинина плазмы крови. Дана характеристика структуры, роли функций таких биомаркеров, как NGAL, Cistatin C, IL-18, KIM-1. Интенсивная терапия ОПП сепсис-ассоциированного генеза включает стандартную терапию, соответствующую Surviving Sepsis Campaing 2016 и клиническим практическим рекомендациям KDIGO. Большое внимание уделено заместительной почечной терапии (ЗПТ): показаниям к ее началу, факторам, влияющим на начало ЗПТ, срокам начала, путям оптимизации, срокам прекращения ЗПТ, рекомендациям по дозе ЗПТ, дозе заместительной почечной терапии именно при сепсис-ассоциированной ОПП, выбору метода, преимуществам и недостаткам постоянной ЗПТ и интермиттирующего гемодиализа, медикаментозному сопровождению постоянной ЗПТ.
Acute kidney injury (AKI) is a condition that develops as a result of a rapid decrease in the glomerular filtration rate, which leads to the accumulation of nitrogenous, including urea and creatinine, and non-nitrogenous metabolic products with electrolytic disorders, impairment of the acid-base balance, and the volume of fluid excreted by the kidneys. Objective: to provide a review of the literature concerning sepsis-associated acute kidney injury. We presented the problems of diagnosis, risk factors, the pathogenesis of sepsis-associated acute kidney injury, as well as to outline terminologically the clinical form of sepsis-associated acute kidney injury: the paradigm shifts from ischemia and vasoconstriction to hyperemia and vasodilation, from acute tubular necrosis to acute tubular apoptosis. Sepsis contributes significantly to the development of AKI: in sepsis, it occurs in 19 % of patients; nevertheless, it is much more frequent in septic shock (45 % of cases), the mortality of individuals with AKI is especially high in non-septic and septic conditions (45 and 73 %, respectively). To effectively diagnose the functional state of the kidneys and conduct nephroprotective therapy, stratification scales for assessing the severity of acute kidney damage are applied, which are based on the determination of plasma creatinine level and urine output: RIFLE (risk, injury, failure, loss of kidney function, and end-stage renal failure), AKIN (Acute Kidney Injury Network), KDIGO (Kidney Disease Improving Global Outcomes); the experts considered KDIGO scale more modern and perfect. It has been found that plasma creatinine is not an early biomarker of AKI that indicates the advisability of using other integral indicators. AKI biomarkers are substances that either participate in the pathological process or witness it allowing diagnose AKI even before an increase in plasma creatinine level. The characteristics of the structure, role of functions of such biomarkers as neutrophil gelatinase-associated lipocalin, cystatin C, interleukin-18, kidney injury molecule-1 and others are given. Intensive care for sepsis-associated acute kidney injury includes the standard therapy corresponding to 2016 Surviving Sepsis Campaign and KDIGO guidelines. Also, the paper focuses on renal replacement therapy (RRT): renal and extrarenal indications for the initiation, factors affecting the initiation of RRT, the timing of initiation, ways of optimization, the timing of RRT discontinuation, recommendations for the dose of RRT, the dose of renal replacement therapy in sepsis-associated AKI, choice of method, advantages and disadvantages of continuous RRT and intermittent hemodialysis, medication support for continuous therapy, the role of hemodialysis machine in the intensive care unit.
сепсис; гостре пошкодження нирок; біомаркери; огляд
сепсис; острое повреждение почек; биомаркеры; обзор
sepsis; acute kidney injury; biomarkers; review
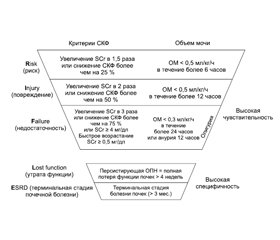
Диагностические критерии острого повреждения почек
Интенсивная терапия
- Kellum J.A., Lameire N.; KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit. Care. 2013. № 17. Р. 204-2013.
- Полунин Ю.С., Соколов Д.В. Нарушение почечной функции у пациентов в критическом состоянии. Вестник анестезиологии и реаниматологии. 2018. № 15(5). С. 54-64.
- Coca S.G., Singanamala S., Chirag R. Parikh Chronic Kidney Disease after Acute Kidney Injury: A Systematic Review and Meta-analysis. Kidney Int. 2012 Mar. № 81(5). Р. 442-448.
- Hazel Z., Wald R., Bargman J.M. et al. Neprologists follow-up improves all-cause mortality of severe acute Kidney injury survivors. Kidney International. 2013. № 83(5). Р. 901-908.
- Рей С.И., Бердников Г.А., Васина Н.В. Острое почечное повреждение 2020: эпидемиология, критерии диагностики, показания, сроки начала и модальность заместительной почечной терапии. Анестезиология и реаниматология. 2020. № 5.
- Hoste E.A., Bagsshow S.M., Bellomo R. et al. Epidemiology of acute Kidney injury in critically ill patients: the multinational AKI-EPI study. Intensive Care Medicine. 2015. № 41(8). Р. 1411-1423.
- Вельков В.В. Сепсис и острое повреждение почек — дорога с двухсторонним движением: значение биомаркеров. Мед. алфавит. Современная лаборатория. 2019. Т. 1. № 4. С. 65.
- Cole L., Bellomo R., Silvester W. et al. A prospective, multicenter study of the epidemiology, management and outcome of severe acute renal failure in a «closed» ICU system. Am. J. Respir. Crit. Care Med. 2000. Vol. 162. Р. 191.
- Vincent J. L., Sakr Y., Sprung C. L. et al. Sepsis in European intensive care units: results of the SOAP study. Crit. Care Med. 2006 Feb. № 34(2). Р. 344-53.
- Poukkanen M., Vaara S.T., Pettilä V. et al. Acute kidney injury in patients with severe sepsis in Finnish Intensive Care Units. Acta Anaesthesiol Scand. 2013 Aug. № 57(7). Р. 863-72.
- Bellomo R., Kellum J.A., Ronco C. et al. Acute kidney injury in sepsis. Intensive Care Med. 2017 Mar 31. № 43(6). Р. 816-828.
- Bagshaw S.M., Uchino S., Bellomo R. et al. Septic acute kidney injury in critically ill patients: clinical characteristics and outcomes. Clin. J. Am. Soc. Nephro. 2007 May. № 2(3). Р. 431-439.
- Zhi D.Y., Lin J., Zhuang H.Z. et al. Acute Kidney Injury in Critically Ill Patients with Sepsis: Clinical Characteristics and Outcomes. J. Invest. Surg. 2019 Dec. № 32(8). Р. 689-696.
- Клинические практические рекомендации KDIGO по острому почечному повреждению. Нефрология и диализ. 2012. Т. 14. № 2. С. 86-94.
- Smirnova N.N., Galkina O.V., Novikova V.P., Prokopyeva N.E. Modern biomarkers of renal in pediatrics. Nephrology. 2019. № 23(4). P. 112-118.
- Haase M., Bellomo R., Devarajan P. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis acute kidney injurea: a systematic review and meta-analysis. Am. J. Kidney Dis. 2009. № 54(6). P. 1012-1024.
- Martensson J.I., Bellomo R. The rise and fall of NGAL in acute kidney injury. Blood Purif. 2014. 37(4). Р. 304-310.
- Zhang A., Cai Y., Peng-Fei Wang et al. Diagnosis and prognosis of neutrophil gelatinase-associated lipocalin for acute kidney injury with sepsis: a systematic review and meta-analysis. Crit. Care. 2016 Feb 16. № 20. Р. 41.
- Kim S., Kim H.J., Ahn H.S. et al. Is plasma neutrophil gelatinase-associated lipocalin a predictive biomarker for acute kidney injury in sepsis patients? A systematic review and meta-analysis. J. of Critical Care. 2016 June. Vol. 33. P. 213-223.
- Leem A.Y. et al. Value of Serum Cystatin C Measurement in the Diagnosis of Sepsis-Induced Kidney Injury and Prediction of Renal Function Recovery. Yonsei Med. J. 2017 May. № 58(3). Р. 604-612.
- Wang K., Xie S., Xiao K. et al. Biomarkers of Sepsis-Induced Acute Kidney Injury. Biomed. Res. Int. 2018. № 24. Р. 6937-6947.
- Lin X., Yuan J., Zhao Y., Zha Y. Urine interleukin-18 in prediction of acute kidney injury: a systemic review and meta-analysis. J. Nephrol. 2015. № 28. Р. 7-16.
- Schrezenmeier E.V., Barasch J., Budde K., Westhoff T., Schmidt-Ot K.M. Biomarkers in acute kidney injury — pathophysiological basis and clinical performance. Acta Physiol (Oxf). 2017 Mar. № 219(3). Р. 554-572.
- Peralta C.A., Weekley C.C., Li Y., Shlipak M.G. Occult chro-nic kidney disease among persons with hypertension in the United States: data from the National Health and Nutrition Surveys 1988–1994 and 1999–2002. J. Hypertens. 2013 Jun. № 31(6). Р. 1196-202.
- Bellomo R., Ronco C., Kellum J.A. et al. Acute renal fai-lure — definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit. Care. 2004. № 8(4). Р. 204-212.
- Rhodes A., Evans I.E., Alhazzani W., Levy M.M. et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Critical Care Medicine. 2017. № 45(3). Р. 304-377.
- Багин В.А. Острое повреждение почек при сепсисе: эпидемиология, факторы риска и показания к заместительной терапии. Автор. дисс. к.м.н. Екатеринбург, 2011.
- Форни Л.Дж., Ричи З., Рoнко К. Экстракорпоральная почечно-заместительная терапия в лечении сепсиса: текущее положение дел. Семинары по нефрологии. 2015. Т. 35. № 1. С. 55-63.
- Андрусев А.М., Ватазин А.В., Гуревич К.Я. и др. Клинические рекомендации по диагностике и лечению острого почечного повреждения. М., 2014. 27 с.

/49.jpg)