Журнал «Медицина неотложных состояний» Том 17, №6, 2021
Вернуться к номеру
Комплексний протокол проведення штучного кровообігу при кардіохірургічних втручаннях
Авторы: Черній В.І., Собанська Л.О.
Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
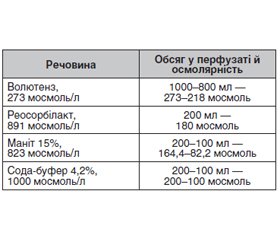
Актуальність. Сучасний підхід до зменшення негативного впливу штучного кровообігу (ШК) вимагає комплексного вирішення. Найбільш актуальними питаннями залишаються профілактика й усунення гіпоксії, склад первинного об’єму заповнення оксигенатора, стан еритроцитів і їх енергетичний потенціал, рівень гемолізу, патогенетичний підхід до корекції електролітів під час перфузії, а також біосумісність екстракорпорального контура. Мета: створити протокол проведення штучного кровообігу, який включав би можливість зниження негативного впливу синтетичних полімерів екстракорпорального контура; зменшення гідродинамічного навантаження на тканини; проведення більш фізіологічної корекції кислотно-лужного стану; усунення енергетичного дефіциту клітин; проведення корекції електролітного балансу під час штучного кровообігу з урахуванням етапів операції. Матеріали та методи. У дослідження увійшло 225 хворих, яким виконані кардіохірургічні операції з використанням штучного кровообігу. Пацієнти були розподілені на 3 групи. У першу групу ввійшли пацієнти (n = 75), у яких екстракорпоральний контур оброблявся адаптуючою композицією за спеціальною методикою. У результаті центрифугування крові пацієнта отримували сироватку, яку розводили в розчині 0,9% NaCl, і обробляли контур оксигенатора. До другої групи були включені пацієнти (n = 75), у яких у схемі проведення перфузії використовувався препарат фруктозо-1,6-дифосфат (ФДФ). Препарат вводили внутрішньовенно в дозі 10 г зі швидкістю 10 мл/хв у два етапи: 5 г ФДФ вводилися безпосередньо перед початком перфузії і 5 г — перед зігріванням пацієнта. Третя група була контрольною. Перфузія проводилась за допомогою мембранного оксигенатора в режимі непульсуючого кровотоку з первинним об’ємом заповнен-ня 1,3–1,6 л для досягнення помірної гемодилюції (Ht – 25 ± 2 г/л). Використовували гіперосмолярний первинний об’єм заповнення оксигенатора із загальною осмолярністю до 510,6 ммоль/л. Базисними розчинами були волютенз, реосорбілакт, маніт 15%, сода-буфер 4,2%. Досліджували гемограму (Hb, Ht, MCV, MCH, MCHC, RDWa, RDW%, гемоліз), кисневий транспорт: сатурацію артеріальної (SaO2) і венозної крові (SvO2), парціальний тиск кисню в артеріальній (PaO2) і венозній крові (PvO2), індекс доставки кисню (IDO2), індекс споживання кисню (IVO2), екстракцію кисню (O2ER) та індекс екстракції кисню (O2EI). Відповідно до мазків крові проводили вивчення морфологічних змін еритроцитів. Результати. Наші дослідження були спрямовані на те, щоб за їх результатом розробити й увести в практику оптимізований протокол проведення штучного кровообігу. У попередніх роботах було показано, що обробка контура оксигенатора адаптуючою композицією створює захисний шар з автоальбуміну на внутрішній поверхні екстракорпорального контура, а використання під час перфузії препарату з діючою речовиною фруктозо-1,6-дифосфат дозволяє скорегувати гіпофосфатемію, усунути енергетичний дефіцит клітини. У цих двох групах порівняно з контрольною після закінчення перфузії був менший рівень гемолізу, менша кількість ехіноцитів і сфероцитів. У трьох групах використовували гіперосмолярний первинний об’єм заповнення оксигенатора. До перфузії показники були такими: IDO2 — 332,0 ± 84,84 мл/(хв ∙ м2), IVO2 — 76,07 ± 28,34 мл/(хв ∙ м2), O2ЕR — 22,91 ± 6,33 %, O2EI — 22,47 ± 6,32 %, BE = –0,78 ± 2,13 ммоль/л. На 10-й хвилині ШК IDO2 — 579,7 ± 112,3 мл/(хв ∙ м2), IVO2 — 30,91 ± 13,31мл/(хв ∙ м2), O2ЕR — 5,35 ± 2,07 %, O2EI — 5,26 ± 2,08 %, BE = 0,82 ± 2,03 ммоль/л. IDO2 виріс за рахунок роботи оксигенатора, а зниження IVO2, O2ЕR, O2EI можна пояснити охолодженням хворого. На етапі зігрівання: IDO2 — 598,8 ± 114,9 мл/(хв ∙ м2), IVO2 — 108,1 ± 33,11 мл/(хв ∙ м2), O2ЕR — 18,04 ± 4,14 %, O2EI — 17,95 ± 4,15 %, BE = –0,11 ± 8,88 ммоль/л. Після ШК: IDO2 — 305,7 ± 60,90 мл/(хв ∙ м2), IVO2 — 77,15 ± 24,29 мл/(хв ∙ м2), O2ЕR — 25,36 ± 6,5 %, O2EI — 25,34 ± 6,5 %, BE = –0,36 ± 2,20 ммоль/л. Після перфузії темп діурезу становив 11,88 ± 5,31 мл/кг/год, відносний гідробаланс — 9,67 ± 8,12 мл/кг. Запропонований нами протокол проведення штучного кровообігу включає основні ланки: 1) обробка контура оксигенатора адаптуючою композицією; 2) введення за схемою препарату фруктозо-1,6-дифосфату пацієнтам з початковим низьким рівнем фосфору; 3) використання гіпер-осмолярного первинного об’єму заповнення оксигенатора; 4) корекція електролітів з урахуванням етапів кардіохірургічної операції. Висновки. Запропонована методика обробки екстракорпорального контура оксигенатора є простою і доступною, вона покращує біосумісність оксигенатора, застосування гіперосмолярного первинного об’єму заповнення оксигенатора дозволяє уникнути волемічного навантаження й забезпечує адекватну газотранспортну функцію крові, використання фруктозо-1,6-дифосфату сприяє зменшенню гемолізу й захисту еритроцитів, корекція електролітів з урахуванням етапів операцій враховує особливості штучного кровообігу.
Background. Innovative advances in cardiac surgery to reduce the negative impact of cardiopulmonary bypass (CPB) require a comprehensive solution. The ultimate questions of present interest remain the prevention of hypoxia, the composition of the priming volume of the oxygenator, the state of erythrocytes and their energy potential, the level of hemolysis, the pathogenetic approach to the correction of electrolytes during perfusion, as well as the biocompatibility of the extracorporeal circuit. The study aimed to create the protocol for cardiopulmonary bypass, which includes the possibility of reducing the negative effects of synthetic polymers of the extracorporeal circuit; reducing the hydrodynamic load on the tissue; carrying out a more physiological correction of the acid-base state; improving the energy potential of cells; correction of electrolyte balance during cardiopulmonary bypass taking into account the stages of the surgical operation. Materials and methods. The study included 225 patients who underwent cardiac surgery using cardiopulmonary bypass. The patients were divided into three groups. The first group consisted of 75 people, whose extracorporeal contour was treated with the adaptive composition by a special technique. After centrifuging the patient’s blood, serum was obtained, which was diluted in a solution of 0.9% NaCl and treated with the oxygenator circuit. The second group included patients (n = 75) in whom fructose-1,6-diphosphate (FPD) was used in the perfusion regimen. The drug was administered intravenously at a dose of 10 g at a rate of 10 ml/min in two stages: 5 g of FPD were injected immediately before the start of perfusion and 5 g before the patient was warmed up. The third group was the control group. Perfusion was performed using a membrane oxygenator in a non-pulsating blood flow mode with a prime of 1.3–1.6 L to achieve moderate hemodilution (Ht — 25 ± 2 g/L). A hyperosmolar priming volume with a total osmolarity of up to 510.6 mmol/L was used. The basic solutions were volutens, reosorbilact, mannitol 15%, Soda-buffer 4.2%. Hemogram (Hb, Ht, MCV, MCH, MCHC, RDWa, RDW%, hemolysis), oxygen transport: saturation of arterial (SaO2%) and venous blood (SvO2%), partial pressure of oxygen in arterial (PaO2) and venous blood (PvO2), oxygen delivery index (IDO2), oxygen consumption index (IVO2), oxygen extraction (O2ER), and oxygen extraction index (O2EI) were studied. The research of morphological changes in erythrocytes was carried out. Results. Our study aimed to develop and implement into practice an optimized cardiopulmonary bypass protocol based on the results obtained. The previous studies have shown that treatment of the oxy-genator circuit with the adaptive composition creates a protective layer of autoalbumin on the inner surface of the extracorporeal circuit, and the use of a drug with the active fructose-1,6-diphosphate ingredient during perfusion allows correcting hypophosphatemia, reducing the energy deficiency of the cells. In these two groups, in comparison with the control one, after CPB, there was a lower level of hemolysis, a lower number of echinocytes, and spherocytes. The three groups used the hyperosmolar priming volume. Before perfusion, there were the following indices: IDO2 — 332.00 ± 84.84 ml/(min • m2), IVO2 — 76.07 ± 28.34 ml/(min • m2), O2ЕR — 22.91 ± 6.33 %, O2EI — 22.47 ± 6.32 %, BE = –0.78 ± 2.13 mmol/L. At 10 min after CPB, there were the following indices: IDO2 — 579.7 ± 112.3 ml/(min • m2), IVO2 — 30.91 ± 13.31 ml / (min • m2), O2ER — 5.35 ± 2.07 %, O2EI — 5.26 ± 2.08 %, BE = 0.82 ± 2.03 mmol/L. IDO2 increased due to the oxygenator gas exchange, and the decrease in IVO2, O2ЕR, O2EI can be explained by the patient’s cooling. At the warming stage, there were the indices: IDO2 — 598.8 ± 114.9 ml/(min • m2), IVO2 — 108.10 ± 33.11 ml/(min • m2), O2ER — 18.04 ± 4.14 %, O2EI — 17.95 ± 4.15 %, BE = –0.11 ± 8.88 mmol/L. IDO2 — 305.7 ± 60.9 ml / min • m2), IVO2 — 77.15 ± 24.29 ml/(min • m2), O2ЕR — 25.36 ± 6.5 %, O2EI — 25.34 ± 6.5 %, BE = –0.36 ± 2.20 mmol/L. After CPB, the rate of diuresis was 11.88 ± 5.31 ml/kg/h, the relative hydrobalance after CPB was 9.67 ± 8.12 ml/kg. Our proposed protocol for cardiopulmonary bypass includes the basic points: 1) treatment of the oxygenator contour with the adaptive composition; 2) in patients with an initially low level of phosphorus, administration of the drug of fructose-1,6-diphosphate by the scheme; 3) the use of a hyperosmolar priming volume of the oxygenator; 4) correction of electrolytes taking into account the stages of cardiac surgery. Conclusions. The proposed procedure for the treatment of the extracorporeal oxygenator circuit is simple and affordable, improves the biocompatibility of the oxygenator. The use of a hyperosmolar priming volume avoids the volume load and provides an adequate gas transport function of the blood. The application of FPD makes it possible to reduce hemolysis and protect erythrocytes, correct electrolytes by taking into account the stages of operations and the peculiarities of CPB.
штучний кровообіг; оксигенатор; гіпофосфатемія; фруктозо-1,6-дифосфат; адаптуюча композиція; гемоліз; фосфор
cardiopulmonary bypass; hypophosphatemia; fructose-1,6-diphosphate; adaptive composition; hemolysis; phosphorus
Вступ
Матеріали та методи
Результати та обговорення
/68.jpg)
Висновки
- Grygorczyk R., Orlov S.N. The effect of hypoxia on the properties of erythrocyte membranes — importance for intravascular hemolysis and purinergic blood flow control. Front. Physiol. 2017. № 22. https://doi.org/10.3389/fphys.2017.01110.
- Cherniy V.I., Sobanska L.O., Topolov P.O., Cherniy T.V. Influence of cardiopulmonary bypass on the erythrocyte membranes and the method of its protection. Medical perspectives. 2021. Vol. 33. № 1. P. 85 -90. https://doi.org/10.26641/2307-0404.2021.1.227936.
- Bilfinger T.V. Should We Pay More Attention to the Pump-Prime? Ann. Thorac. Surg. 2020. Vol. 110. № 5. Р. 1548. https://doi.org/10.1016/j.athoracsur.2020.03.044.
- Brauer S.D., Applegate R.L., Jameson J.J. et al. Association of plasmadilution with cardiopulmonary bypass-associated bleeding and morbidity. J. Cardiothorac. Vasc. Anesth. 2013. Vol. 27. P. 845-852. doi: 10.1053 / j.jvca.2013.01.011.
- Ranucci M., Conti D., Castelvecchio S., Menicanti L., Frigiola A., Ballotta A., Pelissero G. Hematocrit on cardiopulmonary bypass and outcome after coronary surgery in nontransfusedpatients. Ann. Thorac. Surg. 2010. Vol. 89. № 1. P. 7-11. https://doi.org/10.1016/j.athoracsur.2009.07.078.
- Habib R.H., Zacharias A., Schwann T.A. et al. Role of hemodilutional anemia and transfusion during cardiopulmonary bypass in renal injury after coronary revascularization: implications on operative outcomes. Crit. Care Med. 2005. Vol. 33. № 8. P. 1749-1756. DOI: 10.1097/01.ccm.0000171531.06133.b0.
- Ranucci M., Biagioli B., Scolletta S. et al. Lowest hematocrit on cardiopulmonary bypass impairs the outcome in coronary surgery. Tex. Heart. Inst. J. 2006. Vol. 33. № 3. P. 300-305. PMC1592281.
- Батюк А.М. Клинико-лабораторные аспекты применения перфузата с различной осмолярностью при операциях реваскуляризации миокарда в условиях искусственного кровообращения: дис... канд. мед. наук: 14.00.37. Новосибирск, 2009. 116 с.
- Ломиворотов В.В., Ефремов С.М., Шмырев В.А., Князькова Л.Г. Эффективность и безопасность использования альбумина, волювена, гелофузина и физиологического раствора при кардиохирургических вмешательствах. Патология кровообращения и кардиохирургия. 2009. № 3. С. 43-47.
- Евсеев А.К., Журавель С.В., Алентьев А.Ю., Горончаровская И.В., Петриков С.С. Мембраны в технологии экстракорпоральной оксигенации крови. Мембраны и мембранные технологии. 2019. Т. 9. № 4. С. 235-246.
- Алентьев А.Ю., Богданова Ю.Г., Должикова В.Д. и др. Оценка гемосовместимости полимерных мембранных материалов для оксигенации крови. Мембраны и мембранные технологии. 2020. Т. 10. № 6. С. 393-408.
- Iwahashi H., Yuri K., Nose Y. Development of the oxygenator: past, present and future. J. Artif. Organs. 2004. Vol. 7. № 3. P. 111-120. https://doi.org/10.1007/s10047-004-0268-6.
- Собанська Л.О., Черній В.І., Лазаренко О.М., Алєксє-єва Т.А., Лазаренко Г.О. Спосіб обробки поверхні контуру оксигенатора при кардіохірургічних операціях: пат. 140413 Україна. № 201908112; заявл. 15.07.2019; опубл. 25.02.2020, бюл. № 4/2020.
- Собанська Л.О., Черній В.І., Лазаренко О.М., Алєксє-єва Т.А., Лазаренко Г.О. Адаптуюча композиція для обробки внутрішньої поверхні контуру оксигенатора при кардіохірургічних операціях: пат. 141109 Україна. № 201908457; заявл. 17.07.2019; опубл. 25.03.2020, бюл. № 6/2020.
- Собанська Л.О., Черній В.І. Склад розчинів для заповнення первинного об’єму оксигенатора: пат. 140427 Україна. № 201908289; заявл. 16.07.2019; опубл. 25.02.2020, бюл. № 4/2020.
- Cherniy V.I., Sobanska L.O., Shestak N.V. Protection of red blood cells during cardiopulmonary bypass. Clinical and Preventive Medicine. 2021. Vol. 1. № 15. P. 12-21. https://doi.org/10.31612/2616-4868.1(15).2021.02.
- Cherniy V.I., Sobanska L.O., Lazarenko O.M., Lazarenko G.O., Alekseeva T.A. Influence of oxygenator extracorporal circuit treatment with adaptation composition (AdC) on morphological changes of erythrocytes. Clinical and Preventive Medicine. 2020. Vol. 3. № 13. P. 86-97. DOI: https://doi.org/10.31612/2616-4868.3(13).2020.10.
- Wang D., Xiang L., Luo J. Preliminary study of colloid osmotic pressure for cardiopulmonary bypass. Zhonghua Wai Ke Za Zhi. 1996. Vol. 34. № 12. P. 751-3. PMID: 9590779.
- Мороз В.В., Герасимов Л.В., Исакова А.А., Марченков Ю.В., Родионов Е.П. Влияние различных инфузионных растворов на микрореологию. Общая реаниматология. 2010. Т. VI. № 6. C. 10-11.
- Лишневская В.Ю. Малообъемная инфузионная терапия в практике врача кардиолога. Український хіміотерапевтичний журнал. 2012. № 3(26). С. 108-110.
- Черний В.И., Прокопенко Б.Б., Тюменцева В.Г., Шраменко Е.К. Коррекция кислотно-основного состояния раствором сода-буфер в комплексной интенсивной терапии диабетического кетоацидоза. Медицина неотложных состояний. 2010. № 2 (27). С. 90-94.
- Корнилов И.А., Пономарев Д.Н., Шмырев В.А., Скопец А.А., Синельников Ю.С., Ломиворотов В.В. Физиологические параметры искусственного кровообращения с точки зрения доказательной медицины (часть 2). Вестник анестезиологии и реаниматологии. 2016. Т. 13. № 3. С. 26-42. DOI 10.21292/2078-5658-2016-13-3-29-42.

/69.jpg)