Вступ
Застосування нестероїдних протизапальних препаратів (НПЗП) асоційовано з широким спектром небажаних реакцій із залученням шлунково-кишкового тракту (ШКТ), серцево-судинної системи та нирок. Широке безрецептурне призначення НПЗП призводить до безконтрольного їх застосування серед населення, що в низці випадків робить неможливою профілактику та своєчасне виявлення небажаних лікарських реакцій [1].
Гастроінтестинальні побічні реакції виникають найчастіше та можуть мати варіативні прояви — від диспепсії, печії чи дискомфорту до більш серйозних і загрозливих для життя станів, таких як кровотечі та перфорації. Слід відзначити, що 80 % випадків кровотеч з верхніх відділів ШКТ перебігають практично безсимптомно, що пов’язано в першу чергу з аналгетичною дією НПЗП [1]. У роботі японських вчених [2] показано, що застосування НПЗП призводить до підвищення ризику кровотеч з товстої кишки у 2,3 раза, зокрема при застосуванні коксибів — у 2,8 раза, а при комбінованому застосуванні з ацетилсаліциловою кислотою — у 4,3 раза.
Негативний вплив НПЗП на стан усіх відділів ШКТ обумовлений єдиним патогенетичним механізмом — інгібуванням циклооксигенази першого типу (ЦОГ-1) у незміненій слизовій оболонці (СО) та ЦОГ-2 в ділянці ерозивно-виразкових змін, з пригнічуванням синтезу цитопротективних простагландинів, що викликає мікроциркуляторні порушення, знижує активність метаболізму епітеліоцитів та ін. Тим самим НПЗП зменшують репаративний потенціал СО, роблячи її менш стійкою до шкідливої дії природних факторів агресії — соляної кислоти в проксимальних відділах і насиченого ферментами, жовчю, бактеріями і продуктами їх життєдіяльності хімусу в дистальних відділах ШКТ [2].
На сьогодні з метою корекції ульцерогенної дії НПЗП застосовують дуже широке коло лікарських засобів — інгібітори протонної помпи (ІПП), Н2-гіста-міноблокатори, синтетичні аналоги простагландинів і стимулятори їх синтезу та ін., однак всі вони не позбуті власних побічних ефектів, а їх ефективність не завжди здатна задовольнити клініцистів.
Як можливий засіб корекції ульцерогенної дії НПЗП нашу увагу привернули біологічні препарати, а саме кріоконсервований екстракт плаценти (КЕП, кріоцелл-кріоекстракт плаценти (ДП «МНЦ кріобіології і кріомедицини НАН, НАМН та МОЗ України», м. Харків, Україна)). Добре відомо, що плацентарна тканина містить широкий набір діючих на організм речовин: гормони та гормоноподібні речовин, білки, поліпептиди, нуклеїнові кислоти, ліпіди, вітаміни тощо [5, 8].
Багаторічні дослідження показали, що екстракт плаценти впливає на органи-мішені, стимулюючи їх функціонування, і підвищує неспецифічну резистентність організму до несприятливих факторів зовнішнього середовища та стресових чинників, стимулює репаративні властивості клітин при пошкодженнях і захворюваннях різного генезу [5].
Серед численних НПЗП для дослідження обрано похідне пропіонової кислоти — ібупрофен (ібупрофен-Дарниця, ПрАТ «Фармацевтична фірма «Дарниця», м. Київ, Україна). Ібупрофен застосовують у дітей старше 6 міс. як безрецептурний засіб та з 3 міс. — за рекомендацією лікаря, що свідчить про низьку токсичність препарату та мінімальну кількість побічних реакцій. Проте при тривалому застосуванні (понад 7–14 днів) навіть ібупрофен у низьких дозах (800 мг/добу) може призвести до ураження ШКТ [3, 7].
Мета дослідження: охарактеризувати цитопротективні властивості кріоконсервованого екстракту плаценти за станом СО проксимальних (стравохід і шлунок) і дистальних (тонка та товста кишки) відділів ШКТ на моделі ібупрофен-індукованої езофагогастроентероколонопатії (ЕГЕКП).
Планування (методологія) досліджень
Досягнення поставленої мети реалізовано в 7 етапів:
— І — опрацювання сучасних літературних відомостей і вибір доз ібупрофену, езомепразолу та КЕП відповідно до мети дослідження;
— ІІ — моделювання ібупрофен-індукованої ЕГЕКП та профілактично-лікувальне застосування досліджуваних засобів корекції;
— ІІІ — макроскопічна оцінка СО стравоходу;
— ІV — макроскопічна оцінка СО шлунка;
— V — макроскопічна оцінка СО тонкої кишки;
— VІ — макроскопічна оцінка СО товстої кишки;
— VІІ — статистичне опрацювання отриманих даних та їх інтерпретація.
Матеріали та методи
Експериментальні дослідження in vivo проведені на 28 нелінійних лабораторних щурах-самцях масою 200–220 г, розподілених на 4 групи: І — інтактні щури (n = 7), ІІ група (контрольна) — щури з ібупрофен-індукованою ЕГЕКП (n = 7), ІІІ група — щури з ібупрофен-індукованою ЕГЕКП, яким у профілактично-лікувальному режимі вводили внутрішньом’язово (в/м) КЕП; ІV група (n = 7) — щури з ібупрофен-індукованою ЕГЕКП, яким у профілактично-лікувальному режимі за схемою, аналогічною введенню КЕП, внутрішньо-шлунково (в/шл) вводили інгібітор протонної помпи V покоління езомепразол (АТ «Актавіс», Ісландія) в дозі 50 мг/кг (5 ін’єкцій за 5 днів).
Використання езомепразолу як референс-препарату обумовлене наявністю достатньої доказової бази його ефективності як гастроцитопротективного препарату, у тому числі при НПЗП-індукованій гастропатії. У той же час, зважаючи на відсутність відомостей про його цитопротективну дію у тонкій та товстій кишці, порівняння вказаної активності між КЕП та зазначеним вище ІПП не проводили.
Усі експериментальні дослідження над лабораторними тваринами виконано з урахуванням вимог належної лабораторної практики «GLP» (Good Laboratory Practice), відображених в настанові «Лікарські засоби. Належна лабораторна практика», затвердженій Законом України наказом МОЗ України № 95 від 16 лютого 2009 р. і з дотриманням основних положень Конвенції Ради Європи про охорону хребетних тварин, що використовуються в експериментах та в інших наукових цілях від 18 березня 1986 р., Директиви Європейського парламенту та Ради ЄС 2010/63/ЄС від 22 вересня 2010 р. про захист тварин, які використовуються для наукових цілей, наказу МОЗ України від 14 грудня 2009 р. № 944 «Про затвердження Порядку проведення доклінічного вивчення лікарських засобів та експертизи матеріалів доклінічного вивчення лікарських засобів», Закону України від 21 лютого 2006 р. № 3447-IV «Про захист тварин від жорстокого поводження».
Комплексну програму досліджень розглянуто та погоджено комітетом з біоетики при Інституті проблем кріобіології і кріомедицини Національної академії наук України (витяг з Протоколу № 2 від 11 березня 2020 р.).
До початку експерименту щури впродовж 14 діб перебували в умовах карантину (Наказ № 755 від 12.08.1997 р. «Структура та утримання експериментальних біологічних клінік»), після чого проводилась рандомізація на групи по 7 особин в кожній із подальшим утриманням в умовах стандартного водно-харчового раціону (Наказ № 163 від 10.03.1996 р. «Про добові норми годування лабораторних тварин та продуцентів»). Упродовж усього експерименту контролювали масу тіла, оцінювали зовнішній вигляд і загальний стан тварин (поведінкові реакції, рефлекси, у тому числі харчовий тощо). Для уникнення впливу на експеримент добового ритму біологічної активності досліди виконували завжди у першій половині дня, з 8-ї до 11-ї години.
За 24 години до моделювання ібупрофен-індукованого ульцерогенезу щури були позбавлені доступу до їжі з вільним доступом до води (ad libitum) та знаходились у клітках із ґратчастим дном для усунення явища копрофагії.
Субхронічну ібупрофен-індуковану ЕГЕКП відтворювали шляхом внутрішньошлункового введення щурам ібупрофену в дозі 310 мг/кг (УД50) 1 раз/добу впродовж 3 днів [9]. Евтаназію тварин проводили через 24 год після останнього введення ібупрофену шляхом цервікальної дислокації під інгаляційним трихлорметановим (CHCl3) наркозом.
У дослідженнях використовували таблетовану лікарську форму ібупрофену (ПрАТ «Фармацевтична фірма «Дарниця», Україна), яку подрібнювали та емульгували у воді для ін’єкцій (ПАТ «Галичфарм», Україна) із додаванням полісорбату Twin-80 (поліоксіетилен-20-сорбітанмоноолеат), що обумовлено хімічною нейтральністю, низькою токсичністю та стійкістю до дії слабких кислот останнього.
Різниця цільової концентрації речовин у крові ссавців і людини, яка залежить від інтенсивності їх надходження та елімінації, обумовлює видові відмінності в дозах лікарських препаратів для досягнення еквівалентних ефектів. Тому для екстраполяції середньотерапевичних доз для людини на ізоефективні дози для щурів нами здійснено перерахунок за методом Ю.Р. Риболовлєва та співавт. (1979) із використанням коефіцієнту видової витривалості [3, 10]: для щурів — R = 3,62; для мишей — R = 3,20; для людини — R = 0,57.
Препарат КЕП (кріоцелл-кріоекстракт плаценти), згідно з інструкцією, застосовується у пацієнтів парентерально в разовій дозі 1,8 мл. Відповідно разова доза для щурів становить: 1,8 мл / 70 кг × 6,35 = 0,16 мл/кг маси тіла або відповідно 0,02 мл/100 г маси тіла щура.
Перед застосуванням препарату кріоцелл-кріоекстракт плаценти разову дозу (0,16 мл/кг) екстемпорально розводили у 0,9% р-ні NaCl (ПрАТ «Фармацевтична фірма «Дарниця», Україна) з розрахунку 0,1 мл 0,9% р-ну NaCl/100 г маси тіла та вводили в/м у профілактично-лікувальному режимі — 1 р/добу впродовж двох днів (сумарно 2 рази) до введення ібупрофену та через 60 хв після кожного введення НПЗП (сумарно 3 введення), усього 5 введень [5, 10].
Щурам контрольної групи в/шл вводили воду pro injectionibus (ПАТ «Галичфарм», Україна) з розрахунку 0,1 мл/100 г маси тіла.
Евтаназію тварин проводили шляхом цервікальної дислокації під інгаляційним наркозом.
Після видалення стравоходу з органокомплексу його розрізали у повздовжньому напрямку та проводили макроскопічну оцінку структури СО, враховуючи рекомендації міжнародної наукової номенклатурної групи Vevey (2011) про тяжкість езофагіту та розширення стандартної Лос-Анджелеської класифікації гастроезофагеальної рефлюксної хвороби, виокремлюючи нові стадії: M (мінімальні заміни, гіперемія, набряк СО стравоходу) та N (зміні відсутні) [14, 15].
Після лапаротомії по білій лінії живота (linea alba abdominis) проводили макроскопічну оцінку розмірів шлунка (здуття) та наявність спайкових процесів із суміжними органами як ознак перфорації. Екстирповані шлунки розкривали по великій кривизні, промивали у 0,9% р-ні NaCl та робили знімки за допомогою цифрового фотоапарату Canon PowerShot SX120 IS. Вплив досліджуваних лікарських засобів на стан шлунка оцінювали макроскопічно за такими критеріями: набряк, гіперемія та наявність крововиливів на поверхні слизової оболонки. Для кожної групи проводили розрахунок відсоткового складу піддослідних тварин за вказаними ознаками та середнє значення їх вираженості, яку оцінювали за такою шкалою: 0 балів — ознака відсутня, 1 бал — ознака слабко виражена, 2 бали — ознака помірно виражена, 3 бали — ознака добре виражена [3].
Крім того, проводили оцінку стану СО шлунка (СОШ) за бальною шкалою Л.В. Яковлевої (табл. 1) [3, 10].
Розрахунок інтегрального показника стану СОШ — ВІ проводили за формулою:
Статистичну обробку одержаних результатів проведено з використанням прикладної програми для роботи з електронними таблицями Microsoft Office Excel 2003; 2013 (Microsoft Corporation, США) за допомогою розширення Real Statistics (http://www.real-statistics.com/) Windows 7. Оцінку характеру розподілу величин у кожній групі вибіркової сукупності проводили з використанням W-критерію Шапіро — Уїлка (n < 50). Однорідність дисперсій визначали за критерієм Левена. Для оцінки значущості виявлених відмінностей досліджуваних показників за різних умов експерименту проводили статистичний аналіз з використанням параметричних або непараметричних критеріїв.
При нормальному розподілі незалежних величин відмінності між групами визначали попарно за t-критерієм Стьюдента. При ненормальному розподілі принаймні однієї з груп незалежних величин відмінності між ними визначали попарно за непараметричним ранговим U-критерієм Манна — Уїтні.
Вірогідність відмінностей між відсотковими частками якісних параметрів в альтернативній формі визначали за значенням F-критерію кутового перетворення Фішера.
Отримані значення порівнювали з критичними при рівні вірогідності вище 95 % (p ≤ 0,05), вище 99 % (p ≤ 0,01), вище 99,5 % (p ≤ 0,005) та вище 99,9 % (p ≤ 0,001) і робили висновок про ймовірність похибки.
Цифрові дані у разі нормального розподілу величин наведені у вигляді (M ± m) (M ± SE), де M — середнє арифметичне значення, m (SE) — стандартна похибка середнього арифметичного або М (95% ДІ 5–95 %), де 95% ДІ — 95% довірчий інтервал (Confidence interval — СІ). При ненормальному розподілі отриманих величин дані наведені у вигляді Ме [LQ; UQ], де Ме — медіана, [LQ; UQ] — верхня межа нижнього (першого) квартиля (lower quartile — LQ) та нижня межа верхнього (третього) квартиля (upper quartile — UQ) [4].
Результати
Макроскопічна оцінка стану шлунка (СОШ) показала, що триразове введення ібупрофену по 310 мг/кг призвело до розвитку ерозивно-виразкових змін у 100 % щурів. Так, геморагії, набряк і порушення складчастості СОШ мали місце в усіх тварин, а ВІ становив відповідно 2,9 (табл. 2, 3, рис. 1). Слід зазначити, що у 17,3 % тварин також відмічено ураження стравоходу.
Профілактично-лікувальне застосування КЕП призвело до статистично вірогідного (р = 0,02) зниження ВІ в 3,7 раза відносно показників тварин, яким вводили тільки ібупрофен, та становив відповідно 0,79 (табл. 3), а ерозивно-виразкові зміни СОШ відмічені лише у 57,1 % тварин.
Слід відзначити, що в групі комбінованого застосування ібупрофену та КЕП практично не відмічено набряку та порушення складчастості СОШ, що може вказувати на пригнічення запальних явищ в СО шлунка, індукованих ібупрофеном, які є відображенням гастриту, що, за даними літератури, може виникати у хворих, які застосовують НПЗП [6, 7, 11].
Комбіноване застосування ібупрофену та КЕП призвело до значного ослаблення всіх явищ ібупрофен-індукованої гастропатії у щурів — ВІ був нижчим у 3,7 раза (0,79) відносно показників тварин, які не отримували засоби корекції, здуття та порушення складчастості не мали місця, а геморагії, гіперемія та набряк виявлені лише у 14,3 % тварин. Встановлені зміни цілком узгоджувались з даними літератури щодо гастропротективних властивостей ІПП в профілактиці та лікуванні НПЗП-індукованої гастропатії [7, 13].
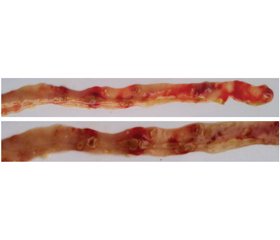
Дослідження стану СО тонкої кишки показало, що введення ібупрофену призвело до розвитку ентеропатії у 100 % тварин, на що вказувало формування в середньому (43,7 ± 2,1) виразкових дефектів на 10 см довжини кишки (табл. 4, рис. 2), з яких кожна дев’ята мала тенденцію до перфорації.
Застосування езомепразолу призвело до статистично вірогідного (р < 0,001) зниження загального числа виразкових дефектів СО тонкої кишки в 1,7 раза та становило відповідно (26,1 ± 2,5) виразок на 10 см довжини, а кількість перфоративних виразок знизилась відповідно вдвічі (р = 0,02).
Найбільш виражене послаблення ентеротоксичної дії ібупрофену відмічено на тлі застосування КЕП — виразкові дефекти СО тонкої кишки виявлені лише у 57,1 % тварин (табл. 4), а їх множинність була в 4,6 раза нижчою за показники тварин без корекції (р = 0,02). Таким чином, ентеропротективна активність КЕП становила відповідно 78,5 %.
Характеризуючи стан СО товстої кишки, слід відзначити, що трикратне введення ібупрофену у його ЛД50 (310 мг/кг) призвело до розвитку колонопатії у 100 % щурів — загальне число виразкових дефектів в СО становило в середньому (15,0 ± 1,5) на 10 см довжини (табл. 5).
Профілактично-лікувальне застосування езомепразолу не мало ефекту щодо показників множинності виразкових уражень СО товстої кишки, що цілком узгоджувалось з даними літератури про відсутність у вказаного засобу ентеро- та колонопротективної активності [12], загальне число виразкових дефектів в СО становило в середньому (14,1 ± 1,2) на 10 см довжини, однак призвело до зменшення (р = 0,3) кількості перфоративних виразок в 2 рази (табл. 5).
На тлі застосування КЕП множинність виразкових ушкоджень СО товстої кишки (табл. 5) була співставною з показниками ушкоджень в тонкій кишці — 57,1 %, а загальне число виразок в товстій кишці статистично вірогідно (р < 0,001) в 3,8 раза була нижчою за показники тварин, які отримували тільки ібупрофен.
Обговорення
Дослідження показало, що триразове введення ібупрофену по 310 мг/кг призвело до вірогідного ураження всіх відділів травного тракту — від стравоходу до товстої кишки, проте якщо зміни з боку стравоходу виявлені лише у 14,3 % тварин, то ураження шлунка і кишечника — у 100 % тварин.
Ураження СОШ характеризувалось формуванням виразної гіперемії та геморагій у 100 % щурів, а також здуттям шлунка у 71,4 % тварин, що опосередковано відображало й ураження тонкої кишки та порушення моторно-евакуаторної активності шлунка. Отримані дані узгоджуються з даними літератури про ульцерогенну дію ібупрофену в досліджуваній дозі [3, 9].
Порівнюючи за множинністю ураження кишечника, слід зазначити, що кількість виразок у тонкій кишці у 2,9 раза перевищувала аналогічні показники у товстій кишці. Це можна пов’язати з агресивним впливом жовчі на СО тонкої кишки на тлі ослаблення її захисних властивостей при формуванні ібупрофен-індукованої ентеропатії [11].
Профілактично-лікувальна ефективність ІПП езомепразолу ймовірно мала місце в проксимальних відділах ШКТ, однак встановлено, що практично не впливала на поширеність виразкових ушкоджень у кишечнику, хоча і мала тенденцію до зниження їх множинності. Це узгоджувалось з даними літератури про здатність ІПП знижувати ульцерогенну дію НПЗП виключно у шлунку [7, 12].
Встановлено, що застосування КЕП дещо поступалось за своєю гастропротективною активністю езомепразолу, проте у досліджуваного екстракту виявлено наявність вираженої ентеро- і колонопротективної дії на відміну від езомепразолу. Так, поширеність ібупрофен-індукованої як ентеро-, так і колонопатії на тлі застосування КЕП була майже вдвічі нижчою, ніж у щурів, які не отримували препаратів корекції. Встановлені цитопротективні властивості КЕП щодо СО тонкого та товстого кишечника узгоджуються із літературними відомостями про біологічні властивості (антиоксидантна, протизапальна, імуномодулююча та ін.) досліджуваного екстракту, які цілком вкладаються у патогенез токсичної дії НПЗП на ШКТ [5].
Обмеження дослідження. Дослідження обмежене об’ємом репрезентативної вибірки за різних умов експерименту. Результати експериментальних досліджень на даному етапі роботи доцільно розглядати лише як доклінічний етап вивчення можливості розширення показань до клінічного застосування КЕП. При оцінці ентеро- та колонопротективної активності КЕП порівняння зі специфічними засобами із вказаними видами активності не проводились, оскільки езомепразол має тільки гастроцитопротективну дію.
Перспективи подальших досліджень. Перспективним напрямком є вивчення цитопротективних властивостей КЕП на моделях ульцерогенезу, індукованого НПЗП інших хімічних груп (диклофенак натрію, ацетилсаліцилова кислота, мелоксикам, індометацин та ін.).
Висновки
1. Встановлено, що застосування кріоконсервованого екстракту плаценти у профілактично-лікувальному режимі має порівнянну з езомепразолом гастропротективну активність, на що вказувало статистично вірогідне (р < 0,05) зниження виразкового індексу відповідно в 2,6 та 3,7 раза відносно показників тварин з ібупрофен-індукованим ураженням слизової оболонки шлунка.
2. Встановлено наявність вираженої цитопротективної дії у кріоконсервованого екстракту плаценти на слизову оболонку кишечника, на що вказувала нижча множинність виразкових дефектів у тонкій та товстій кишці щурів у 4,6 та 3,8 раза відповідно відносно показників тварин контрольної групи.
Конфлікт інтересів. Автор рукопису свідомо засвідчує відсутність фактичного або потенційного конфлікту інтересів щодо результатів цієї роботи з фармацевтичними компаніями, виробниками біомедичних пристроїв, іншими організаціями, чиї продукти, послуги, фінансова підтримка можуть бути пов’язані з предметом наданих матеріалів або які спонсорували проведені дослідження.
Інформація про фінансування. Це дослідження є фрагментом планової науково-дослідної роботи відділу експериментальної кріомедицини Інституту проблем кріобіології і кріомедицини Національної академії наук України «Деструктивні та відновні процеси в тканинах in vivo після дії низьких температур та біологічно активних речовин» (шифр 2.2.6.113, номер державної реєстрації 0117U001049). Фінансування видатками державного бюджету України.
Отримано/Received 20.06.2021
Рецензовано/Revised 03.07.2021
Прийнято до друку/Accepted 10.07.2021
/28_2.jpg)

/27.jpg)
/29.jpg)
/28.jpg)
/30.jpg)
/29_2.jpg)
/30_2.jpg)