Вступ
Аналіз статистичного матеріалу [1] показав, що у 60–70 % хворих на рак стравоходу, шлунка і дванадцятипалої кишки (ДПК) на момент встановлення діагнозу є інкурабельність через поширеність пухлинного процесу або тяжкої супутньої патології. Основним клінічним симптомом раку стравоходу, вихідного відділу шлунка і ДПК є дисфагія та блювання, що виникають при обструкції просвіту у 50–75 % випадків. Це найчастіше відповідає III або IV стадії захворювання [2], коли пацієнти не можуть бути піддані радикальному лікуванню.
Для надання допомоги таким хворим можна застосовувати тільки паліативне лікування, спрямоване на відновлення харчування і тимчасове поліпшення якості життя. До хірургічних методів належать різні варіанти гастростомії або ентеростомії, які позбавляють пацієнтів можливості природного прийому їжі, погіршують якість життя, викликають соціальну дезадаптацію. Лише у невеликої групи пацієнтів без тяжкої супутньої патології проводять циторедуктивні операції [3].
Хворим з очікуваною тривалістю життя показано умовно радикальне хірургічне лікування, що забезпечує довгострокове відновлення прохідності, а у пацієнтів із прогнозованою більш короткою тривалістю життя показано ендоскопічне стентування з відновленням певного тимчасового рівня якості життя шляхом швидкого повернення до перорального прийому їжі [4].
Для зниження частоти ускладнень і забезпечення адекватної прохідності в ділянці стенозу важливо правильно вибрати стент. Пластикові стенти мають більш високу ймовірність міграції (саморозправні пластикові стенти) і перфорації (несаморозправні пластикові стенти), ніж саморозправні металеві стенти (англ. Self-Expandable Metallic Stent — SEMS) [5–7]. Металеві стенти можуть бути покриті мембраною, зробленою з різних полімерних матеріалів, що забезпечує високу стійкість до проростання пухлиною. Але ці стенти частіше втрачають функціональність через більш високу частоту міграції. Непокриті SEMS мають більш низькі показники міграції, оскільки закріплюються самою пухлиною, проте такі стенти пов’язані з більш частою повторюваністю симптомів, викликаних вростанням пухлини. Проте вони використовуються частіше, ніж покриті металеві стенти, при гастродуоденальній злоякісній обструкції, тому що в цілому мають кращі результати [5, 8–10].
У практиці використовують кілька поширених методів установки саморозправних стентів у стравоході та шлунку:
1. Ендоскопічний метод установки стентів під прямим рентгенотелевізійним контролем. Це найбільш часто використовуваний спосіб стентування верхніх відділів травного каналу (має прямі показання при звивистих ходах стенозованого відділу стравоходу, шлунка, ДПК або зони післяопераційного анастомозу).
2. Ендоскопічна установка стента без прямого рентгеноскопічного контролю. Цей метод стентування виключає променеве навантаження медперсоналу і має перспективи на більш широке застосування при використанні сучасної відеоендоскопічної техніки малого діаметра. Умовою для безпечного застосування такого методу стентування є попередня реканалізація, бужування або балонна дилатація, що дозволяють виконати ендоскопічний огляд дистальної межі стенозу стравоходу, шлунка або ДПК [11].
Усі саморозправні стенти мають систему доставки у стислому вигляді, яка є меншого діаметра порівняно з остаточним діаметром стента після розгортання. Стенти мають встановлену систему доставки і при здійсненні стентування завдання лікаря зводяться до правильного позиціювання такої системи з подальшим розкриттям стента. Розміри систем доставки варіюють в межах від 6 до 14 мм. Всі системи доставки мають рентгенонегативні маркери, що вказують межі стисненого стента, а також мітки розташування стента після його розкриття [12].
Розроблено кілька методик попередньої розмітки місця розкриття стента перед його установкою в просвіті стравоходу або шлунка: а) підслизова ін’єкція рентгеноконтрастною речовиною в зоні планованої установки дистального і проксимального краю стента; б) фіксація танталових кліпс у слизовій оболонці в зазначених зонах; в) фіксація рентгеноконтрастних міток на шкірі грудної клітки, відповідних планованому положенню стента; г) ендоскопічний контроль положення проксимального кінця стента [12].
Сьогодні показання для стентування стравоходу і кардії значно розширені. Крім паліативного лікування інкурабельних онкологічних хворих з первинною стенозуючою пухлиною, показання до постановки стента такі: а) при пухлинній компресії стравоходу (рак легені та пухлини середостіння); б) при рецидиві раку стравоходу або шлунка зі стенозом в зоні стравохідно-шлункового або стравохідно-кишкового анастомозу; в) при раку стравоходу, що ускладнився стравохідно-трахеальною або стравохідно-бронхіальною норицею; г) при післяопераційній неспроможності стравохідно-шлункового або стравохідно-кишкового анастомозу; д) при гострій ятрогенній перфорації стінки стравоходу; е) при гострій кровотечі з розширених варикозних вен стравоходу [13–15].
У найближчому періоді після стентування стравоходу або кардії біль в грудній клітці виникає у 100 % пацієнтів, однак постійні болі зберігаються у менше ніж 13 % пацієнтів [16]. Найбільш інтенсивні болі виникають при стентуванні високих стриктур і при використанні стентів великого діаметра.
Тридцятиденна летальність після стентування в інкурабельних онкологічних хворих зі стенозуючим раком стравоходу, шлунка або ДПК становить 28 %, середня тривалість життя — 92,5 доби, медіана виживаності — 61 доба [17].
Ускладнення стентування у вигляді кровотечі, перфорації і нориць, аспіраційної пневмонії і лихоманки трапляються у 10–20 % хворих [18, 19]. Летальні результати пов’язані з установкою стента, виникають рідко і пов’язані з профузною кровотечею або масивною аспірацією.
У рандомізованому проспективному дослідженні проведено порівняння ефективності застосування покритих і непокритих SEMS у пацієнтів з раком шлунка (по 40 осіб у кожній групі). Відзначено більш високу частоту міграції покритих стентів протягом 8 тижнів після установки (25,8 %), ніж непокритих (2,8 %). Водночас частота рестенозу, пов’язаного з вростанням пухлини, була вище в групі з непокритими стентами (25,0 %), ніж з покритими (0 %) [20].
Попередня дилатація, термічна абляція та променева терапія збільшують ризик розвитку ускладнень при стентуванні, підвищують ризик міграції стента [21].
При стентуванні ділянки кардії частота міграції непокритих стентів коливається від 0 до 3 % і підвищується до 6 % [22]. Частота міграції покритих стентів коливається від 25 до 32 % і частіше трапляється при стентуванні стравохідно-шлункового переходу [23].
Повторні ендоскопічні втручання при рестенозуванні стравоходу і кардії здійснюються у 8–35 % спостереженнях, в першу чергу при проростанні пухлиною непокритих стентів. Ретроспективні дослідження показали, що рецидив дисфагії внаслідок проростання пухлиною непокритих стентів розвивається в 60 % випадків [24]. При установці саморозправних стентів із пластиковим покриттям повторна дисфагія зазвичай розвивається через обростання пухлиною проксимального або дистального краю стента [24].
До пізніх ускладнень належать: ерозивна кровотеча (3–10 %), виразковий езофагіт (7 %), перфорація або нориці (5 %), поворот стента (5 %), міграція стента (5 %), перелом або руйнування конструкції стента (2 %). M.Q. Wang зі співавт. [25] встановили, що небезпечні для життя ускладнення (масивна кровотеча, перфорація, масивна аспірація, нориці, компресія трахеї) найбільш часто розвиваються при стентуванні проксимальної третини стравоходу.
Отже, порівняно з іншими методами паліативної допомоги інкурабельним хворим з пухлинним стенозом стравоходу, шлунка і ДПК ендоскопічна реканалізація і стентування саморозправними металевими стентами є оптимальним варіантом комплексного лікування із задовільним клінічним і функціональним результатом, з тимчасовим поліпшенням якості життя і низькою частотою ускладнень [26, 27].
Мета роботи: оцінити ефективність методики ендоскопічного стентування при стенозуючому раку і стриктурах травного каналу.
Матеріали та методи
Саморозправні нітинолові стенти при злоякісних пухлинах, що стенозують просвіт шлунка, ДПК і стравоходу, а також при непухлинних стриктурах стравоходу застосовують в клініці ДУ «Інститут гастроентерології НАМН України» з 2015 року. За цей невеликий період накопичено клінічний досвід ендоскопічного стентування стравоходу, шлунка та ДПК у 9 онкологічних інкурабельних та у 3 неонкологічних хворих. Для стентування використовували нітинолові саморозправні стенти Flamingo Wallstent (Boston Scientific Ltd, США) з повним або частковим внутрішнім полімерним покриттям та нітинолові стенти (Garson, Корея) без покриття. Чоловіків було 8 (66,7 %), жінок — 4 (33,3 %); вік пацієнтів становив 51–80 років, середній вік — (63,0 ± 4,2) року. Стенозуючий рак стравоходу діагностовано у 5 пацієнтів, стенозуючий рак вихідного відділу шлунка — у 3, стенозуючий рак ДПК — в одного, стриктури стравоходу — у 3 хворих. У всіх хворих показаннями до стентування були евакуаторні порушення внаслідок основного захворювання.
УЗД у В-режимі проводили на апараті Toshiba Xario-660 (Японія); езофагогастродуоденоскопію — за допомогою відеоендоскопічної системи SonoScape HD-500 (Китай). Рентген-пасаж з барієм або розчином тріомбраст проводили на стаціонарній установці Opera T90 сex (Італія).
Установка стентів здійснювалали під ендоскопічним контролем по провіднику. Ступінь розкриття стентів контролювали рентгенологічно.
Для реканалізації просвіту стента використовували аргоно-плазмову коагуляцію апаратом Soring Arco-3000 (Німеччина).
Стентування під подвійним рентгеноендоскопічним контролем застосовували при довгому звивистому ході пухлинного звуження стравоходу та в усіх випадках стентування вихідного відділу шлунка і ДПК. У випадках зі стриктурою стравоходу застосовували методику ендоскопічного контролю розкриття стента з обов’язковим подальшим рентгенологічним контролем його положення і прохідності з використанням водорозчинного контрасту тріомбраст.
Результати
Установка саморозправних стентів у верхніх відділах шлунково-кишкового тракту здійснювалася успішно. Після стентування при пухлинному стенозі стравоходу, шлунка, ДПК або стриктурі стравоходу у всіх випадках були усунені евакуаторні порушення. У групі хворих зі стенозуючим раком стравоходу показник тридцятиденної летальності становив 20 %, медіана виживання — 9 місяців. У групі зі стенозуючим раком вихідного відділу шлунка та ДПК показник тридцятиденної летальності становив 33,3 %, медіана виживання — 11 місяців.
Ускладнення після стентування встановлено у 25 % випадків: міграцію стента визначено в одного пацієнта, рецидив дисфагії — в одного пацієнта, евакуаторні порушення — в одного пацієнта.
В одному випадку на 9 добу визначалася міграція нітинолового стента з частковим полімерним покриттям після стентування рубцевої стриктури стравоходу. Проведено ендоскопічну репозицію стента.
В одному випадку в інкурабельного хворого з раком дистального відділу стравоходу через 32 доби після стентування стравохідно-шлункового переходу нітиноловим стентом з полімерним покриттям повернулись явища дисфагії. Здійснено ендоскопічну реканалізацію просвіту стента за допомогою аргоно-плазмової коагуляції.
Повне розкриття стента у стенозованій ділянці стравоходу або кардії виникає не одразу, а протягом 2–5 діб.
В одному випадку в інкурабельного хворого на рак ДПК через 44 доби після стентування непокритим стентом повернулись явища евакуаторних порушень. Проведено повторне стентування нітиноловим стентом з повним полімерним покриттям «стент у стент».
В інкурабельних хворих на рак вихідного відділу шлунка не спостерігалося міграції стента та явищ евакуаторних порушень.
Після стентування рубцевих стриктур стравоходу через 2–3 місяці проведено ендоскопічне видалення стента. У всіх випадках отримали відновлення просвіту стравоходу і пасажу їжі в період нагляду 10–12 місяців.
В одному випадку перед стентуванням у хворого зі стенозуючим раком стравоходу здійснювали реканалізацію просвіту, обтурованого пухлиною, за допомогою аргоно-плазмової коагуляції; стентування без реканалізації просвіту — в 11 хворих. Для стентування пілоричного відділу шлунка використовували покриті або частково покриті стенти діаметром 16–18 мм, для ДПК — непокриті стенти діаметром 18–22 мм, для кардіоезофагеального відділу шлунка — покриті стенти діаметром 18–24 мм. При стриктурах стравоходу для стентування використовували саморозправні нітинолові стенти з частковим полімерним покриттям діаметром 20–24 мм.
В одному випадку, для більш швидкого та адекватного розправлення стента, встановленого у вихідному відділі шлунка, використовували його балонну дилатацію за допомогою балона Esophagus-Pyloric Dilator діаметром 18–20 мм фірми Boston Scientific Ltd (США).
Невдач у проведенні й установці саморозправних стентів не було.
Частота проростання пухлиною непокритих стентів і стентів з неповним полімерним покриттям становила 58,3 %.
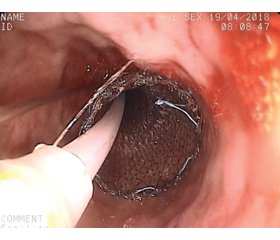
Діагностика та ендоскопічне стентування при стенозуючій стриктурі середньої третини стравоходу показані на рис. 1.
Променева діагностика при стенозуючому раку середньої третини стравоходу показана на рис. 2.
За даними морфологічного дослідження ендоскопічного біоптату циркулярного раку нижньої третини стравоходу діагностовано помірно диференційований плоскоклітинний рак (рис. 3).
Ендоскопічне стентування при стенозуючому раку середньої третини стравоходу показано на рис. 4.
Рентгенографія органів грудної порожнини при раку нижньої третини стравоходу в прямій і боковій проєкціях після стентування подана на рис. 5.
Променева діагностика при стенозуючому раку антрального відділу шлунка подана на рис. 6.
За даними морфологічного дослідження ендоскопічного біоптату стенозуючого раку антрального відділу шлунка діагностовано низькодиференційований інфільтративний рак (рис. 7).
Ендоскопічне стентування при стенозуючому раку антрального відділу шлунка подано на рис. 8.
Рентгенографія з контрастом у прямій проєкції органів черевної порожнини при раку шлунка після стентування подана на рис. 9.
Ускладнень під час і в ранній період після стентування не спостерігалося.
Наводимо клінічний приклад встановлення саморозправного стента у хворого зі стенозуючим раком ДПК, який перебував під нашим наглядом.
Клінічний приклад
Хворий В., 80 років, медична карта стаціонарного хворого № 0211, надійшов у клініку інституту 04.02.2021 р. зі скаргами на болі в епігастрії, важкість у животі, блювання з’їденою їжею через короткий час після її прийому, повільну втрату маси тіла до 20 кг протягом останнього року. Упродовж останніх 2 діб після надходження в стаціонар пацієнт не приймав не тільки тверду, але і рідку їжу.
За результатами ендоскопії від 04.02.2021 р. в шлунку визначено помірну кількість прозорої рідини. Слизова оболонка складчаста, еластична, у верхніх відділах рожева, в антральному відділі дрібноплямиста, воротар змикається. Слизова цибулина ДПК рожева, в просвіті жовч, в позацибулинному відділі слизова рожева, рівномірна, в просвіті жовч. У ділянці переходу низхідного відділу ДПК у нижній горизонтальний (D2 у D3) визначається циркулярне звуження просвіту до 4 мм, для апарата не прохідне, слизова в цьому місці щільна, зі зруйнованим судинним та ямковим рисунком, взята біопсія (рис. 10).
Висновок: захворювання ДПК зі стенозуванням просвіту. Гастропатія (антральний відділ). Уреазний тест негативний.
За результатами рентгенологічного дослідження від 05.02.2021 р. відзначається розширення низхідного відділу ДПК із звуженням в ділянці її переходу у нижній горизонтальний відділ ДПК у вигляді ниткоподібного просвіту діаметром до 3–4 мм і довжиною до 4 см, розширений та збільшений у розмірах шлунок (рис. 11).
Висновок: стенозування ДПК, диференціювати між стриктурою та захворюванням.
Мікроскопічний опис біоптату від 18.12.2020 р. Тканина слизової оболонки тонкокишкового типу з комплексами інвазивної пухлини, сформованої епітеліоїдними клітинами з ознаками диференціювання за типом залозистого епітелію, що відповідає аденокарциномі (ICD-O, код: 8140/3). На більшій частині площі (> 50 %) пухлина сформована залозистими криброзними структурами з наявністю солідних ділянок, втратою полярності ядер клітин пухлин, що відповідає аденокарциномі низького ступеня злоякісності — low-grade (G1-G2) (рис. 12).
УЗД від 05.02.2021 р. УЗ-ознаки хронічного панкреатиту, хронічного холециститу, дифузних змін паренхіми печінки, аневризми черевного відділу аорти.
МРТ від 12.02.2021 р. Аневризма черевного відділу аорти. Компресійний перелом Th2. Спондилолістез L4.
Зважаючи на вік пацієнта, інкурабельність випадку, хворому запропоновано і здійснено за його згодою паліативне лікування — ендоскопічне стентування.
За ділянку стенозу ДПК під рентгенологічним контролем введено провідник. На наступному етапі по провіднику встановлено саморозправний нітиноловий стент без полімерного покриття (Garson, Корея), дія якого контролювалася як ендоскопічно, так і рентгенологічно. Після установки стента так, щоб його дистальний кінець зайшов за край стенозу на 2 см, зроблено розкриття стента. Вже у перші 10 хвилин процесу розкриття стента ми змогли здійснити огляд ДПК, пройшовши апаратом зі стандартним діаметром через її просвіт, який відкрився (рис. 13).
Рентгенологічно визначалися правильне розташування стента і задовільне відновлення просвіту (рис. 14). Практично відразу після стентування хворий відчув полегшення: тупий ниючий біль і важкість у животі майже купірувані.
При ендоскопічному контролі наступного дня після стентування ДПК у просвіті шлунка визначалися домішки жовчі. Стент знаходився в тому самому положенні, в якому був встановлений напередодні. Хворий зміг самостійно приймати рідку їжу через ротову порожнину.
Через 3 місяці після стентування у хворого з’явились евакуаторні порушення. Виконано ендоскопічне дослідження, за даними якого встановлено інвазію пухлини в просвіт стенту з його стенозуванням. За допомогою аргоно-плазмової коагуляції здійснено реканалізацію стента в просвіті ДПК, обтурованого пухлиною. Додатково проведено стентування методикою «стент у стент» із застосуванням нітинолового пілородуоденального стента діаметром 22 мм з неповним полімерним покриттям (Taewoong Medical Co Ltd, Корея) (рис. 15).
Одразу після першого прийому їжі евакуаторних порушень не відзначалося. Виживаність хворого після стентування становила 6 місяців, тривалість якої була пов’язана з прогресуванням ракової інтоксикації.
Висновки
1. Ендоскопічне стентування є операцією вибору при стенозуючому раку і стриктурах травного каналу.
2. Застосування нітинолових стентів з полімерним покриттям і без такого, що саморозправляються, в інкурабельних пацієнтів зі злоякісними стенозами стравоходу, шлунка і ДПК та у хворих з непухлинними стриктурами стравоходу є виправданим, безпечним та ефективним методом, який дозволяє відновити і продовжити харчування природним шляхом і у такий спосіб покращити якість життя в інкурабельних випадках з показником тридцятиденної летальності у 20–33,3 % і медіаною виживаності 9–11 місяців.
3. Ускладнення, що виникають у віддаленому періоді після стентування при стенозуючому раку і стриктурах травного каналу, а саме міграція стента, рецидив дисфагії та евакуаторні порушення, встановлено у 25 % випадків, які кориговані ендоскопічно із застосуванням методик репозиції стента, реканалізації просвіту стента та повторного стентування «стент у стент».
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про фінансування. Дослідження проведено позапланово до наукової тематики відділень інституту. Усі пацієнти підписали інформовану згоду на участь у цьому дослідженні.
Інформація про внесок кожного з авторів: Степанов Ю.М. — ідея роботи, затвердження статті; Бабій О.М. — дизайн роботи, аналіз та інтерпретація літературних джерел і клінічних даних, написання та редагування статті; Шевченко Б.Ф. — редагування та доповнення статті; Тарабаров С.О. — проведення ендоскопічних досліджень та маніпуляцій.
Отримано/Received 29.06.2021
Рецензовано/Revised 09.07.2021
Прийнято до друку/Accepted 13.07.2021
/37_2.jpg)

/36.jpg)
/37.jpg)
/38.jpg)
/39.jpg)
/40.jpg)
/41.jpg)