Резюме
Мета: визначити наявність зв’язку між концентрацією вітаміну D у крові та факторами, що впливають на функцію ендотелію та відображають стан гемодинаміки гонад у жінок із синдромом полікістозних яєчників (СПКЯ). Матеріали та методи. Обстежено 60 жінок віком 18–26 років: основна група — 30 хворих із СПКЯ, контрольна — 30 здорових жінок. У сироватці крові досліджували: вміст вітаміну D, С-реактивного білка (СРБ), інтерлейкіну-6 (IL-6), гомоцистеїну (ГЦ), нітритів і нітратів (NOx) та аргініну. Проводили ультразвукове та допплерометричне дослідження, оцінювали максимальну систолічну швидкість кровотоку (Vmax), індекс резистентності (RI), пульсаційний індекс (РІ). Для корекції дефіциту вітаміну D застосовували холекальциферол у дозі 4000 МО на добу впродовж 12 тижнів. Результати. Хворі із СПКЯ мали більш низький (Р < 0,001) середній рівень вітаміну D, ніж здорові жінки. Знижена концентрація вітаміну D поєднувалась з підвищенням (Р < 0,001) середньої концентрації NОx та зниженням аргініну. Встановлено наявність позитивної асоціації між вітаміном D та аргініном (r = 0,391; Р < 0,05), між рівнем NOx та СРБ (r = 0,432; Р < 0,02), IL-6 (r = 0,476; Р < 0,01), Vmax (r = 0,383; Р < 0,05), RI (r = 0,369; Р < 0,05), РІ (r = 0,380; Р < 0,05) і зворотної — з аргініном (r = –0,375; Р < 0,05). Не виявлено взаємозв’язку між NOx та вітаміном D (r = 0,207; Р > 0,05), ГЦ (r = 0,176; Р > 0,05); між вітаміном D і Vmax (r = 0,231; Р > 0,05), RI (r = 0,201; Р > 0,05), РІ (r = 0,181; Р > 0,05). Призначення холекальциферолу супроводжувалось підвищенням (Р < 0,001) концентрації вітаміну D, аргініну (Р < 0,05) та зменшенням показників сумарної кількості нітратів/нітритів (Р < 0,02), IL-6 (Р < 0,05), СРБ (Р < 0,001), ГЦ (Р < 0,001), Vmax (Р < 0,001), RI (Р < 0,001), РІ (Р < 0,01), кількості антральних фолікулів (Р < 0,001) та зростанням середнього розміру фолікулів (Р < 0,001). Однак жоден з досліджуваних показників не досягав значень здорових жінок. Висновки. Недостатність вітаміну D асоціюється з підвищеними показниками маркерів хронічного запалення, гомоцистеїну, метаболітів NOx, зниженим рівнем аргініну, що є підґрунтям для розвитку дисфункції ендотелію і, як наслідок, для формування порушень гемодинаміки та фолікулогенезу в яєчниках.
Background. The study was aimed to determine the correlation between the blood concentration of vitamin D and factors that influence the function of the endothelium and the hemodynamic of gonads in women with polycystic ovary syndrome (PCOS). Material and methods. Sixty women aged from 18 to 26 years were examined: 30 women with a diagnosis of PCOS and 30 healthy women. The blood serum concentration of vitamin D, C-reactive protein (CRP), interleukin-6 (IL-6), homocysteine (Hcy), nitrites/nitrates (NOx), and arginine were investigated. Maximum systolic velocity (Vmax), resistance index (RI), and pulsatility index (PI) were measured with Doppler ultrasound. Cholecalciferol was used in a dose of 4000 IU per day for 12 weeks for the correction of deficiency of vitamin D. Results. The patients with PCOS were found to have a lower (Р < 0.001) average vitamin D than healthy women. The reduction of vitamin D concentration was combined with an increase (P < 0.001) in the average concentration of NOx and a decrease in arginine. It was found a positive association between vitamin D and arginine (r = 0.391; P < 0.05), between NOx and CRP (r = 0.432; P < 0.02), IL-6 (r = 0.476; P < 0.01), Vmax (r = 0.383; P < 0.05), RI (r = 0.369; P < 0.05), PI (r = 0.380; P < 0.05) and reverse correlation with arginine (r = –0.375; P < 0.05). It was not found an association between NOx and vitamin D (r = 0.207; P > 0.05), Hcy (r = 0.176; P > 0.05); between vitamin D and Vmax (r = 0.231; P > 0.05), RI (r = 0.201; P > 0.05), PI (r = 0.181; P > 0.05). The therapy of cholecalciferol level was accompanied by an increase (P < 0.001) in concentrations of vitamin D, arginine (P < 0.05) and a decrease in NOx (P < 0.02), IL-6 (P < 0.05), SRP (P < 0.001), Hcy (P < 0.001), Vmax (P < 0.001), RI (P < 0.001), PI (P < 0.01), quantity of antral follicles (P < 0.001), and the growth of follicles (P < 0.001). However, none of the studied indicators reached the indicators in healthy women. Conclusions. The deficiency of vitamin D is associated with increased markers of chronic inflammation, homocysteine, nitrate/nitrites, reduced concentration of arginine that provokes the development of endothelium dysfunction and, therefore, the hemodynamics disorders and folliculogenesis in the ovary.
Вступ
Наукові праці останніх років присвячені дослідженню функції ендотелію у хворих на синдром полікістозних яєчників (СПКЯ) [1]. Зазвичай розвиток ендотеліальної дисфункції (ЕД) асоціюють з притаманними СПКЯ метаболічними і гормональними розладами, кожен з яких може справляти негативний вплив на функцію ендотелію [2]. Однак на сьогодні у літературних джерелах також з’являються повідомлення щодо ролі недостатності вітаміну D у формуванні ЕД за умов СПКЯ [3–5].
Вітамін D — це жиророзчинний гормон, якому притаманні ендокринний, паракринний та автокринний механізми регуляції [4]. Вважається, що за умов його недостатності збільшується ризик виникнення метаболічного синдрому, цукрового діабету 2-го типу, патології нирок та серцево-судинної системи [2]. Вітамін D може впливати на стан судин, а саме проліферацію гладких м’язів та регуляцію системного метаболізму кальцію [5, 6]. Результати доклінічних досліджень свідчать про те, що свою фізіологічну дію він здійснює через рецептори вітаміну D (VDR), які виявлено в ендотеліальних клітинах [6], однак повністю механізми, за допомогою яких вітамін D впливає на ендотелій, не з’ясовані. Частково цей вплив може бути пов’язаний із зменшенням біодоступності оксиду азоту (NO), підвищенням окислювального стресу або зниженням антиоксидантного захисту, порушеною регуляцією ренін-ангіотензинової системи, що, у свою чергу, призводить до збільшення жорсткості артерій та ЕД [5–7].
У пацієнток із СПКЯ розвиток ЕД також асоціюють з підвищенням маркерів хронічного системного запалення, а саме прозапальних цитокінів, таких як фактор некрозу пухлини альфа, інтерлейкін-6 (IL-6), інтерлейкін-1 та С-реактивний білок (СРБ) [7]. Водночас адекватний рівень вітаміну D може зменшувати шкідливу дію хронічного запалення на функцію ендотелію шляхом пригнічення активності ядерного транскрипційного фактора NF-κB та експресії прозапальних цитокінів [5]. Крім того, попередні доклінічні дослідження засвідчили позитивний ефект застосування вітаміну D та підтвердили наявність біохімічного зв’язку між рівнем вітаміну D і концентрацією біологічно активних речовин, які синтезуються ендотелієм [8]. Серед цих речовин роль модератора основної функції ендотелію належить ендотеліальному фактору релаксації, а саме NO [8].
Оксид азоту, що синтезується ендотелієм, діє на сусідні клітини гладеньких м’язів судин паракринним шляхом і викликає розслаблення судинних м’язів за рахунок активації розчинної гуанілатциклази, що, у свою чергу, призводить до збільшення продукції циклічного гуанозинмонофосфату і зниження внутрішньоклітинної концентрації кальцію [9]. Здатність ендотеліальних клітин звільняти релаксуючі фактори може зменшуватися під впливом різних факторів, водночас утворення судинозвужувальних факторів зберігається, тобто формується ЕД [10]. При ЕД дефіцит NO викликає порушення іонного складу клітин, стимулюються коагуляційні механізми, підвищується тонус і посилюється скорочення гладких м’язів судин. Надмірне виділення NO робить його токсичним та може стимулювати апоптоз і нейродегенеративні процеси. У нормальних умовах NO виконує захисну функцію, яка полягає в запобіганні пошкодженню ендотелію та збереженні його фізіологічного стану [10]. Тобто NO відіграє важливу роль у різних фізіологічних станах, продукується різними клітинами людини, зокрема ендотеліоцитами, незалежно від розмірів і функції судин, у тому числі й ендотелієм судин яєчників. На участі NO в модуляції функції яєчників наголошують багато дослідників, які довели його значення в стимуляції ангіогенезу, регуляції активності факторів росту, стероїдогенезу, фолікулогенезу, овуляції, лютеїнової регресії та в патогенезі СПКЯ [11].
Субстратом для синтезу NO, який відбувається за участі ендотеліальної NO-синтази в ендотелії, є напівнезамінна амінокислота аргінін [7]. Існують різні причини зниження вмісту аргініну в сироватці крові, а саме недостатнє його надходження з їжею, неефективне всмоктування в кишечнику, утилізація аргініну мікрофлорою, підвищення активності аргінази, високий рівень ліпопротеїдів низької щільності, що порушує його метаболізм і мембранний транспорт. Однак незалежно від причини зниження вмісту аргініну супроводжується порушенням базального вироблення NO й, відповідно, призводить до виникнення ЕД [12, 13].
Ще одним фактором, який може призводити до розвитку ЕД у жінок із СПКЯ, є гіпергомоцистеїнемія (ГГЦ). Дані літератури свідчать про те, що під впливом ГГЦ відбувається підвищення експресії прозапальних цитокінів, збільшення експресії індуцибельної форми NO-синтази та зміна біодоступності NO, індукція оксидативного стресу, активація апоптозу і дефектного метилювання, що пригнічує ооцитарну та фолікулярну матурацію, а також стероїдогенез в яєчниках і, відповідно, ускладнює настання вагітності [14, 15]. Крім того, гомоцистеїн (ГЦ) справляє негативний вплив на компоненти коагуляційного каскаду, який зростає пропорційно концентрації амінокислоти в плазмі крові і тривалості впливу [16]. На сьогодні вже доведено, що сироватковий рівень ГЦ збільшується за умов недостатності та дефіциту вітаміну D, оскільки останній може регулювати експресію генів ферментів, які беруть участь у метаболізмі ГЦ [17]. Водночас необхідно зазначити, що, окрім D-гіповітамінозу, може відбуватися й пригнічення дії вітаміну D унаслідок зменшення його біосинтезу, недостатності гідроксилази в клітинах та зниження вмісту VDR, що, у свою чергу, також сприятиме розвитку ЕД [18].
У вітчизняній літературі публікації, які відображають зв’язок між вітаміном D та функцією ендотелію у хворих на СПКЯ, практично відсутні, а у проведених дослідженнях не отримано переконливих результатів, які б підтверджували або виключали вплив вітаміну D на регуляцію функції ендотелію. Недостатньо вивчений і вплив перорального застосування вітаміну D на функцію ендотелію у даного контингенту хворих, що спонукає продовжити дослідження в цьому напрямку.
Мета: визначити наявність зв’язку між концентрацією вітаміну D у крові та факторами, що впливають на функцію ендотелію та відображають стан гемодинаміки гонад у жінок із СПКЯ.
Матеріали та методи
До дослідження, яке проводилось у клініці ДУ «ІПЕП», було залучено 60 жінок віком від 18 до 26 років (середній вік 24,2 ± 0,2 року). Усіх обстежених розподілено на дві групи: 30 пацієнток із СПКЯ увійшли до основної групи та 30 жінок із нормальною репродуктивною функцією становили контрольну групу. Дослідження тривало з жовтня 2019 по лютий 2021 р. Жінки, які увійшли до обох груп, не застосовували вітамін D і препарати, які можуть впливати на метаболізм кальцію, фосфору та ліпідний спектр крові.
У сироватці крові імуноферментним методом досліджували вміст вітаміну D (набір 25-OH Vitamin D (total) ELISA, Німеччина); спектрометрично визначали показники стабільних метаболітів NO (нітритів і нітратів (NОх)) та аргініну [19]; турбідиметричним методом досліджували рівні СРБ (реактиви BioSystems (Іспанія)); імунометричним методом визначали рівень IL-6 (набір Siеmens (Німеччина)); визначення рівня ГЦ проводили з використанням наборів Architect system (Німеччина).
Для оцінки стану яєчників було використано трансвагінальне ультрасонографічне дослідження з допплерометричним визначенням інтраоваріального кровотоку на 5–7-й день менструального циклу за допомогою апарату Philips HD-11 з використанням вагінальних датчиків, які працюють у частотному діапазоні від 4 до 9 МГц у триплексному режимі. При допплерометричному дослідженні оцінювали такі показники, як максимальна систолічна швидкість кровотоку (Vmax) та індекси, що відображають опір судинної стінки (індекс резистентності (RI), пульсаційний індекс (РІ)).
Корекція дефіциту вітаміну D проводилась відповідно до існуючих рекомендацій [20] препаратом, що містив холекальциферол, у дозі 4000 МО на добу протягом 12 тижнів. Оцінку ефективності здійснювали до початку терапії та через 12 тижнів.
Усі жінки, які були залучені у дослідження, отримали інформацію про його хід та письмово дали згоду на участь.
За допомогою пакета прикладних програм StatSoft Statistica 6.1 фірми Statsoft Inc. та Microsoft Office Excel проводили статистичний аналіз отриманих даних: застосовували параметричний t-критерій Стьюдента для порівняння середніх значень величин; коефіцієнт Пірсона для кореляції кількісних змінних. Статистично значущими вважали відмінності при рівні Р < 0,05.
Результати
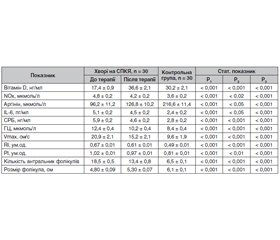
Отримані результати свідчать про те, що хворі із СПКЯ мають більш низький (Р < 0,001) середній рівень вітаміну D, ніж здорові жінки. Знижена концентрація вітаміну D поєднувалась з підвищенням (Р < 0,001) непрямих показників умісту NO в сироватці крови, а саме сумарної кількості нітратів/нітритів (табл. 1). Однак наявності кореляційного взаємозв’язку між рівнем вітаміну D та метаболітами NO не виявлено (r = 0,207; Р > 0,05).
За умов СПКЯ підвищення показників NОx поєднувалось зі зниженням рівня аргініну в сироватці крові щодо такого в здорових жінок (табл. 1). Установлено негативну кореляційну залежність між аргініном та NOx (r = –0,375; Р < 0,05) і позитивну (r = 0,391; Р < 0,05) — з вітаміном D. Отримані результати свідчать про те, що зниження аргініну супроводжується порушенням базального вироблення NO в ендотелії, а недостатність вітаміну D можливо розглядати як додатковий фактор, який сприяє розвитку дизрегуляції ендотеліальної функції при СПКЯ.
Недостатність вітаміну D тісно пов’язана з ГГЦ, яка існує у кожної другої жінки із СПКЯ та вважається фактором ризику формування ЕД. В обстежених із СПКЯ виявлена наявність негативної кореляційної залежності між рівнем вітаміну D та ГЦ (r = –0,431; Р < 0,02). За умов ГГЦ частота підвищення концентрації NOx була вірогідно вищою, ніж при нормальному рівні ГЦ (χ2 = 7,1; Р < 0,001), але наявність асоціативного взаємозв’язку між ГЦ та NOx (r = 0,176; Р > 0,05) не доведена. Зазначені зміни в секреції та взаємовідносинах показників, що досліджувались, опосередковано свідчать про роль зниження вітаміну D як фактора ризику виникнення дисфункції ендотелію за умов СПКЯ.
Щодо маркерів хронічного запалення, то рівні СРБ та IL-6 у хворих на СПКЯ вірогідно перевищували показники жінок групи контролю (табл. 1). Встановлено наявність негативного асоціативного зв’язку між концентрацією вітаміну D й СРБ (r = –0,505; Р < 0,01) та IL-6 (r = –0,384; Р < 0,05). Водночас зазначені маркери позитивно корелювали з умістом NОx (СРБ: r = 0,432, Р < 0,02; IL-6: r = 0,476, Р < 0,01). Виходячи з отриманих даних, можливим є припущення щодо ролі недостатності вітаміну D у формуванні дисфункції ендотелію внаслідок активації прозапального каскаду [5].
Однією з ключових патофізіологічних ознак СПКЯ є порушений фолікулогенез у вигляді збільшення кількості антральних фолікулів та відсутності домінантного фолікула. Для розвитку якісного домінантного фолікула важливими є не лише адекватні гормональні та метаболічні показники, але й властивості ендотелію та баланс ендотеліальних факторів, які контролюють тонус судин, що забезпечують кровопостачання фолікула на кожній окремій стадії розвитку [20].
Оцінка ультразвукових та допплерометричних показників яєчників показала, що у жінок із СПКЯ має місце підвищення Vmax кровотоку, RI та РI, які відображають опір судинної стінки. Зазначені показники вірогідно (Р < 0,001) перевищували відповідні показники здорових жінок. Установлено, що за умов СПКЯ концентрація NОx позитивно асоціювалася з Vmax (r = 0,383; Р < 0,05), RI (r = 0,369; Р < 0,05), РI (r = 0,380; Р < 0,05); водночас із кількістю антральних фолікулів (r = 0,189; Р > 0,05) і їх середнім розміром (r = 0,221; Р > 0,05) зв’язку не спостерігалося. Щодо вітаміну D, то результати нашого дослідження вказують на відсутність кореляційної залежності між його середнім рівнем та Vmax (r = 0,231; Р > 0,05), RI (r = 0,201; Р > 0,05), РІ (r = 0,181; Р > 0,05), тому питання впливу вітаміну D на гемодинамічні показники залишається відкритим.
Призначення холекальциферолу в дозі 4000 МО на добу впродовж 12 тижнів супроводжувалось підвищенням концентрації вітаміну D (Р < 0,001), аргініну (Р < 0,05) та зменшенням рівня сумарної кількості нітратів/нітритів (Р < 0,02) у сироватці крові; також відбувалось вірогідне зниження концентрації IL-6 (Р < 0,05), СРБ (Р < 0,001) й ГЦ (Р < 0,001). Крім цього, зазначено зменшення Vmax (Р < 0,001), RI (Р < 0,001) й РІ (Р < 0,01), спостерігалось зменшення кількості антральних фолікулів (Р < 0,001), зростання середнього розміру фолікулів (Р < 0,001), що свідчило про зміни у фолікулогенезі. Тобто на тлі терапії холекальциферолом відбувалась позитивна динаміка, однак жоден із досліджуваних показників не досягав значень здорових жінок.
Таким чином, дефіцит вітаміну D робить істотний внесок у виникнення та прогресування ЕД, тому стає цілком очевидною необхідність підтримки нормальної концентрації даного нутрієнта.
Обговорення
На сьогодні відомо, що за умов СПКЯ спостерігається зниження рівня вітаміну D до значень, які відповідають критеріям недостатності. Існують дані, що низька концентрація вітаміну D в сироватці крові поєднується з виникненням ЕД [7], для якої притаманним є зниження синтезу та біодоступності речовин з властивостями вазодилатації, зокрема NO. Оксид азоту продукується клітинами ендотелію, тому активація його синтезу, яка опосередковано пов’язана з концентрацією вітаміну D, обумовлює припущення щодо захисної дії вітаміну D на судини [21]. Для оцінки загального синтезу NO в експериментальних та клінічних роботах застосовується визначення кінцевих метаболітів NO — нітритів і нітратів [13]. Згідно з результатами досліджень, які проводились на тваринах та серед людей, вітамін D і NOx є важливими молекулами, які можуть мати функціональну асоціацію [5–7]. У нашому дослідженні у пацієнтів із СПКЯ було наявне значне підвищення концентрації NOx порівняно з контрольною групою, що свідчило про порушення функції ендотелію. Збільшені рівні NOx поєднувались із зниженими показниками вітаміну D, однак чітка кореляційна залежність була відсутня. Цілком можливо, що зростання концентрації NOx відбувалось унаслідок впливу різних метаболічних складових, що притаманні СПКЯ та призводять до зміни як рівнів NOx, так і взаємовідносин між NOx та вітаміном D. Отримані результати вкрай складно інтерпретувати, оскільки визначення зв’язку з NOx ускладнюється схильністю даного показника до значних коливань за часом і кількістю. Однак це не робить неможливим припущення, що недостатність вітаміну D є одним із факторів, які сприяють підвищенню NOx у жінок із СПКЯ. Також нами встановлено зв’язок між рівнями вітаміну D та аргініну (донатора NO) в сироватці крові, що обумовлює доцільність урахування даних показників при розробленні методів лікування хворих із СПКЯ.
Одним із ключових факторів формування ЕД у хворих із СПКЯ є хронічне запалення [5]. У роботі наведені дані, які свідчать про те, що зростання концентрації вітаміну D у сироватці крові сприяє зниженню показника NOx шляхом впливу на рівень маркерів хронічного запалення, а саме IL-6 та СРБ. Отримані результати можна порівняти з даними, які були опубліковані раніше та засвідчують, що протизапальні властивості вітаміну D полягають у зменшенні шкідливої дії запалення на функцію ендотелію [14, 15].
Ще одним важливим фактором формування ЕД є ГГЦ. У нашому дослідженні отримано докази тісного зв’язку між вітаміном D та ГЦ і продемонстровано, що терапія холекальциферолом, яка сприяє зростанню концентрації вітаміну D у сироватці крові, призводить до зменшення рівня ГЦ. Однак основний механізм, завдяки якому вітамін D впливає на зниження показника ГЦ, ще не з’ясований. Існує припущення, що така асоціація може бути результатом опосередкованої дії вітаміну D, тобто наслідком впливу на фактори, від яких залежить рівень ГЦ, при цьому ці фактори не обов’язково самостійно справляють пряму дію на формування ЕД [15].
Застосування холекальциферолу призводило до підвищення плазмової концентрації аргініну, зниження прозапальних цитокінів, ГЦ та, як наслідок, до покращення фолікулогенезу і гемодинамічних властивостей. Однак зазначені показники не досягали значень здорових жінок. Отримані дані свідчать, що вплив вітаміну D на ендотелій не є специфічним і покращує його стан через плейотропну дію [7], що, на нашу думку, є результатом перехресної взаємодії між сигнальними шляхами, регулюючими метаболізм вітаміну D, хронічним запаленням і функцією ендотелію. Таким чином, існує необхідність у подальших клінічних та експериментальних дослідженнях для більш детального вивчення механізмів негативного впливу дефіциту вітаміну D на формування дисфункції ендотелію.
Висновки
1. У хворих із СПКЯ D-гіповітаміноз виступає як предиктор розвитку ендотеліальної дисфункції, яка асоціюється з підвищенням маркерів хронічного запалення, рівнів оксиду азоту, гомоцистеїну, зниженням концентрації аргініну та з порушенням кровопостачання й фолікулогенезу в яєчниках.
2. Застосування холекальциферолу в дозі 4000 МО упродовж 12 тижнів призводить до зростання концентрації вітаміну D у сироватці крові, що супроводжується покращенням показників, які впливають на стан ендотелію та інтраоваріальну гемодинаміку. Отримані дані обґрунтовують доцільність використання холекальциферолу в комплексі лікувальних заходів з метою профілактики дисфункції ендотелію у жінок із СПКЯ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів у роботу над статтею: Архипкіна Т.Л., Бондаренко В.О. — концепція та дизайн дослідження, критичний огляд статті, остаточне затвердження статті; Любимова Л.П., Бєлкіна І.О. — збір даних, аналіз та інтерпретація даних, написання статті; Величко Н.Ф. — аналіз та інтерпретація даних, написання статті.
Отримано/Received 29.07.2021
Рецензовано/Revised 30.08.2021
Прийнято до друку/Accepted 15.09.2021

/16.jpg)