Международный эндокринологический журнал Том 17, №6, 2021
Вернуться к номеру
Покращення інтраопераційної верифікації навколощитоподібних залоз через визначення їх автофлуоресценції в інфрачервоному спектрі
Авторы: Горобейко М.Б. (1, 2), Дінець А.В. (1, 2), Хоперія В.Г. (1), Абдалла К.М. (2)
(1) — Київський національний університет імені Тараса Шевченка, м. Київ, Україна
(2) — Verum Expert Clinic, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
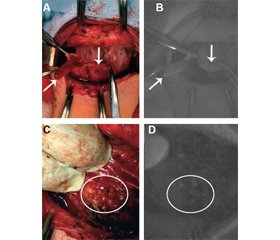
Актуальність. Виявлення навколощитоподібних залоз методом спектроскопії їх автофлуоресценції в ближній інфрачервоній ділянці (АФБІЧ) розцінюється як перспективний метод інтраопераційної детекції в комплексі з візуальною ідентифікацією. Мета цього дослідження — оцінити роль спектроскопії АФБІЧ за допомогою двох різних візуалізаційних систем для ідентифікації навколощитоподібних залоз під час операцій з приводу доброякісних та злоякісних утворень щитоподібної та навколощитоподібних залоз. Матеріали та методи. У дослідження були залучені 62 пацієнти, у яких під час оперативного втручання була проведена верифікація АФБІЧ навколощитоподібних залоз за допомогою двох різних систем візуалізації, оснащених камерою БІЧ. Для посилення АФБІЧ-сигналу використовувалось внутрішньовенне введення флуорофору індоціаніну зеленого. Результати. Нормальні навколощитоподібні залози були ідентифіковані та мобілізовані після візуального контролю у 50 пацієнтів (80 %), що підтвердилося оцінкою спектроскопії АФБІЧ навколощитоподібних залоз. Визначення АФБІЧ навколощитоподібних залоз та їх диференціація від лімфатичних вузлів були досягнуті у 8 (13 %) пацієнтів з папілярним раком щитоподібної залози. У 3 (5 %) пацієнтів навколощитоподібні залози були ідентифіковані у ділянці післяопераційних рубцевих змін за допомогою АФБІЧ, але не при візуальній ідентифікації. У 2 (3 %) випадках визначалось збереження сигналу, проте зі зниженням інтенсивності сигналу АФБІЧ від навколощитоподібних залоз при їх випадковому видаленні. Краща інтенсивність сигналу АФБІЧ відзначалася від навколощитоподібних залоз після зміни положення БІЧ-камери при використанні апарата Fluobeam 800 на кут приблизно 45–65° щодо ділянки ймовірного розташування навколощитоподібної залози. Апарат Fluobeam LX продемонстрував задовільний сигнал АФБІЧ без будь-яких специфічних змін у позиції камери. АФБІЧ-сигнал визначався в тканині токсичних аденом щитоподібної залози. АФБІЧ-сигнал зниженої інтенсивності відмічався при інвазії карциноми в капсулу щитоподібної залози. При оцінці сигналу АФБІЧ не отримано сигналу від метастатичних та нормальних лімфатичних вузлів. Висновки. Застосування технології спектроскопії АФБІЧ навколощитоподібних залоз дозволяє покращити їх візуалізацію та верифікацію як додатковий метод до оцінки навколощитоподібних залоз неозброєним оком під час оперативного втручання на шиї. Практична цінність спектроскопії АФБІЧ навколощитоподібних залоз підвищується у випадку повторного хірургічного втручання через ризик випадкового видалення навколощитоподібних залоз, а також для диференціальної діагностики між навколощитоподібною залозою та метастатичними лімфатичними вузлами.
Background. Detection of parathyroid glands by spectroscopy of their autofluorescence in the near-infrared spectrum (NIRAF) is considered a promising intraoperative tool in addition to their verification with visual identification. The study was aimed to evaluate the role of NIRAF by using two different imaging systems to confirm parathyroid glands during operations for benign and malignant thyroid and parathyroid tumors. Materials and methods. The study included 62 patients who underwent verification of NIRAF by using two different imaging systems equipped with a near-infrared (NIR) camera during surgery. Intravenous fluorophore of indocyanine green was applied to amplify the NIRAF signal. Results. Normal parathyroid glands were identified and mobilized after a visual inspection in 50 patients (80 %), which was subsequently confirmed by evaluation with NIRAF spectroscopy. Determination of NIRAF in the parathyroid glands and their differentiation from lymph nodes was achieved in 8 (13 %) patients with papillary thyroid carcinoma. In 3 (5 %) patients, the parathyroid gland was identified in the area of the postoperative scar, using NIRAF but not by the visual identification. In 2 (3 %) cases, the appearance of the signal was determined but with a decrease in the intensity of the NIRAF from the parathyroid glands during their unintentional removal. The strong NIRAF signal intensity was observed from the parathyroid gland after changing the position of the NIR camera when using the Fluobeam 800 device at an angle of approximately 45–65° to the area of the parathyroid gland location. The Fluobeam LX demonstrated a satisfactory NIRAF signal without any specific changes in camera position. NIRAF signal was determined in the tissue of toxic thyroid adenomas. NIRAF signal of the low intensity was detected in the invasion of thyroid carcinoma in a capsule of a thyroid gland. No NIRAF signal was observed from metastatic and normal lymph nodes. Conclusions. The use of NIRAF parathyroid spectroscopy technology allows improving their imaging and verification as an additional method during surgery of the neck. The practical value of NIRAF spectroscopy of the parathyroid gland is increased in the case of reoperations due to the risk of accidental removal of the parathyroid gland as well as for differential diagnosis between the parathyroid gland and metastatic lymph nodes.
автофлуоресценція навколощитоподібної залози; автофлуоресценція в ближній інфрачервоній ділянці; гіпопаратиреоз; ідентифікація навколощитоподібних залоз
parathyroid autofluorescence; near-infrared fluorescence; hypoparathyroidism; parathyroid identification
Вступ
Матеріали та методи
Результати
/22.jpg)
/23.jpg)
Обговорення
Висновки
- Gorobeiko M., Dinets A. Intraoperative detection of parathyroid glands by autofluorescence identification using image-based system: report of 15 cases. J. Med. Case Rep. 2021. 15(1). 414. Epub 20210809. doi: 10.1186/s13256-021-03009-8. PubMed PMID: 34365979.
- Sichinava R., Larin O., Cherenko S., Gorobeiko M. Algorithm for providing medical care to patients with nodular thyroid neoplasms. Military health problems. 2014. 42(1). 401-8. (in Ukrainian)
- Palamarchuk V., Larin O., Gorobeiko M. Application of spectral analysis of vowels to predict the dynamics of neuromuscular laryngeal stenosis in the early postoperative period. Clinical Endocrinology and Endocrine Surgery. 2008. 2. 24. (in Ukrainian)
- Cherenko S.M., Larin O.S., Gorobeyko M.B., Sichynava R.M. Clinical analysis of thyroid cancer in adult patients exposed to ionizing radiation due to the Chernobyl nuclear accident: 5-year comparative investigations based on the results of surgical treatment. World J. Surg. 2004. 28(11). 1071-4. doi: 10.1007/s00268-004-7561-7. PMID: 15490064.
- Alesina P.F., Meier B., Hinrichs J., Mohmand W., Walz M.K. Enhanced visualization of parathyroid glands during video-assisted neck surgery. Langenbecks Arch. Surg. 2018. 403(3). 395-401. Epub 2018/03/13. doi: 10.1007/s00423-018-1665-2. PMID: 29536247.
- Kose E., Rudin A.V., Kahramangil B., Moore E., Aydin H., Donmez M. et al. Autofluorescence imaging of parathyroid glands: An assessment of potential indications. Surgery. 2020. 167(1). 173-9. Epub 2019/09/13. doi: 10.1016/j.surg.2019.04.072. PMID: 31526579.
- Cherenko S.M., Dinets A., Bandura G.V., Sheptuha S.A., Larin O.S. Multiglandular parathyroid gland disease: an incidental discovery in normocalcemic patients during thyroid surgery. Acta Endocrinologica. 2017. 8(3). 349-55. doi: 10.4183/aeb.2017.349.
- Barczyński M., Bränström R., Dionigi G., Mihai R. Sporadic multiple parathyroid gland disease — a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbecks Arch. Surg. 2015. doi: 10.1007/s00423-015-1348-1. PMID: 26542689.
- Palmhag D., Brydolf J., Zedenius J., Bränström R., Nilsson I.L. A Single Parathyroid Hormone Measurement Two Hours after a Thyroidectomy Reliably Predicts Permanent Hypoparathyroidism. Scand. J. Surg. 2020. 1-7. Epub 2020/04/09. doi: 10.1177/1457496920913666. PMID: 32268827.
- Paras C., Keller M., White L., Phay J., Mahadevan-Jansen A. Near-infrared autofluorescence for the detection of parathyroid glands. J. Biomed. Opt. 2011. 16(6). 067012. doi: 10.1117/1.3583571. PMID: 21721833.
- Solórzano C.C., Thomas G., Berber E., Wang T.S., Randolph G.W., Duh Q.Y. et al. Current state of intraoperative use of near infrared fluorescence for parathyroid identification and preservation. Surgery. 2021. 169(4). 868-78. Epub 2020/11/01. doi: 10.1016/j.surg.2020.09.014. PMID: 33139065; PMCID: PMC7987670.
- McWade M.A., Sanders M.E., Broome J.T., Solórzano C.C., Mahadevan-Jansen A. Establishing the clinical utility of autofluorescence spectroscopy for parathyroid detection. Surgery. 2016. 159(1). 193-202. Epub 2015/10/09. doi: 10.1016/j.surg.2015.06.047. PMID: 26454675; PMCID: PMC4836056.
- Dinets A., Nykytiuk O., Gorobeiko M., Barabanchyk O., Khrol N. Milestones and pitfalls in strategic planning of healthcare in capital city in transition. Georgian Med. News. 2021. 315. 189-95. PMID: 34365449.
- Cheren’ko S.M., Horobeĭko M.A., Vas’ko V.V., Larin O.S., Ivanov M.A. The choice and substantiation of optimal strategies in the surgical treatment of thyroid cancer. Klin. Khir. 2000. 8. 50-3. PMID: 11036317. (in Ukrainian)
- Lloyd R., Osamura R., Klöppel G. Other encapsulated follicular-patterned thyroid tumours. Classification of tumours of endocrine organs 4th ed. Lyon, France: World Health Organization. 2017. 75-80.
- Orloff L.A., Wiseman S.M., Bernet V.J., Fahey T.J., Shaha A.R., Shindo M.L. et al. American Thyroid Association Statement on Postoperative Hypoparathyroidism: Diagnosis, Prevention, and Management in Adults. Thyroid. 2018. 28(7). 830-41. Epub 2018/06/29. doi: 10.1089/thy.2017.0309. PMID: 29848235.
- Papavramidis T.S., Chorti A., Tzikos G., Anagnostis P., Pantelidis P., Pliakos I. et al. The effect of intraoperative autofluorescence monitoring on unintentional parathyroid gland excision rates and postoperative PTH concentrations-a single-blind randomized-controlled trial. Endocrine. 2021. 72(2). 546-52. Epub 2021/01/11. doi: 10.1007/s12020-020-02599-5. PMID: 33432503.
- Ladurner R., Lerchenberger M., Al Arabi N., Gallwas J.K.S., Stepp H., Hallfeldt K.K.J. Parathyroid Autofluorescence-How Does It Affect Parathyroid and Thyroid Surgery? A 5 Year Experience. Molecules. 2019. 24(14). Epub 2019/07/14. doi: 10.3390/molecules24142560. PMID: 31337096; PMCID: PMC6680977.
- Cui L., Gao Y., Yu H., Li M., Wang B., Zhou T. et al. Intraoperative Parathyroid Localization with Near-Infrared Fluorescence Imaging Using Indocyanine Green during Total Parathyroidectomy for Secondary Hyperparathyroidism. Sci. Rep. 2017. 7(1). 8193. Epub 2017/08/15. doi: 10.1038/s41598-017-08347-6. PMID: 28811539; PMCID: PMC5557759.
- Idogawa H., Sakashita T., Homma A. A novel study for fluorescence patterns of the parathyroid glands during surgery using a fluorescence spectroscopy system. Eur. Arch. Otorhinolaryngol. 2020. 277(5). 1525-9. Epub 2020/02/20. doi: 10.1007/s00405-020-05849-4. PMID: 32078027.
- Zaidi N., Bucak E., Okoh A., Yazici P., Yigitbas H., Berber E. The utility of indocyanine green near infrared fluorescent imaging in the identification of parathyroid glands during surgery for primary hyperparathyroidism. J. Surg. Oncol. 2016. 113(7). 771-4. Epub 2016/04/04. doi: 10.1002/jso.24240. PMID: 27039880.