Международный эндокринологический журнал Том 17, №6, 2021
Вернуться к номеру
Первинний гіпотиреоз як предиктор розвитку гіпогонадизму
Авторы: Пасєчко Н.В., Крицький Т.І., Кадубець С.В., Наумова У.В., Наумова Л.В.
Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
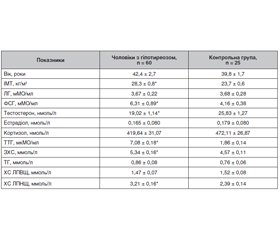
Актуальність. Спосіб життя людини істотно впливає на її здоров’я та репродуктивні функції. Наявність гіпотиреозу негативно відображається на самопочутті, активності й репродуктивному статусі. Мета даного дослідження — оцінити гормональний статус, метаболічні й антропометричні показники в чоловіків активного репродуктивного віку з первинним гіпотиреозом. Матеріали та методи. Проведений порівняльний аналіз гормональних, антропометричних і метаболічних показників у 60 чоловіків з гіпотирео-зом (основна група) і 25 чоловіків без гіпотиреозу й інших хронічних соматичних захворювань (контрольна група). Середній вік випробовуваних осіб становив 42,4 ± 2,7 року. Результати. У чоловіків з гіпотиреозом рівень тестостерону у крові виявився вірогідно нижчим порівняно з чоловіками контрольної групи. При цьому вміст тестостерону в групі осіб з гіпотиреозом не досягав нижньої межі нормальних значень (12 нмоль/л), і, отже, андрогенний дефіцит був виражений у відносно помірній формі. Результати дослідження вказують на вірогідне підвищення рівня фолікулостимулюючого гормону у хворих на гіпотиреоз порівняно з чоловіками контрольної групи. Водночас вміст лютеїнізуючого гормону, естрадіолу і кортизолу в чоловіків з гіпотиреозом не відрізнявся від аналогічних показників контрольної групи. Висновки. У чоловіків з гіпотиреозом встановлені зміни гормонального статусу, що проявляються зниженням вмісту тестостерону та підвищенням рівня фолікулостимулюючого гормону у крові. При цьому не встановлено вплив гіпотиреозу на рівень інших гормонів у крові (лютеїнізуючого, естрадіолу, кортизолу). Гіпотиреоз у чоловіків супроводжується змінами ліпідного обміну (підвищенням у крові вмісту загального холестерину і холестерину ліпопротеїнів низької щільності).
Background. Human lifestyle significantly affects human health and reproductive functions. The presence of hypothyroidism negatively impacts the health, activity, and reproductive status. This study was aimed to assess hormonal status, metabolic and anthropometric parameters in men of active reproductive age with primary hypothyroidism. Materials and methods. Totally 60 males with primary hypothyroidism were included in the study. A comparative analysis of hormonal, anthropometric, and metabolic parameters in 60 men with hypothyroidism (basic group) and 25 men without hypothyroidism and other chronic somatic diseases (control group) was performed. The mean age of the subjects was 42.4 ± 2.7 years. Results. It has been established that hypothyroidism was accompanied by an increase in serum concentrations of cholesterol and low-density lipoprotein cholesterol in comparison with control group (25 men without hypothyroidism) indicating metabolic disturbance. The data shows the significant effect of hypothyroidism on testosterone and follicle-stimulating hormone (FSH) serum concentration but not on luteinizing hormone, estradiol levels. Patients with hypothyroidism had lower circulating testosterone and higher FSH level in comparison with the controls. The reproductive hormone changes in men with hypothyroidism can result in deleterious effects on sexual functions including erectile dysfunction, reduced libido, and alteration in spermatogenesis. Conclusions. In men with hypothyroidism, changes in hormonal status have been found, which manifested in a decrease in testosterone and an increase in the blood level of follicle-stimulating hormone. The effect of hypothyroidism on the blood level of other hormones (luteinizing, estradiol, cortisol) has not been established. Hypothyroidism in men is accompanied by changes in lipid metabolism (increased levels of total cholesterol and low-density lipoprotein cholesterol).
гіпотиреоз; гіпогонадизм; тестостерон; гормональний статус; чоловіки
hypothyroidism; hypogonadism; testosterone; hormonal status; males
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Wagner M.S., Wajner S.M., Maia A.L. The role of thyroid hormone in testicular development and function. J. Endocrinol. 2008. № 199. Р. 351-365. doi: 10.1677/JOE-08-0218.
- Krassas G.E., Poppe K., Glinoer D. Thyroid function and human reproductive health. Endocr. Rev. 2010. № 31. Р. 702-755. doi: 10.1210/er.2009-0041.
- Voloshyna L., Doholich О., Sithinska I. Hypothyroidism — a special comorbidity factor in patients with osteoarthrosis: clinical, pathophysiological and prognostic aspects. Georgian Med. News. 2017. № 272. Р. 53-59.
- Verma I., Sood R., Juneja S., Kaur S. Prevalence of hypothyroidism in infertile women and evaluation of response of treatment for hypothyroidism on infertility. International Journal of Applied and Basic Medical Research. 2012. № 2(1). Р. 17-19. doi: 10.4103/2229-516x.96795.
- Krajewska-Kulak E., Sengupta P. Thyroid Function in Male Infertility. Front. Endocrinol. (Lausanne). 2013. № 4. Р. 174. doi: 10.3389/fendo.2013.00174.
- Krassas G.E., Papadopoulou F., Tziomalos K., Zeginiadou T., Pontikides N. Hypothyroidism has an adverse effect on human spermatogenesis: A prospective, controlled study. Thyroid. 2008. № 18. Р. 1255-1259. doi: 10.1089/thy.2008.0257.
- Singh R., Hamadaa A.J., Agarwal A. Thyroid hormones in male reproduction and fertility. Open Reprod. Sci. J. 2011. № 3. Р. 98-104. doi: 10.2174/1874255601103010098.
- Ajayi A.F., Akhigbe R.E., Ajayi L.O. Hypothalamic-pituitary-ovarian axis in thyroid dysfunction. West Indian Med. J. 2013. № 62. Р. 835-838. doi: 10.7727/wimj.2013.038.
- Aggerholm A.S., Thulstrup A.M., Toft G., Ramlau-Hansen C.H., Bonde J.P. Is overweight a risk factor for reduced semen quality and altered serum sex hormone profile? Fertil. Steril. 2008. № 90. Р. 619-626.
- Rambhatla A., Mills J.N., Rajfer J. The Role of Estrogen Modulators in Male Hypogonadism and Infertility. Rev. Urol. 2016. № 18(2). Р. 66-72. doi: 10.3909/riu0711.
- Jensen T.K., Andersson A.M., Jørgensen N., Andersen A.G., Carlsen E., Petersen J.H., Skakkebaek N.E. Body mass index in relation to semen quality and reproductive hormones among 1,558 Danish men. Fertil. Steril. 2004. № 82. Р. 863-870.
- Livingston M., Kalansooriya A., Hartland A.J., Ramachandran S., Heald A. Serum testosterone levels in male hypogonadism: Why and when to check — A review. Int. J. Clin. Pract. 2017. № 71(11). Р. e12995. doi: 10.1111/ijcp.12995.
- Nieschlag E., Simoni M., Gromoll J., Weinbauer G.F. Role of FSH in the regulation of spermatogenesis: clinical aspects. Clin. Endocrinol. 1999. № 51. Р. 139-146.
- British Society of Sexual Medicine. Guidelines of the management of sexual problems in men: the role of androgens. 2010. Р. 1-12. https://www.endocrinology.org/media/1454/10-12-01_uk-guidelines-androgens-male.pdf. Accessed June 21, 2017.
- Pye S.R., Huhtaniemi J.D., Finn D.M. et al., EMAS Study Group. Late-onset hypogonadism and mortality in aging men. J. Clin. Endocrinol. Metabol. 2014. № 99. Р. 1357-1366.
- Luchitsky Ye.V. Hypogonadism induced by the administration of anabolic steroids. International Journal of Endocrinology (Ukraine). 2019. № 15(3). Р. 78-82. doi: 10.22141/2224-0721.15.3.2019.172112.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. № 2. Р. 46-51. doi 10.21856/j-PEP.2019.2.07.

/38.jpg)