Газета «Новости медицины и фармации» №14 (774), 2021
Вернуться к номеру
Оцінка прогнозованого ризику онкологічних захворювань у хворих на цукровий діабет 2-го типу
Авторы: Вацеба Т.С. (1), Соколова Л.К. (2), Кошель Н.М. (3)
(1) — Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
(2) — ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
(3) — ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Вступ
Згідно з результатами новітніх досліджень, хворі на цукровий діабет (ЦД) 2-го типу мають підвищений ризик онкологічних захворювань (ОЗ) багатьох локалізацій, зокрема колоректального раку (КРР) [1], раку молочної залози (МЗ) [2], підшлункової залози (ПШЗ) [3, 4], тіла матки, печінки [5].
Однозначних даних щодо зростання онкоризику в пацієнтів із ЦД 1-го типу немає. Більшість досліджень не підтверджують вірогідного збільшення частоти раку в пацієнтів з ЦД 1-го типу [6, 7], хоча в дослідженні S.C. Larsson et al. у хворих на ЦД 1-го типу виявлений підвищений ризик раку шлунка, шийки матки й ендометрію [2].
Підвищений ризик ОЗ у хворих на ЦД 2-го типу закономірно відображається на показниках загальної онкологічної захворюваності за рахунок когорти пацієнтів з ЦД. Враховуючи тенденції прогресуючого зростання поширеності ЦД, обґрунтовано очікувати збільшення кількості пацієнтів з ОЗ. Виникає необхідність обізнаності пацієнтів щодо ролі діабет-асоційованих дисметаболічних порушень в активації процесів онкогенезу.
За результатами проведеного епідеміологічного дослідження, в хворих на ЦД 2-го типу в Івано-Франківській області доведений підвищений ризик ОЗ МЗ (P < 0,05), тіла матки (P < 0,05) та ПШЗ (P < 0,05) [8]. Аналіз даних виявив найбільшу частоту ОЗ у віковій категорії хворих 60–70 років на тлі декомпенсованого ЦД середньої тяжкості тривалістю більше п’яти років [8].
Додатковий аналіз пацієнтів з ОЗ різних локалізацій, діагностованими на фоні ЦД 2-го типу, виявив відмінності клінічних характеристик, особливостей перебігу та терапії діабету у хворих з ОЗ ПШЗ порівняно з хворими з гормон-залежними формами раку та з КРР [8]. Підтверджена необхідність диференційованого підходу при аналізі значущості впливу різних факторів при вказаних локалізаціях ОЗ. Оцінка індивідуального прогнозованого онкоризику може бути одним із етапів первинної профілактики ОЗ у хворих на ЦД 2-го типу.
Метою даної роботи було створення моделі математичного розрахунку та оцінки прогнозованого ризику ОЗ МЗ, тіла матки, ПШЗ, колоректальної локалізації у хворих на ЦД 2-го типу з огляду на значущість діабет-асоційованих чинників онкогенезу.
Матеріали та методи
Дослідження проводилося відповідно до керівних принципів Гельсінської декларації 1975 року та її переглянутої версії 1983 року. Дослідження проведене на основі аналізу медичних карт стаціонарних та амбулаторних пацієнтів з ОЗ МЗ, тіла матки, ПШЗ та колоректальної локалізації, діагностованими на фоні ЦД 2-го типу впродовж 2012–2016 років. Базами для проведення дослідження були: КНП «Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради», КНП «Обласна клінічна лікарня Івано-Франківської обласної ради», медичні заклади Івано-Франківської області.
Аналіз даних проводили за допомогою програми Statistica 12.0 (StatSoft Inc., США). Відмінності між показниками в групах порівняння визначали за t-критерієм Стьюдента і вважали вірогідними при Р < 0,05.
Дослідження схвалене комісією з етики Івано-Франківського національного медичного університету (протокол № 3 від 17.02.2020 р.).
Для математичного розрахунку прогнозованого ризику ОЗ вказаних локалізацій застосували багатофакторний аналіз і рівняння логістичної регресії. Для представлення коефіцієнта прогнозованого ризику ОЗ (Y) використовували формулу логістичного перетворення Y = 1/(1 + 2,71–Y), де 2,71 — коефіцієнт логістичного перетворення.
Результати
Проведений порівняльний аналіз клінічних характеристик і компенсації ЦД у хворих з ОЗ МЗ, тіла матки, ПШЗ, колоректальної локалізації (табл. 1).
За отриманими результатами виявлено, що порівняно з показниками хворих з ОЗ ПШЗ вірогідно вищий ІМТ та більшу тривалість ЦД до виявлення ЗН мали хворі з ОЗ МЗ (P < 0,05), тіла матки (P < 0,05) та колоректальної локалізації (P < 0,05). Пацієнти із злоякісними пухлинами тіла матки були молодшими за віком (P < 0,05). Відмінностей компенсації ЦД за рівнем HbA1c виявлено не було (табл. 1).
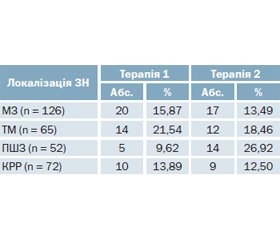
Проведений аналіз цукрознижуючої терапії (ЦЗТ) пацієнтів. Схеми ЦЗТ були поєднані в наступні групи (терапія 1–6): терапія 1 — цукрознижуючі препарати (ЦЗП) без впливу на синтез інсуліну (метформін, глітазони, гліфлозини); терапія 2 — стимулятори синтезу інсуліну (похідні сульфонілсечовини (СС), гліптини); терапія 3 — комбінація препаратів першої і другої груп; терапія 4 — інсулінотерапія (монотерапія або в поєднанні з похідними СС); терапія 5 — дієтотерапія; терапія 6 — комбінація інсуліну з препаратами, що не впливають на його синтез.
Вивчені особливості ЦЗТ хворих на ЦД 2-го типу залежно від локалізації ЗН (табл. 2).
Встановлено, що ОЗ МЗ та тіла матки найчастіше діагностували в жінок віком 60–70 років, з ожирінням, тривалістю ЦД > 5 років, з рівнем HbA1c > 7,5 % та при використанні комбінованої терапії (терапія 3), що включає поєднання ЦЗП без впливу на синтез інсуліну (метформін, глітазони, гліфлозини) із стимуляторами синтезу інсуліну (похідні СС, гліптини).
Отримані результати використані для створення моделі математичного розрахунку коефіцієнта прогнозованого ризику ОЗ (Y) МЗ та тіла матки у жінок з ЦД 2-го типу за рівнянням логістичної регресії.
Розрахунок прогнозованого ризику злоякісних пухлин МЗ та тіла матки:
Y = 0,005 × вік + 0,15 × HbA1c + 0,33 × ІМТ + 0,17 × тривалість ЦД + 0,38 × терапія (1–6) – 14,9.
Точність моделі становить 76,24 %. Належність до групи 0 — «немає ризику раку» — визначається моделлю з точністю 80,18 %, а до групи 1 — «ризик ОЗ високий» — з точністю 71,43 %, площа під кривою AUC = 0,853 (0,796–0,899), χ2-квадрат = 80,4, P < 0,001. Модель має високу прогностичну силу, AUC = 0,853, P < 0,001, порівняно з діагоналлю (AUC = 0,5), що доводить високу вірогідність оцінки ймовірності розвитку раку залежно від рівня незалежних показників, які увійшли в модель.
Найбільшу значущість при розрахунку коефіцієнта прогнозованого ризику ОЗ МЗ і тіла матки мали ІМТ (P < 0,001), тривалість ЦД (P < 0,001) і схема ЦЗТ (P < 0,001).
За отриманими даними, ОЗ ПШЗ найчастіше діагностували у хворих на ЦД 2-го типу віком 60–70 років, без ожиріння, з тривалістю захворювання < 5 років, з рівнем HbA1c > 7,5 %, на монотерапії інсуліном (терапія 4) або похідними СС (терапія 2), без гендерних відмінностей.
Розрахунок прогнозованого ризику злоякісних пухлин ПШЗ:
Y = 0,315 × стать – 0,209 × ІМТ – 0,035 × вік + 0,313 × HbA1c – 0,34 × тривалість ЦД – 0,52 × терапія (1–6) + 7,15.
Точність моделі становить 75,0 %. Належність до групи 0 — «немає ризику раку» — визначається моделлю з точністю 87,50 %, а до групи 1 — «ризик ОЗ високий» — з точністю 55,0 %, площа під кривою AUC = 0,797 (0,662–0,896), χ2-квадрат = 15,5, P = 0,016. Модель має добру прогностичну силу, AUC = 0,797, P = 0,016, порівняно з діагоналлю (AUC = 0,5), що доводить вірогідну оцінку ймовірності розвитку раку залежно від рівня незалежних показників, які увійшли в модель.
Найбільшу значущість при розрахунку коефіцієнта прогнозованого ризику ОЗ ПШЗ мали ІМТ (P < 0,05), тривалість ЦД (P < 0,05) і схема ЦЗТ (P < 0,05).
КРР найчастіше діагностували у хворих віком 60–70 років, з ожирінням, тривалістю ЦД > 5 років, з рівнем HbA1c > 7,5 %, при використанні комбінованої терапії, що включає поєднання ЦЗП без впливу на синтез інсуліну (метформін, глітазони, гліфлозини) зі стимуляторами синтезу інсуліну (похідні СС, гліптини) (терапія 3), без гендерних відмінностей.
Розрахунок ризику КРР:
Y = 0,40 × ІМТ + 0,02 × вік + 0,31 × HbA1c – 0,04 × тривалість ЦД + 0,21 × терапія (1–6) – 0,68 × стать – 16,5.
Точність моделі становить 72,2 %. Належність до групи 0 — «немає ризику раку» — визначається моделлю з точністю 81,40 %, а до групи 1 — «ризик ОЗ високий» — з точністю 58,6 %, площа під кривою AUC = 0,834 (0,728–0,911), χ2-квадрат = 26,5, P < 0,001. Модель має добру прогностичну силу, AUC = 0,834, P < 0,001, порівняно з діагоналлю (AUC = 0,5), що доводить вірогідну оцінку ймовірності розвитку раку залежно від рівня незалежних показників, які увійшли в модель.
Найбільшу значущість при розрахунку коефіцієнта прогнозованого ризику КРР мав показник ІМТ (P < 0,05).
Оцінка прогнозованого ризику ОЗ у хворих на ЦД 2-го типу: Y = 0,1–0,3 — ризик низький; 0–3–0,6 — ризик середній; 0,6–1,0 — ризик високий.
Обговорення
Згідно з отриманими даними епідеміологічного дослідження, чинниками, що впливають на формування підвищеного ризику ОЗ у хворих на ЦД 2-го типу, незалежно від локалізації є вік понад 60 років та декомпенсація ЦД.
Поширеність ОЗ в осіб старшого віку можливо пов’язати з клітинним старінням (сенесценцією), що тісно пов’язане з поняттям апоптозу. Доведено, що наслідком впливу ендогенних або екзогенних факторів пошкодження ДНК є активація каскадів специфічних кіназ і генів, які в кінцевому результаті, впливаючи на клітинний цикл, або спричиняють його сповільнення (для усунення пошкодження), або, якщо репарація неможлива, призводять до апоптозу змінених клітин [9]. Тобто апоптоз клітин із пошкодженим ДНК зумовлює зупинку їх клітинного циклу та старіння. З цієї точки зору старіння є механізмом захисту від раку.
Проте встановлено, що у старшому віці апоптоз пошкоджених клітин може не відбуватися або є неефективним. Поясненням служить зміна експресії генів, відповідальних за контроль апоптозу (зокрема, генів-онкосупресорів). Існує думка, що експресія була посиленою в репродуктивному (молодому) віці через необхідність регуляції виживаності та апоптозу клітин в умовах надмірного впливу чинників пошкодження ДНК [10].
Важливим фактором захисту від ОЗ є імунологічний контроль. Відомо про локальну запальну реакцію навколо сенесцентних клітин, що регулюється впливом імунокомпетентних клітин. Імуносенесценція зумовлює неефективний імунологічний контроль. Прозапальні цитокіни в зоні локального запалення створюють мікрооточення, в якому змінені клітини (в умовах неефективного імунологічного нагляду) набувають здатності виживати в некомфортних умовах та уникати апоптозу.
Хронічна гіперглікемія — потужний фактор онкогенезу. Доведено, що гіперглікемія прискорює клітинний цикл за рахунок регулювання активності циклінзалежної кінази 2, фактора транскрипції E2F, цикліну А та цикліну E, що сприяє проліферації [11].
Проліферативний ефект гіперглікемії обумовлений підвищеною експресією GLUT-1 і GLUT-3 на поверхні клітин у відповідь на збільшення концентрації глюкози [12]. Внутрішньоклітинне перенасичення глюкозою призводить до інтенсифікації гліколізу, циклу трикарбонових кислот, що зумовлює гіперпродукцію вільних радикалів, зокрема супероксид-аніону, який при взаємодії з іншими сполуками перетворюється на гідроксил-радикал, пероксид водню та пероксинітрит [13]. Накопичення пероксинітриту спричиняє розвиток оксидативно-нітративного стресу. Шляхом модифікації тирозинових залишків у структурі білків пероксинітрит зумовлює втрату їх біологічних функцій, змінюючи активність сигнальних молекул та ензимів [14]. При ЦД саме ОС може спричинити пошкодження ДНК і, як наслідок, хромосомні аберації у клітині [15]. Антиапоптичний ефект гіперглікемії зумовлений зниженим рівнем глутатіону, антиоксидантного чинника, під впливом активації пентозофосфатного шляху метаболізму глюкози при ЦД [16].
Згідно з отриманими результатами, підтверджена роль ожиріння в розвитку ОЗ МЗ, тіла матки та колоректального раку. Наукові дослідження доводять, що ожиріння вірогідно підвищує ризик постменопаузального раку МЗ, ендометрію та яєчників [17]. Пухлини даної локалізації є гормонозалежними. Механізмами онкогенезу, асоційованими з ожирінням, є гіперестрогенія, зумовлена інтенсивним перетворенням андрогенних попередників в естрадіол у жировій тканині, а також зниженням рівня глобуліну, що пов’язує статеві гормони, внаслідок гіперінсулінемії. Тривала гіперестрогенія та дефіцит прогестерону сприяють розвитку проліферативних процесів і раку МЗ та ендометрію [18].
Вплив ожиріння на розвиток КРР зумовлений поєднаним впливом цитокінового дисбалансу (прозапальних цитокінів: фактора некрозу пухлин α (TNF-α), інтерлейкіну-6 (IL-6), IL-8, IL-18 та ін.) [19] та дисбіозом кишечника, недостатністю грампозитивних бактерій, що мають протизапальні властивості, регулюють метаболізм білків та ензимів, а також, пригнічуючи ядерний фактор епітеліоцитів товстого кишечника (NF-κB), впливають на експресію генів — регуляторів імунної відповіді, апоптозу та клітинного циклу [20].
Переважна більшість випадків ОЗ МЗ, тіла матки та КРР були діагностовані у хворих на ЦД 2-го типу з тривалістю захворювання більше п’яти років. Такі ж висновки отримані при аналізі поширеності ОЗ у хворих на ЦД в Тірольському дослідженні 2014 року [2] та в дослідженні P. Ballotari та співавт. у Північній Італії 2017 року [21].
За результатами аналізу ЦЗТ, переважна більшість хворих з ОЗ МЗ, тіла матки та з КРР до діагностики в них ЗН отримували комбіновану терапію, що включала метформін та похідні СС. Вказана схема терапії і на сьогодні залишається однією з найбільш поширених у лікуванні хворих на ЦД 2-го типу. Доведені в численних дослідженнях онкопротекторні властивості метформіну [22] дозволяють припустити, що можливий негативний вплив зумовлений застосуванням похідних СС, зокрема для терапії хворих з ожирінням, з огляду на їх здатність збільшувати синтез інсуліну, сприяючи гіперінсулінемії, збільшенню ваги, формуючи замкнене коло інсулінорезистентності, цитокінового дисбалансу, некоригованої гіперглікемії та ОС як чинника пошкодження ДНК.
Відмінності клінічних характеристик, особливостей перебігу та терапії ЦД у хворих з ОЗ ПШЗ порівняно з хворими з гормон-залежними формами раку та з КРР визначили необхідність провести окремий математичний розрахунок прогнозованого ризику панкреатичного раку.
Відсутність ожиріння у хворих з ОЗ ПШЗ доводить ймовірне існування інших механізмів розвитку раку ПШЗ у хворих на ЦД 2-го типу. Аналіз літературних джерел підтвердив існування двох типів ЦД у хворих з панкреатичним раком, а саме ЦД 2-го типу з притаманним для нього ожирінням, інсулінорезистентністю і гіперінсулінемією та вторинного (панкреатогенного діабету типу 3c), асоційованого з панкреатичним раком [23–25], що визначає необхідність їх диференціювання при вперше діагностованому ЦД у старшому віці. Рання потреба в терапії інсуліном, малий стаж діабету до виявлення ОЗ можуть бути непрямими доказами діабету типу 3c.
Таким чином, результати проведеного дослідження підтверджують важливий вплив дисметаболічних порушень на розвиток ОЗ у пацієнтів із ЦД 2-го типу. Підвищений ризик ОЗ, асоційований з ожирінням, має бути врахованим при виборі схеми ЦЗТ хворих на ЦД 2-го типу. Існує необхідність лабораторної ідентифікації типу діабету у хворих з вперше діагностованим ЦД віком понад 50 років, без ожиріння та гіперінсулінемії.
Висновки
Корекція дисметаболічних порушень у хворих на ЦД 2-го типу є важливим фактором профілактики не лише серцево-судинних, а й онкологічних захворювань. Застосування запропонованого методу математичного розрахунку прогнозованого ризику онкологічних захворювань сприятиме профілактиці злоякісних новоутворень в хворих на ЦД 2-го типу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Фінансування. Робота включена в тематику двох комплексних НДР Івано-Франківського національного медичного університету «Патогенетичні механізми розвитку змін в органах дихальної, ендокринної, нервової систем при змодельованих патологічних станах та їх корекція» (номер держреєстрації 0117U001758) та «Наукове обґрунтування та удосконалення діагностики і лікування ендокринопатій на основі вивчення пріоритетних етіопатогенетичних факторів та коморбідних станів» (номер держреєстрації 0120U105103), без спеціального фінансування.
Подяка. Автори статті висловлюють щиру подяку адміністрації, працівникам відділень статистичної обробки інформації та архіву, а також лікарям профільних відділень КНП «Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради», КНП «Обласна клінічна лікарня Івано-Франківської обласної ради», медичних закладів Івано-Франківської області за допомогу у зборі даних, необхідних для епідеміологічного дослідження.
Список литературы
1. Larsson S.C., Orsini N., Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J. Natl. Cancer Inst. 2005. 97(22). 1679-87. doi: https://doi.org/10.1093/jnci/dji375.
2. Larsson S.C., Mantzoros C.S., Wolk A. Diabetes mellitus and risk of breast cancer: a meta-analysis. Int. J. Cancer. 2007. 121(4). 856-62. doi: https://doi.org/10.1002/ijc.22717.
3. Huxley R., Ansary-Moghaddam A., Berrington de González A., Barzi F., Woodward M. Type-II diabetes and pancreatic cancer: a meta-analysis of 36 studies. Br. J. Cancer. 2005. 92(11). 2076-83. doi: https://doi.org/10.1038/sj.bjc.6602619.
4. Ben Q., Xu M., Ning X., Liu J., Hong S., Huang W. et al. Diabetes mellitus and risk of pancreatic cancer: A meta-analysis of cohort studies. Eur. J. Cancer. 2011. 47(13). 1928-37. doi: https://doi.org/10.1016/j.ejca.2011.03.003.
5. Oberaigner W., Ebenbichler C., Oberaigner K., Juchum M., Schönherr H.R., Lechleitner M. Increased cancer incidence risk in type 2 diabetes mellitus: results from a cohort study in Tyrol/Austria. BMC Public Health. 2014. 14. 1058. doi: https://doi.org/10.1186/1471-2458-14-1058.
6. Carstensen B., Jørgensen M.E., Friis S. The epidemiology of diabetes and cancer. Curr. Diab. Rep. 2014. 14(10). 535. doi: https://doi.org/10.1007/s11892-014-0535-8.
7. Gordon-Dseagu V.L., Shelton N., Mindell J.S. Epidemiological evidence of a relationship between type-1 diabetes mellitus and cancer: a review of the existing literature. Int. J. Cancer. 2013. 132(3). 501-8. doi: https://doi.org/10.1002/ijc.27703.
8. Vatseba T.S., Sokolova L.K., Kuzenko R.T. Epidemiology of pancreatic cancer in patients with type 2 diabetes in Ivano-Frankivsk region. Probl. Endocr. Pathol. 2020. 1(71). 14-23. doi: https://doi.org/10.21856/j-PEP.2020.1.02.
9. Zinger A., Cho W.C., Ben-Yehuda A. Cancer and Aging — the Inflammatory Connection. Aging Dis. 2017. 8(5). 611-627. doi: 10.14336/AD.2016.1230.
10. Masur K., Vetter C., Hinz A., Tomas N., Henrich H., Niggemann B. et al. Diabetogenic glucose and insulin concentrations modulate transcriptome and protein levels involved in tumour cell migration, adhesion and proliferation. Br. J. Cancer. 2011. 104(2). 345-52. doi: 10.1038/sj.bjc.6606050.
11. Ryu T.Y., Park J., Scherer P.E. Hyperglycemia as a risk factor for cancer progression. Diabetes Metab. J. 2014. 38(5). 330-6. doi: 10.4093/dmj.2014.38.5.330.
12. Pacher P., Beckman J.S., Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol. Rev. 2007. 87(1). 315-424. doi: 10.1152/physrev.00029.2006.
13. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011. 144(5). 646-74. doi: 10.1016/j.cell.2011.02.013.
14. Drel V.R. Main mechanisms of the initiation and development of diabetic complications: the role of nitrative stress. Biol. Stud. 2010. 4(2). 141-158. doi: 10.30970/sbi.0402.085.
15. Heuson J.C., Legros N., Heimann R. Influence of insulin administration on growth of the 7,12-dimethylbenz(a)anthracene-induced mammary carcinoma in intact, oophorectomized, and hypophysectomized rats. Cancer Res. 1972. 32(2). 233-8. PMID: 5058184.
16. Kennedy L., Sandhu J.K., Harper M.E., Cuperlovic-Culf M. Role of Glutathione in Cancer: From Mechanisms to Therapies. Biomolecules. 2020. 10(10). 1429. doi: 10.3390/biom10101429.
17. Martin R.M., Vatten L., Gunnell D., Romundstad P., Nilsen T.I. Components of the metabolic syndrome and risk of prostate cancer: the HUNT 2 cohort, Norway. Cancer Causes Control. 2009. 20(7). 1181-92. doi: 10.1007/s10552-009-9319-x.
18. Vatseba T.S., Sokolova L.K., Pushkarev V.M. The effect of obesity on the formation of cancer risk in patients with type 2 diabetes (literature review). Mìžnarodnij endokrinologìčnij žurnal. 2020. 16(2). 161-167. doi: https://doi.org/10.22141/22240721.16.2.2020.201303.
19. Wu Y., Liu Y., Dong Y., Vadgama J. Diabetes-associated dysregulated cytokines and cancer. Integr. Cancer Sci Ther. 2016. 3(1). 370-378. doi: 10.15761/ICST.1000173.
20. McNabney S.M., Henagan T.M. Short Chain Fatty Acids in the Colon and Peripheral Tissues: A Focus on Butyrate, Colon Cancer, Obesity and Insulin Resistance. Nutrients. 2017. 9(12). 1348. doi: 10.3390/nu9121348.
21. Ballotari P., Vicentini M., Manicardi V., Gallo M., Chiatamone Ranieri S., Greci M. et al. Diabetes and risk of cancer incidence: results from a population-based cohort study in northern Italy. BMC Cancer. 2017. 17(1). 703. doi: 10.1186/s12885-017-3696-4.
22. Batandier C., Guigas B., Detaille D., El-Mir M.Y., Fontaine E., Rigoulet M. et al. The ROS production induced by a reverse-electron flux at respiratory-chain complex 1 is hampered by metformin. Bioenerg. Biomembr. 2006. 38(1). 33-42. doi: 10.1007/s10863-006-9003-8.
23. Kalender A., Selvaraj A., Kim S.Y., Gulati P., Brûlé S., Viollet B. et al. Metformin, independent of AMPK, inhibits mTORC1 in a rag GTPase-dependent manner. Cell. Metab. 2010. 11(5). 390-401. doi: 10.1016/j.cmet.2010.03.014.
24. Cui Y., Andersen D.K. Diabetes and pancreatic cancer. Endocr. Relat. Cancer. 2012. 19(5). F9-F26. doi: 10.1530/ERC-12-0105.
25. Andersen D.K., Korc M., Petersen G.M., Eibl G., Li D., Rickels M.R. et al. Diabetes, Pancreatogenic Diabetes, and Pancreatic Cancer. Diabetes. 2017. 66(5). 1103-10. doi: 10.2337/db16-1477.

/6_m.jpg)