Международный эндокринологический журнал Том 17, №7, 2021
Вернуться к номеру
Фактори прогнозу прогресування діабетичної хвороби нирок у хворих на цукровий діабет 2-го типу за даними тривалого моніторингу глікемії
Авторы: Мошенець К.І., Перцева Н.О.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
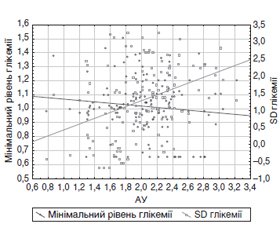
Актуальність. Поряд зі зростанням захворюваності на цукровий діабет (ЦД) 2-го типу збільшується кількість хворих з тяжкими хронічними ускладненнями. Діабетична хвороба нирок (ДХН) посідає провідне місце серед причин смерті цих хворих після серцево-судинних захворювань. Мета дослідження: спрогнозувати прогресування ДХН у хворих на ЦД 2-го типу залежно від варіабельності глікемії (ВГ) за даними тривалого моніторингу глікемії. Матеріали та методи. Обстежені 53 пацієнти з ЦД 2-го типу віком 57,0 (51,0; 64,0) року із середньою тривалістю захворювання 9,0 (6,0; 13,0) року. Лабораторне дослідження включало визначення глікованого гемоглобіну, креатиніну крові, альбумінурії (АУ), швидкості клубочкової фільтрації за формулою CKD-EPI. Визначення ВГ відбувалось за допомогою системи iPro2 GMS. Враховували максимальне, мінімальне значення глікемії та стандартне відхилення (SD) глікемії. Прогнозування прогресування ДХН залежно від варіабельності глікемії встановлювалось із застосуванням множинного регресійного аналізу з використанням покрокового методу. Результати. ДХН відзначалася у 41,51 % обстежених хворих. За даними регресійного аналізу винайдено рівняння лінійної багатофакторної регресії для опису залежності рівня АУ від показників ВГ, F = 10,39 (p < 0,001). Варіативність АУ на 36,7 % обумовлена мінімальним рівнем глікемії та SD глікемії — коефіцієнт множинної кореляції R = 0,6372, коефіцієнт детермінації R2 = 0,4060, скоригований R2 = 0,3670. Парціальний коефіцієнт кореляції між АУ та SD глікемії r = 0,25 (р = 0,027); між АУ та мінімальним рівнем глюкози r = 0,31 (р = 0,005). Висновки. За результатами кореляційного аналізу встановлено вірогідний вплив ВГ, а також значення мінімального рівня глікемії на рівень АУ. Статистично доведено, що високі коливання глікемії повинні розглядатися як фактор прогнозу прогресування ДХН у хворих на ЦД 2-го типу. Із застосуванням регресійного аналізу розроблено математичну модель прогресування ДХН на основі показників ВГ для хворих на ЦД 2-го типу.
Background. An increase in the prevalence of type 2 diabetes mellitus (DM) is accompanied by an increase in the number of patients with severe chronic complications. Diabetic kidney disease (DKD) is the leading cause of death in these patients after cardiovascular diseases. The purpose was to predict the progression of DKD in patients with type 2 diabetes mellitus depending on the glucose variability (GV) measured by continuous glucose monitoring. Materials and methods. We examined 53 type 2 DM patients aged 57.0 (51.0; 64.0) years with an average disease duration of 9.0 (6.0; 13.0) years. The laboratory examination included determination of glycated hemoglobin, blood creatinine, albuminuria (AU), glomerular filtration rate (GFR) according to CKD-EPI equation. GV was measured by iPro2 GMS system. The maximum and minimum blood glucose levels and standard deviation (SD) of glycemia were considered. The role of GV in predicting DKD progression has been established using stepwise multiple regression analysis. Results. DKD was detected in 41.51 % of patients. In regression analysis, we created a linear multiple regression equation to describe the dependence of AU on the GV, F = 10.39 (p < 0.001). The variability of AU by 36.7 % is due to the minimum level of glycemia and SD of glycemia — multiple correlation coefficient R is 0.6372, the coefficient of determination R2 is 0.4060, adjusted R2 is 0.3670. Partial coefficient of correlation between AU and SD of glycemia, r = 0.25 (p = 0.027); between AU and the minimum blood glucose level, r = 0.31 (p = 0.005). Conclusions. According to the results of correlation analysis, a significant effect of GV, as well as the value of minimum blood glucose level on AU was established. It is statistically proved that high fluctuations of glycemia (SD) should be considered as a factor predicting the progression of DKD in type 2 DM patients. Using regression analysis, a mathematical model of DKD progression in type 2 DM patients was developed based on GV parameters.
цукровий діабет 2-го типу; діабетична хвороба нирок; варіабельність глікемії; прогнозування
type 2 diabetes mellitus; diabetic kidney disease; glucose variability; prognosis
Вступ
Матеріали та методи
Результати
/32.jpg)
/33.jpg)
/34.jpg)
Обговорення
Висновки
- Sagoo M.K., Gnudi L. Diabetic Nephropathy: An Overview. Methods Mol. Biol. 2020. 2067. 3-7. doi: 10.1007/978-1-4939-9841-8_1.
- A/L B Vasanth Rao V.R., Tan S.H., Candasamy M., Bhattamisra S.K. Diabetic nephropathy: An update on pathogenesis and drug development. Diabetes Metab. Syndr. 2019 Jan-Feb. 13(1). 754-762. doi: 10.1016/j.dsx.2018.11.054.
- Papadopoulou-Marketou N., Kanaka-Gantenbein C., Marketos N., Chrousos G.P., Papassotiriou I. Biomarkers of diabetic nephropathy: A 2017 update. Crit. Rev. Clin. Lab. Sci. 2017 Aug. 54(5). 326-342. doi: 10.1080/10408363.2017.1377682.
- Zheng Y., Ley S.H., Hu F.B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat. Rev. Endocrinol. 2018 Feb. 14(2). 88-98. doi: 10.1038/nrendo.2017.151.
- Patel A.; ADVANCE Collaborative Group, MacMahon S. et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet. 2007 Sep 8. 370(9590). 829-40. doi: 10.1016/S0140-6736(07)61303-8.
- King P., Peacock I., Donnelly R. The UK prospective diabetes study (UKPDS): clinical and therapeutic implications for type 2 diabetes. Br. J. Clin. Pharmacol. 1999 Nov. 48(5). 643-8. doi: 10.1046/j.1365-2125.1999.00092.x. PMID: 10594464; PMCID: PMC2014359.
- American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2021. Diabetes Care. 2021 Jan. 44(Suppl. 1). S15-S33. doi: 10.2337/dc21-S002.
- Raghavan S., Vassy J.L., Ho Y.L., Song R.J., Gagnon D.R., Cho K., Wilson P.W.F., Phillips L.S. Diabetes Mellitus-Related All-Cause and Cardiovascular Mortality in a National Cohort of Adults. J. Am. Heart Assoc. 2019 Feb 19. 8(4). Е011295. doi: 10.1161/JAHA.118.011295.
- Lin Y.H., Huang Y.Y., Chen H.Y., Hsieh S.H., Sun J.H., Chen S.T., Lin C.H. Impact of Carbohydrate on Glucose Variability in Patients with Type 1 Diabetes Assessed Through Professional Continuous Glucose Monitoring: A Retrospective Study. Diabetes Ther. 2019 Dec. 10(6). 2289-2304. doi: 10.1007/s13300-019-00707-x.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. DOI: 10.5603/AH.a2019.0012
- Sakamoto M. Type 2 diabetes and glycemic variability: various parameters in clinical practice. J. Clin. Med. Res. 2018. 10(10). 737-42. doi: 10.14740/jocmr3556w.
- Order of HM Ukraine from 21.12.2012 N 1118. The unified clinical protocols of primary and secondary (specialized) medical care. Type 2 diabetes mellitus. Kyiv, 2012. 115 p. (in Ukrainian).
- Levey A.S., Stevens L.A., Schmid C.H., Zhang Y.L., Castro A.F. 3rd, Feldman H.I., Kusek J.W. et al.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann. Intern. Med. 2009 May 5. 150(9). 604-12. doi: 10.7326/0003-4819-150-9-200905050-00006.
- Taub P.J., Westheimer E. Biostatistics. Plast. Reconstr. Surg. 2009 Aug. 124(2). 200e-208e. doi: 10.1097/PRS.0b013e3181addcd9. PMID: 19644245.
- Rodbard D. Glucose Variability: A Review of Clinical Applications and Research Developments. Diabetes Technol. Ther. 2018 Jun. 20(S2). S25-S215. doi: 10.1089/dia.2018.0092.
- Viazzi F., Russo G.T., Ceriello A. et al. Natural history and risk factors for diabetic kidney disease in patients with T2D: lessons from the AMD-annals. J. Nephrol. 2019 Aug. 32(4). 517-525. doi: 10.1007/s40620-018-00561-3.
- Subramanian S., Hirsch I.B. Diabetic Kidney Disease: Is There a Role for Glycemic Variability? Curr. Diab. Rep. 2018 Feb 15. 18(3). 13. doi: 10.1007/s11892-018-0979-3.
- Hissa M.R.N., Hissa P.N.G., Guimarães S.B., Hissa M.N. Use of continuous glucose monitoring system in patients with type 2 mellitus diabetic during hemodialysis treatment. Diabetol. Metab. Syndr. 2021 Oct 9. 13(1). 104. doi: 10.1186/s13098-021-00722-8.
- Ceriello A., De Cosmo S., Rossi M.C. et al. Variability in HbA1c, blood pressure, lipid parameters and serum uric acid, and risk of development of chronic kidney disease in type 2 diabetes. Diabetes Obes. Metab. 2017 Nov. 19(11). 1570-1578. doi: 10.1111/dom.12976.
- Yeoh E., Lim B.K., Fun S. et al. Efficacy of self-monitoring of blood glucose versus retrospective continuous glucose monitoring in improving glycaemic control in diabetic kidney disease patients. Nephrology (Carlton). 2018 Mar. 23(3). 264-268. doi: 10.1111/nep.12978.
- Tsaryk I.O., Pashkovska N.V. Peculiarities of the course of diabetic kidney disease in patients with latent autoimmune diabetes in adults. International Journal of Endocrinology (Ukraine). 2021. 17(2). 116-120. doi: 10.22141/2224-0721.17.2.2021.230565
- Chan C.L., Pyle L., Kelsey M.M. et al. Alternate glycemic markers reflect glycemic variability in continuous glucose monitoring in youth with prediabetes and type 2 diabetes. Pediatr. Diabetes. 2017 Nov. 18(7). 629-636. doi: 10.1111/pedi.12475.
- Breyton A.E., Lambert-Porcheron S., Laville M., Vinoy S., Nazare J.A. CGMS and Glycemic Variability, Relevance in Clinical Research to Evaluate Interventions in T2D, a Literature Review. Front Endocrinol (Lausanne). 2021 Sep 9. 12. 666008. doi: 10.3389/fendo.2021.666008.

/33_2.jpg)