Весной этого года были опубликованы новые рекомендации Европейского совета по реанимации (ERC’2021), которые внесли ряд изменений в алгоритм сердечно-легочной реанимации (СЛР) [1, 2] и рекомендации по интенсивной терапии постреанимационного периода, разработанные совместно с Европейским обществом интенсивной медицины (ESICM) [3]. Пандемия COVID-19, вызвавшая развитие мирового кризиса, привела к глобальному переосмыслению возможностей использования существующих медицинских ресурсов, и наиболее критично это коснулось интенсивной медицины, что обусловило множественные ограничения возможности проведения эффективной СЛР. В 2020 г. был опубликован ряд рекомендаций Европейского совета по реанимации и Американской ассоциации сердца (АНА), которые касались особенностей проведения СЛР в условиях пандемии COVID-19 [4, 5]. На сегодняшний день однозначных ответов на возникшую проблему нет, но эта задача требует своего решения.
Частота внегоспитальной остановки кровообращения в Европе варьирует от 67 до 170 случаев на 100 000 населения в год. При этом выживаемость на этапе выписки из больницы остается на достаточно низком уровне и в среднем составляет 8 % (от 0 до 18 %) [6].
Необходимо подчеркнуть, что в европейских странах, в которых прекращение жизнеподдерживающей терапии в отделениях интенсивной терапии (т.е. осуществления пассивной эйтаназии у пациентов в случаях развития неблагоприятного неврологического статуса) является рутинной практикой, хороший неврологический исход регистрируется у более чем 90 % пациентов, перенесших остановку кровообращения, и большинство из них возвращаются к работе.
Напротив, в странах, где не практикуется прекращение жизнеподдерживающей терапии, неврологические исходы менее благоприятны (только около 50 %) и характеризуются большим уровнем инвалидизации. Так, развитие персистирующего вегетативного состояния регистрируется в 33 % случаев [6].
Среди лиц, перенесших остановку кровообращения и имевших хорошее неврологическое восстановление, наиболее часто отмечались когнитивные нарушения, быстрая утомляемость, проблемы в эмоциональной сфере, являясь, таким образом, характерными факторами, обусловливающими снижение качества жизни.
Современные организационные принципы оказания помощи базируются на «цепочке выживания», которая включает: раннее распознавание остановки кровообращения и сообщение соответствующим службам, скорейшее начало СЛР, включая раннюю дефибрилляцию, а также оказание специализированной помощи на раннем этапе постреанимационного периода.
Первичным механизмом остановки кровообращения на догоспитальном этапе в 76 % случаев является развитие фибрилляции желудочков (ФЖ) [7]. Этот факт подчеркивает важность общественно доступной дефибрилляции с использованием автоматических наружных дефибрилляторов — AED (Automatic External Defibrillator), что позволяет обеспечить условия для проведения ранней дефибрилляции в местах значительного скопления людей, продемонстрировавшей свою высокую эффективность во всем мире. Однако, согласно европейским данным, частота использования автоматических наружных дефибрилляторов остается достаточно низкой и составляет в среднем 28 % (от 3,8 до 59 % в разных странах Европы) [6]. К большому сожалению, в Украине за последние годы внедрение общественно доступной дефибрилляции так и осталось на уровне отдельных спорадических случаев. Поскольку основной успех СЛР, обеспечивающий хорошие неврологические исходы, достигается, согласно данным мировой статистики, именно на догоспитальном этапе, особое значение приобретает системная подготовка диспетчеров службы неотложной медицинской помощи, которые по телефону смогут консультировать обратившихся за помощью лиц и инструктировать непрофессионалов в проведении СЛР до момента приезда бригады неотложной медицинской помощи, что уже давно реализовано за рубежом.
Базовое поддержание жизни (Basic Life Support — BLS)
Основной акцент при обучении непрофессионалов должен быть сделан на таких признаках критического состояния, как бессознательное состояние и нарушение внешнего дыхания, которые должны использоваться в качестве маркеров наступления остановки кровообращения. Таким образом, для непрофессионалов при наличии двух признаков — пострадавший без сознания и после восстановления проходимости дыхательных путей не дышит или плохо дышит — необходимо вызвать скорую помощь, обратиться к окружающим за помощью и немедленно начать СЛР. При наличии автоматического внешнего дефибриллятора необходимо его включить и следовать его командам.
Указанные диагностические критерии остановки кровообращения для непрофессионалов получили свое обоснование в результате проведенного анализа 345 случаев проведения непрофессионалами компрессии грудной клетки пациентам, которые были без сознания, но у которых не было остановки кровообращения. В результате в данной категории пациентов была выявлена небольшая частота развития осложнений в виде переломов ребер и ключицы (в 1,7 % случаев) и боли в области грудной клетки в месте проведения компрессии (в 8,7 % случаев). При этом более серьезных, а тем более фатальных осложнений при поведении компрессии грудной клетки у пациентов с сохраненным спонтанным кровообращением установлено не было [8–10]. Полученные данные послужили обоснованием для обучения непрофессионалов указанным маркерам возможной остановки кровообращения, поскольку гипердиагностика клинической смерти лучше, чем ее нераспознание и, соответственно, непроведение СЛР пациентам, которым она в буквальном смысле слова жизненно необходима.
Важно отметить, что агональное дыхание (гаспинг) в первые минуты остановки кровообращения наблюдается у 40 % пациентов, и его наличие ассоциировано с более высоким уровнем выживаемости [11].
Современный комплекс СЛР представляет собой алгоритм С-А-В (А — Аirway, В — Вreathing, С — Сirculation). Таким образом, первым этапом после диагностики остановки кровообращения является немедленное начало компрессий грудной клетки и лишь затем восстановление проходимости дыхательных путей и искусственное дыхание.
Компрессия грудной клетки. Фундаментальной проблемой искусственного поддержания кровообращения является очень низкий (менее 30 % от нормы) уровень сердечного выброса, создаваемого при компрессии грудной клетки. Правильно проводимая компрессия обеспечивает поддержание систолического артериального давления (АД) на уровне 60–80 мм рт.ст., в то время как диастолическое АД редко превышает 40 мм рт.ст. и, как следствие, обусловливает низкий уровень мозгового (30–60 % от нормы) и коронарного (5–20 % от нормы) кровотока [12]. При проведении компрессии грудной клетки коронарное перфузионное давление повышается только постепенно и поэтому с каждой очередной паузой, необходимой для проведения дыхания «изо рта в рот», оно быстро снижается. Необходимо минимум 20 компрессий, чтобы достигнуть максимально возможного уровня системной гемодинамики. В этой связи было показано, что отношение числа компрессий к частоте дыхания, равное 30 : 2, является наиболее эффективным [12].
Проведенное исследование у интубированных пациентов показало, что правильно проводимая компрессия грудной клетки генерирует дыхательный объем, равный 40 мл, что является недостаточным для адекватной вентиляции [13]. Однако в случаях, когда реаниматор не знает, как проводить искусственное дыхание «рот в рот», либо не желает делать это, от него требуется проведение только одной компрессии грудной клетки — так называемой безвентиляционной СЛР (compression — only resuscitation) [1].
Следует подчеркнуть, что правильное и непрерывное проведение компрессии грудной клетки является основным залогом успеха реанимационных мероприятий. Поэтому основной акцент современных рекомендаций ставится на минимизации любых пауз, прекращающих проведение компрессии грудной клетки [1].
Частота компрессии должна составлять 100–120 в 1 минуту, глубина компрессий должна быть не менее 5 см, но не более 6 см. Базируясь на проведенном исследовании у 9136 пациентов, глубина компрессии в диапазоне 4–5,5 см ассоциировалась с лучшим уровнем выживаемости [14, 15]. Глубина компрессий более 6 см достоверно ассоциировалась с более высокой частотой развития переломов ребер и грудины [1, 16].
Особенности BLS в условиях пандемии COVID-19. Как в европейских, так и в американских рекомендациях большое внимание уделяется рискам заражения как непрофессионалов, которые оказывают первую помощь, так и медицинского персонала при проведении сердечно-легочной реанимации у пациентов с возможным или подтвержденным инфицированием коронавирусной инфекцией, поскольку основным механизмом передачи SARS-CoV-2 является воздушно-капельный путь непосредственно от пациента или при прикосновении к загрязненным поверхностям. Необходимо отметить, что взвешенные частицы аэрозоля от инфицированного пациента могут оставаться в воздухе в течение длительного времени, что требует особых мер предосторожности с обязательным использованием средств индивидуальной защиты (СИЗ) [4, 5, 17].
Минимально необходимый перечень СИЗ от попадания капель должен включать: перчатки, короткий фартук с рукавами, водонепроницаемую хирургическую маску. Для защиты глаз и лица необходимо использовать водостойкую хирургическую маску с защитным козырьком/щитком либо защитные очки.
Минимальный перечень средств индивидуальной защиты для обеспечения воздушной биобезопасности включает: перчатки, длинный халат с рукавами, фильтрующую маску (FFP3), респиратор N99 (или FFP2, N95 при недоступности FFP3).
Особые меры предосторожности при контакте с кровью не предусмотрены.
Международный объединенный комитет по реанимации (ILCOR) сформулировал следующие вопросы, посвященные риску инфицирования при проведении СЛР:
1. Имеет ли место образование аэрозоля при проведении компрессии грудной клетки или дефибрилляции?
2. Увеличивается ли передача вирусной инфекции при проведении компрессии грудной клетки, дефибрилляции или использовании комплекса СЛР в целом?
3. Какой тип СИЗ оптимален для защиты от инфицирования лиц, проводящих компрессию грудной клетки, дефибрилляцию или комплекс СЛР в целом?
При проведении компрессии грудной клетки образование аэрозоля возможно, поскольку она сама по себе генерирует небольшие дыхательные объемы. В условиях, когда реаниматор при проведении СЛР находится в непосредственной близости от дыхательных путей пациента, возможна передача вирусной инфекции. Однако не было обнаружено доказательств того, что электрическая дефибрилляция способна генерировать аэрозоли, а использование адгезивных электродов позволяет провести дефибрилляцию без прямого контакта между оператором дефибриллятора и пациентом.
На основании проведенного систематического обзора ILCOR были предложены следующие рекомендации по проведению СЛР в условиях пандемии COVID-19:
1. Компрессия грудной клетки и в целом осуществление комплекса СЛР могут приводить к формированию аэрозолей.
2. В условиях пандемии COVID-19 непрофессиональным реаниматорам рекомендуется проводить безвентиляционную (без проведения искусственного дыхания) СЛР, а также использовать AED.
3. Непрофессиональные реаниматоры, которые имеют подготовку и желание, могут провести искусственное дыхание детям в дополнение к компрессии грудной клетки.
4. В условиях пандемии COVID-19 медицинским работникам рекомендуется использовать средства индивидуальной защиты при проведении процедур, связанных с образованием аэрозолей, при СЛР.
5. Для медицинских работников является рациональным рассмотреть возможность проведения дефибрилляции до момента надевания средств индивидуальной защиты в тех случаях, когда, по мнению реаниматоров, преимущества данного шага могут превышать риск инфицирования [4, 5, 17].
В целом проведение BLS для непрофессионалов строится на следующих принципах:
— Уделить внимание личной безопасности!
— Диагноз остановки кровообращения устанавливается при наличии двух признаков: пострадавший без сознания и плохо дышит.
— Для определения признаков сознания надо потормошить и громко окликнуть пострадавшего и параллельно оценить адекватность внешнего дыхания.
— Для оценки внешнего дыхания не рекомендуется маневр открытия дыхательных путей и приближение реаниматора ко рту и носу пострадавшего с целью минимизации риска заражения. Оценивать наличие и адекватность внешнего дыхания у пострадавшего необходимо только визуально!
— При проведении СЛР одним реаниматором по возможности необходимо включить функцию громкой связи в телефоне для общения с диспетчером службы скорой медицинской помощи и следовать его инструкциям. Поскольку коронавирус распространяется воздушно-капельным путем, до начала проведения компрессии грудной клетки и использования AED надо положить ткань/полотенце/защитную медицинскую маску на рот и нос пострадавшего для снижения риска инфицирования (рис. 1).
— После проведения СЛР реаниматоры должны как можно быстрее тщательно вымыть руки с мылом и/или продезинфицировать антисептиком.
Американской ассоциацией сердца был предложен алгоритм проведения СЛР в условиях пандемии COVID-19, представленный на рис. 2.
Расширенное поддержание жизни (Advanced Life Support — ALS)
А. Искусственное поддержание кровообращения. В целом правила проведения компрессии грудной клетки представлены в следующих положениях:
1. Глубина компрессии не менее 5 см, но не более 6 см.
2. Частота компрессий должна составлять 100–120 в 1 минуту с минимизацией, насколько это возможно, пауз в проведении.
3. Обеспечение после компрессии грудной клетки ее полной декомпрессии, не допуская руками сопротивление, при этом руки не должны отрываться от грудной клетки.
4. Отношение числа компрессий к частоте дыхания без протекции дыхательных путей (через лицевую маску) либо с протекцией ларингеальной маской должно составлять 30 : 2 и осуществляться с паузой на проведение искусственной вентиляции легких (ИВЛ) за счет высокого риска развития аспирации.
5. У интубированных пациентов компрессия грудной клетки должна проводиться с частотой 100–120 в 1 минуту, вентиляция — с частотой 10 в 1 минуту (в случае использования мешка Амбу — 1 вдох каждые 5 секунд), без паузы при проведении ИВЛ (так как компрессия грудной клетки с одновременным раздуванием легких увеличивает коронарное перфузионное давление) [2].
Использование механических устройств для проведения компрессии грудной клетки может быть полезным в целом ряде случаев, облегчая проведение СЛР, например, в процессе транспортировки или выноса пациента из помещений, когда неудобно проводить ручную компрессию, а также в случаях необходимости пролонгированного проведения СЛР [2].
В. Восстановление проходимости дыхательных путей. Золотым стандартом обеспечения проходимости дыхательных путей является интубация трахеи. При этом необходимо отметить, что, согласно данным исследования [7], проведение интубации трахеи у пациентов с остановкой кровообращения было сопряжено с задержкой компрессии грудной клетки длительностью в среднем 110 секунд (от 113 до 146 секунд), а в 25 % случаев интубация продолжалась более 3 минут. Поэтому попытка интубации трахеи должна длиться не более 5 секунд, и, если за это время интубация не удается, необходимо немедленно прекратить попытки интубации и начать проведение компрессии грудной клетки и ИВЛ мешком Амбу (или респиратором) через лицевую маску с резервуарным мешком и обязательной подачей кислорода в мешок со скоростью 10–15 л/мин в соотношении 30 : 2. Через 2 минуты необходимо сделать повторную попытку интубации трахеи или использовать альтернативные методы обеспечения проходимости дыхательных путей. Рекомендуется обучать интубации трахеи без прекращения компрессии грудной клетки. Короткая пауза в компрессиях допускается в момент проведения эндотрахеальной трубки через голосовые связки, при этом такая пауза не должна быть более 5 секунд [2].
Повышение успешности интубации трахеи может обеспечить использование видеоларингоскопии. С целью верификации нахождения эндотрахеальной трубки рекомендуется использование капнографии [2].
Однако интубация трахеи является достаточно сложным навыком, требующим длительного обучения и постоянной практики. Так, в одном из исследований было показано, что только после проведения интернами-анестезиологами около 125 интубаций в операционной уровень успешных интубаций начинал достигать 95 % [18]. В целом в странах Евросоюза при подготовке врачей-анестезиологов критерием освоения интубации трахеи считается проведение обучающимися более 3 тысяч интубаций за период обучения в резидентуре. При этом необходимо отметить, что интубация трахеи на догоспитальном этапе у пострадавших с различными критическими состояниями остается неудовлетворительной из-за многочисленных безуспешных попыток, приводящих к ухудшению исходов и даже фатальным осложнениям. Так, в США парамедики считаются обученными интубации трахеи после проведения только 5 успешных попыток в клинике, при этом ни одной у детей, что явно является недостаточным. Эти факты привели к переосмыслению приоритетности интубации трахеи на догоспитальном этапе по сравнению с протекцией дыхательных путей ларингеальной маской I-gel. В США и Великобритании было проведено рандомизированное клиническое исследование среди > 9000 пациентов с догоспитальной остановкой кровообращения, которым парамедики обеспечивали восстановление проходимости дыхательных путей первоначальным использованием ларингомаски I-gel, в сравнении с интубацией трахеи. В результате не было выявлено достоверных различий между группами по уровню благоприятных исходов в постреанимационном периоде (mRS 3; 6,4 против 6,8 %; P = 0,33) [19]. Все эти факты привели к активному обсуждению данной проблемы на страницах международных медицинских журналов.
С. Искусственное поддержание дыхания. При проведении ИВЛ методом «изо рта в рот» каждый искусственный вдох должен проводиться в течение 1 секунды (не форсированно), одновременно следует наблюдать за экскурсией грудной клетки с целью достижения оптимального дыхательного объема и предотвращения попадания воздуха в желудок. При этом длительность проведения двух искусственных вдохов «изо рта в рот» не должна превышать 10 секунд, после чего необходимо немедленно продолжить компрессию грудной клетки. Дыхательный объем должен составлять 500–600 мл (6–7 мл/кг), частота дыхания — 10/мин с целью недопущения гипервентиляции. Исследованиями было показано, что гипервентиляция во время СЛР, повышая внутриторакальное давление, снижает венозный возврат к сердцу и уменьшает сердечный выброс, ассоциируясь с низким уровнем выживаемости таких больных [20].
Путь введения лекарственных препаратов. Как и в предыдущих рекомендациях, используются два основных доступа для введения препаратов [2]:
а) внутривенный, в центральные или периферические вены. Оптимальным путем введения являются центральные вены — подключичная и внутренняя яремная, поскольку обеспечивается доставка вводимого препарата в центральную циркуляцию. Для достижения этого же эффекта при введении в периферические вены препараты должны быть разведены в 20 мл физиологического раствора;
б) внутрикостный путь — внутрикостная инъекция лекарственных препаратов в плечевую или большеберцовую кость обеспечивает адекватную плазменную концентрацию, по времени сравнимую с введением препаратов в центральную вену. Использование механических устройств для внутрикостного введения лекарственных препаратов обеспечивает простоту и доступность данного пути введения.
Фармакологическое обеспечение реанимации [2]:
1. Адреналин:
а) при электрической активности без пульса/асистолии (ЭАБП/асистолия) — 1 мг каждые 3–5 минут внутривенно;
б) при ФЖ/желудочковой тахикардии (ЖТ) без пульса адреналин вводится только после третьего неэффективного разряда электрической дефибрилляции в дозе 1 мг. В последующем данная доза вводится каждые 3–5 минут внутривенно (т.е. перед каждой второй дефибрилляцией) столь долго, сколько сохраняется ФЖ/ЖТ без пульса. При этом необходимо отметить, что после восстановления самостоятельного кровообращения даже маленькие дозы адреналина (50–100 мкг) могут вызвать развитие тахикардии, ишемии миокарда, ФЖ/ЖТ без пульса. Поэтому в раннем пост-реанимационном периоде адреналин больше не вводится, а при необходимости вазопрессорной поддержки используется норадреналин или мезатон.
Мы хотели бы отметить еще один практический момент, который не обсуждается в рекомендациях ERC’2021, но который нам кажется важным. Так, в нашей практике с момента начала СЛР и обеспечения венозного доступа мы сразу подключаем вазопрессорную поддержку (обычно мезатоном). После восстановления самостоятельного гемодинамически эффективного ритма в этом случае имеется подпор общего периферического сопротивления сосудов, не допускающий повторной остановки кровообращения вследствие критической гипотензии. А с учетом того факта, что больше чем в половине случаев пациентам, перенесшим остановку кровообращения, в раннем
постреанимационном периоде требуется вазопрессорная поддержка, данный подход может повышать эффективность СЛР [20].
2. Амиодарон — антиаритмический препарат первой линии при ФЖ/ЖТ без пульса, рефрактерной к электроимпульсной терапии, вводится после 3-го неэффективного разряда в начальной дозе 300 мг (разведенные в 20 мл 5% раствора глюкозы либо физиологического раствора), а после 5-го неэффективного разряда повторно однократно вводится еще 150 мг.
3. Лидокаин — применяется в случае отсутствия амиодарона (при этом он не должен использоваться в качестве дополнения к амиодарону) — начальная доза 100 мг (1–1,5 мг/кг) в/в, при необходимости дополнительно болюсно вводится по 50 мг (при этом общая доза не должна превышать 3 мг/кг в течение первого часа).
4. Бикарбонат натрия — рутинное применение в процессе СЛР или после восстановления самостоятельного кровообращения не рекомендуется.
Остановка кровообращения представляет собой комбинацию респираторного и метаболического ацидоза. Наиболее оптимальным методом коррекции ацидемии при остановке кровообращения является проведение компрессии грудной клетки, дополнительный положительный эффект обеспечивается проведением вентиляции. Бикарбонат натрия вызывает ряд неблагоприятных эффектов вследствие генерации СО2, диффундирующего в клетки:
— усиление внутриклеточного ацидоза;
— отрицательное инотропное действие на ишемизированный миокард;
— нарушение кровообращения в головном мозге за счет наличия высокоосмолярного натрия;
— смещение кривой диссоциации оксигемоглобина влево, что может снижать доставку кислорода тканям.
Абсолютным показанием для введения бикарбоната натрия является развитие жизнеугрожающей гиперкалиемии [21], а также случаи остановки кровообращения, ассоциированной с гиперкалиемией или передозировкой трициклических антидепрессантов в дозе 50 ммоль (50 мл 8,4% раствора) или 1 ммоль/кг в/в [2].
5. Хлорид кальция — в дозе 10 мл 10% раствора в/в (6,8 ммоль Сa2+) при гиперкалиемии, гипокальциемии, передозировке блокаторов кальциевых каналов [2].
Дефибрилляция. Проведение ранней дефибрилляции в течение первых 3–5 минут с момента остановки кровообращения обеспечивает уровень выживаемости 50–70 %, что возможно реализовать только при внедрении общественно доступной дефибрилляции. При этом каждая минута задержки проведения дефибрилляции снижает выживаемость пациентов в постреанимационном периоде на этапе выписки из больницы на 10–12 %. При этом необходимо отметить, что ряд проведенных исследований использования AED врачебными бригадами в больничных условиях в сравнении с использованием профессиональных дефибрилляторов показал снижение уровня выживаемости пациентов [7].
Выделяют трехфазную времязависимую модель развития фибрилляции желудочков, которая включает последовательно развивающиеся фазы:
— электрическую (первые 4–5 минут), во время которой эффективным методом устранения ФЖ является электрическая дефибрилляция;
— циркуляторную (последующие 5–10 минут — пролонгированная ФЖ), эффективным методом ее устранения является предварительное проведение компрессии грудной клетки и только в последующем — электрической дефибрилляции;
— метаболическую, при которой необходимо проведение метаболической терапии [20].
Следует подчеркнуть, что непрерывная компрессия грудной клетки может быть полезной на ранних стадиях ФЖ, в электрическую и циркуляторную фазу, в то время как дополнительная вентиляция более значимой становится в позднюю — метаболическую фазу ФЖ. Также было установлено, что проведение перед дефибрилляцией компрессии грудной клетки в течение 180 секунд может быть полезным (более короткий, 30–60 с, как и более длинный период, > 180 с, неэффективны) [7].
При выявлении на кардиомониторе/дефибрилляторе ФЖ/ЖТ без пульса необходимо немедленно нанести один разряд электрической дефибрилляции. Сразу же после нанесения разряда дефибрилляции следует продолжить компрессию грудной клетки и другие компоненты СЛР в течение 2 минут, и только затем провести оценку ритма по ЭКГ и в случае восстановления синусового ритма оценить его гемодинамическую эффективность по наличию пульса на сонной артерии. Даже если дефибрилляция будет эффективной и восстановится по данным ЭКГ синусовый ритм, крайне редко сразу после дефибрилляции он является гемодинамически эффективным (т.е. способным генерировать пульс, а значит, и кровообращение). Обычно еще требуется проведение ≥ 1 минуты компрессии грудной клетки для восстановления самостоятельного кровообращения (пульса). При этом необходимо подчеркнуть, что в случае восстановления гемодинамически эффективного ритма дополнительная компрессия грудной клетки не приведет к повторному развитию ФЖ. И наоборот, в случае восстановления только организованной биоэлектрической активности сердца, но гемодинамически неэффективной прекращение проведения компрессии грудной клетки неизбежно приведет к рефибрилляции желудочков.
Вышеизложенные факты являются обоснованием немедленного начала проведения компрессии грудной клетки после разряда дефибрилляции в течение 2 минут и только последующей оценки ритма по ЭКГ, а в случае восстановления синусового ритма — оценки пульсации на сонной артерии.
Промежуток между проведением разряда дефибрилляции и продолжением компрессии грудной клетки не должен превышать 5 секунд [2].
Оценка ритма/пульса также не должна превышать 5 секунд — в случае сохранения на ЭКГ ФЖ/ЖТ без пульса необходимо нанести повторный разряд дефибрилляции с более высокой энергией и продолжить компрессию грудной клетки в течение 2 минут. В случае восстановления синусового ритма по данным ЭКГ-мониторинга, но отсутствия пульса необходимо немедленно продолжить компрессию грудной клетки в течение 2 мин, с последующей оценкой ритма и пульса:
разряд → СЛР в течение 2 мин → оценка ритма/пульса → разряд → СЛР в течение 2 минут.
Монофазная дефибрилляция больше не используется в связи с тем, что дефибрилляторы такого типа уже не выпускаются, а сам принцип, реализованный в старых моделях дефибрилляторов, малоэффективен и вызывает выраженное постдефибрилляционное повреждение миокарда.
Бифазная дефибрилляция, использующая меньшую энергию разряда, значительно более эффективна и в меньшей степени вызывает повреждение и постреанимационную дисфункцию миокарда по сравнению с эквивалентной энергией монофазного импульса [7, 20].
Начальный уровень энергии для бифазных дефибрилляторов должен составлять 150 Дж (или ниже, с учетом рекомендаций завода — изготовителя конкретного бифазного дефибриллятора, в зависимости от реализованной в нем формы электрического импульса) с последующей эскалацией энергии при повторных разрядах [2].
При проведении электрической дефибрилляции важным является правильное расположение электродов (один справа по парастернальной линии ниже ключицы, другой слева по среднеподмышечной линии в проекции верхушки сердца). Для стандартных электродов (неадгезивных) в момент нанесения разряда необходимо обеспечить силу приложения на электроды в пределах 8 кг с обязательным использованием специального электропроводного геля для дефибрилляции, а при его отсутствии — прокладок, смоченных любым токопроводящим раствором. Недопустимо использование «сухих» электродов, так как это существенно снижает эффективность дефибрилляции (сводя ее практически к нулю) и вызывает ожоги кожных покровов [20].
Рекомендуется преимущественное использование адгезивных (самоклеящихся) электродов, а не стандартных, поскольку их применение является более удобным, высвобождает руки и позволяет минимизировать паузы перед проведением дефибрилляции. В настоящее время все современные модели дефибрилляторов наряду со стандартными электродами комплектуются самоклеящимися электродами.
Если у пациента имеется имплантированный электрокардиостимулятор, то электроды дефибриллятора должны размещаться от него на расстоянии минимум 8 см. В этой ситуации также рекомендуется использование передне-заднего расположения электродов [2, 21].
Потенциально обратимые причины СЛР. Вероятность благоприятного исхода СЛР при ЭАБП/асистолии (как и при рефрактерной ФЖ/ЖТ) можно повысить, только если имеются потенциально обратимые причины остановки кровообращения, поддающиеся лечению. Они представлены в виде универсального алгоритма «четыре Г — четыре Т» (рис. 3).
Мониторинг во время проведения СЛР. В новых рекомендациях большое внимание уделяется мониторингу, позволяющему оценить качество и эффективность проводимых реанимационных мероприятий за счет использования следующих технологий:
1. Устройств, позволяющих оценить качество проводимой СЛР по частоте и глубине компрессий грудной клетки, а вентиляции — по частоте и объему. Данная технология реализована в ряде современных дефибрилляторов и представляет собой устройство, которое располагается на грудной клетке пациента, и на него оказывается компрессия в процессе СЛР. При этом на кардиомониторе дефибриллятора отображаются параметры проводимой компрессии и вентиляции, а также имеется возможность голосовой подсказки правильности проведения реанимационных мероприятий. Именно данное устройство позволяет контролировать оптимальную глубину (не меньше 5 и не более 6 см) и частоту компрессии, не допускать гипервентиляцию.
2. Капнографии, позволяющей верифицировать положение эндотрахеальной трубки, оценить качество проводимой СЛР, являясь ранним индикатором восстановления самостоятельного гемодинамически эффективного кровообращения.
3. Ультразвукового исследования для выявления в процессе СЛР потенциально обратимых причин остановки кровообращения согласно алгоритму 4Г — 4Т (тампонада сердца, тромбоэмболия легочной артерии (ТЭЛА), пневмоторакс), а также идентификации псевдоэлектрической активности без пульса [2].
Длительность реанимационных мероприятий. СЛР необходимо проводить так долго, как долго сохраняется на ЭКГ фибрилляция желудочков, поскольку при этом сохраняется минимальный метаболизм в миокарде, что обеспечивает потенциальную возможность восстановления самостоятельного кровообращения.
В случае остановки кровообращения по механизму ЭАБП/асистолии при отсутствии потенциально обратимой причины (алгоритм «четыре Г — четыре Т») СЛР проводят в течение 30 минут, при ее неэффективности — прекращают.
Ранее рекомендовалось проведение СЛР более 30 минут только в случаях общего переохлаждения, утопления в ледяной воде и передозировки лекарственных препаратов. Однако в последние годы появилось множество сообщений об успехе СЛР с хорошими неврологическими исходами в случае пролонгации реанимационных мероприятий больше 30 минут, что дает авторам право поднимать вопрос о пересмотре временных пределов проведения СЛР, особенно при наличии механических устройств для компрессии грудной клетки или портативных аппаратов искусственного кровообращения (АИК).
В связи с этим в рекомендации ERC’2021 были внесены изменения. Так, если причиной остановки кровообращения является ТЭЛА и в процессе СЛР был проведен тромболизис, реанимационные мероприятия необходимо проводить на протяжении 60–90 минут с момента введения тромболитических препаратов [2].
Экстракорпоральное поддержание жизни. Проводимые исследования все больше расширяют возможности систем неотложной перфузионной реанимации (EPR — Emergency Perfusion Resuscitation). Данные системы представляют собой портативные АИК, обеспечивающие экстракорпоральное поддержание кровообращения у пациентов в состоянии клинической смерти, у которых стандартный комплекс СЛР неэффективен, но при этом имеется потенциально обратимая причина, на которую можно воздействовать специфическими методами терапии. Потенциально обратимыми причинами, для которых показано применение EPR, являются: острый коронарный тромбоз — для проведения чрескожного коронарного вмешательства, массивная ТЭЛА — для проведения эмболэктомии, тяжелое общее переохлаждение — для экстракорпорального согревания пациента. Необходимо подчеркнуть, что указанные аппараты могут, кроме экстракорпорального согревания, обеспечить индукцию лечебной гипотермии в постреанимационном периоде [2].
Особенности АLS в условиях пандемии COVID-19
Главный акцент рекомендаций Европейского совета по реанимации делается на том, что никогда нельзя ставить под угрозу безопасность медицинских работников. Он базируется на том положении, что время, необходимое для обеспечения безопасности реаниматоров, оказывающих помощь, является приемлемой частью процесса СЛР [2].
Необходимо отметить, что в момент возникновения пандемии в Китае в городе Ухань при анализе 136 пациентов с тяжелой формой COVID-19, у которых имела место внутрибольничная остановка кровообращения, в 87,5 % случаев ее причиной были респираторные нарушения. По механизму остановки кровообращения в 89,7 % случаев была зарегистрирована асистолия, в 4,4 % — ЭАБП и только в 5,9 % случаев — ФЖ/ЖТ без пульса. Таким образом, в большинстве случаев остановки кровообращения у пациентов с COVID-19 не было необходимости в проведении электрической дефибрилляции. Это явилось следствием системного гипоксического воздействия и/или прямого повреждения сердца коронавирусом. Причем из всех указанных случаев остановки кровообращения в Ухане только четыре пациента (2,9 %) имели выживаемость в течение 30 дней, и только у одного из них было зарегистрировано благоприятное неврологическое восстановление [22].
В настоящее время возможности интенсивной терапии тяжелого COVID-19 еще крайне ограниченны и проведение СЛР у данной категории пациентов в случае развития остановки кровообращения малоперспективно в связи с наступлением необратимой полиорганной недостаточности, в том числе у пациентов с так называемым «постковидным синдромом», число которых растет. Но, на наш взгляд, правильнее говорить о фазах развития коронавирусной болезни, и данное представление в последнее время начало терминологически оформляться в международной литературе как «долговременный эффект коронавирусной болезни» (long-COVID) [23].
Проведение СЛР у пациентов с COVID-19 во внутрибольничных условиях должно базироваться на следующих принципах:
— раннее выявление всех пациентов с заболеванием, похожим на COVID-19, которые подвержены риску острого ухудшения состояния или развития остановки кровообращения;
— использование систем мониторинга, позволяющих на раннем этапе выявлять развитие критического состояния, с целью недопущения остановки кровообращения и проведения «незащищенной» СЛР;
— после вызова реанимационной бригады больницы к пациенту с остановкой кровообращения в случае, если немедленно доступен дефибриллятор, рекомендуется его подключение и при наличии ФЖ/ЖТ без пульса проведение разряда дефибрилляции. При сохранении ФЖ/ЖТ без пульса, в случае если уже надеты СИЗ, необходимо начать проведение компрессии грудной клетки. Если СИЗ еще не надеты, допустимо проведение двух дополнительных разрядов (что возможно только при применении профессионального дефибриллятора), пока другие медицинские работники надевают СИЗ;
— постоянная доступность СИЗ для медперсонала при проведении СЛР. Несмотря на то что надевание СИЗ может вызвать кратковременную задержку начала СЛР, безопасность медперсонала должна иметь приоритетное значение;
— при проведении ИВЛ необходимо убедиться, что между мешком Амбу и лицевой маской (ларингомаской, эндотрахеальной трубкой) находится бактериально-вирусный фильтр (с функцией тепло- и влагообмена либо HEPA-фильтр) для фильтрации выдыхаемого воздуха;
— диагностика остановки кровообращения должна основываться на признаке наличия/отсутствия пульса на сонной артерии, при этом не допускается выслушивание наличия дыхания приближением к лицу пациента;
— в случае если компрессия грудной клетки еще не была начата, необходимо надеть пациенту кислородную маску и начать оксигенотерапию, которую следует продолжать до тех пор, пока не будет доставлен мешок Амбу;
— компрессию грудной клетки и ИВЛ с помощью мешка Амбу и лицевой маски с подачей кислорода необходимо проводить в соотношении 30 : 2, делая паузу на компрессию в момент проведения вентиляции с целью минимизации риска образования аэрозоля. С этой же целью один реаниматор должен двумя руками плотно держать маску, а второй реаниматор, обеспечивающий компрессию грудной клетки, после окончания цикла должен провести 2 вдоха мешком Амбу;
— специально подготовленный медицинский персонал должен на ранней стадии обеспечить восстановление проходимости дыхательных путей (ларингеальная маска, интубация трахеи), чтобы свести к минимуму продолжительность ИВЛ при помощи лицевой маски;
— видеоларингоскопия для интубации трахеи имеет преимущество, позволяющее обеспечить дистанцирование от дыхательных путей пациента;
— при необходимости пролонгированной СЛР следует рассмотреть возможность использования механических устройств для проведения компрессии грудной клетки [4, 5, 17].
Особенности проведения СЛР у пациентов, находящихся в prone position. В случае остановки кровообращения у неинтубированных пациентов, находящихся в prone position, при условии, что медперсонал одет в СИЗ, необходимо немедленно перевернуть пациента на спину перед началом СЛР.
У интубированных пациентов можно начать проведение компрессии грудной клетки путем нажатия на спину пациента (рис. 4а), что может обеспечить некоторую перфузию жизненно важных органов до того момента, пока медперсонал готовится повернуть пациента на спину, — этот маневр должен быть предварительно отработан медицинской командой.
Техника проведения компрессии грудной клетки у пациентов, находящихся в prone position, заключается в проведении компрессий между лопатками со стандартной глубиной компрессии (не менее 5 см, но не более 6 см) и частотой 2 компрессии в 1 секунду.
В положении на животе возможно также проведение электрической дефибрилляции с использованием адгезивных самоклеящихся электродов. При этом используют такие варианты расположения электродов дефибриллятора:
— передне-заднее (рис. 4б);
— биаксиллярное (обе подмышки) (рис. 4в) [24].
При оказании медицинской помощи пациентам с COVID-19 возникает целый ряд этических проблем:
— ограниченность коммуникации с родственниками в случае смерти больного;
— недопустимо использовать категориальные или общие критерии (например, возрастные пороги) для определения правомочия пациента полу-чать или не получать определенные медицинские ресурсы;
— ключевой проблемой СЛР во время пандемии COVID-19 является сложность надежного баланса риска для тех, кто оказывает помощь, и потенциальной пользы для пациента;
— делая все возможное для отдельного пациента, медицинские работники должны в равной степени осознавать свою ответственность перед своими родственниками, коллегами и более широким сообществом [4, 5, 17].
Интенсивная терапия постреанимационного синдрома
На современном этапе термин «постреанимационная болезнь», введенный В.А. Неговским (1972), был заменен на термин «постреанимационный синдром», который можно определить как специфическое патологическое состояние, развивающееся в организме пациента вследствие ишемии, вызванной тотальным нарушением кровообращения и реперфузии после успешной СЛР, и характеризующееся тяжелыми расстройствами различных звеньев гомеостаза на фоне нарушенной интегративной функции ЦНС и развития полиорганной недостаточности [25–27].
Прогностическая оценка состояния в постреанимационном периоде. Коматозное состояние в течение 48 и более часов является предиктором плохого неврологического исхода. Если через 72 часа после остановки кровообращения неврологический дефицит составляет ≤ 5 баллов по шкале комы Глазго, отсутствует двигательная реакция в ответ на болевое раздражение или зрачковый рефлекс, то данные признаки являются предиктором развития персистирующего вегетативного состояния [3].
Принципы интенсивной терапии постреанимационного периода. Интенсивная терапия постреанимационного периода нацелена на причины, вызвавшие остановку кровообращения и реперфузионное повреждение органов.
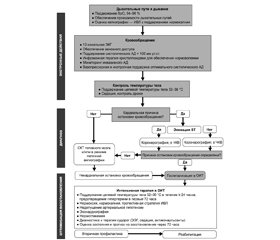
Оксигенация и вентиляция. Артериальная гипероксия должна быть исключена, уровень FiO2 должен обеспечивать SрO2 94–98 %, поскольку проведение ИВЛ с 100% кислородом в первый час постреанимационного периода ассоциируется с плохими неврологическими последствиями за счет создания дополнительного оксидативного стресса для постишемических нейронов.
Поддержание нормоксемии (РаО2 75–100 мм рт.ст.) и недопущение гипоксемии (РаО2 < 60 мм рт.ст.); поддержание нормокапнии — уровня РаСО2 35–45 мм рт.ст. Необходимо подчеркнуть, что вазодилатация сосудов головного мозга, обусловленная гиповентиляцией, приводит к повышению внутричерепного давления (ВЧД), так же как и вазоконстрикция, вызванная гипервентиляцией, увеличивает церебральное ишемическое повреждение [3].
Ранняя оптимизация гемодинамики. Вследствие срыва ауторегуляции мозгового кровотока в постреанимационном периоде уровень церебрального перфузионного давления (ЦПД) становится зависимым от уровня среднего артериального давления (САД): ЦПД = САД – ВЧД. Поэтому очень важным является поддержание нормотензии — систолическое АД должно быть больше 100 мм рт.ст., САД > 65 мм рт.ст. Рекомендуется использование инвазивного измерения АД и поддержка целевых значений гемодинамики за счет коррекции инфузионной терапией возможной гиповолемии и использования вазопрессорных и инотропных препаратов.
Фармакологическое обеспечение для достижения целевых значений интенсивной терапии:
— мониторинг уровня лактата, являющегося маркером адекватности перфузии органов, и поддержание его в пределах нормы;
— коррекция гипокалиемии, обусловливающей развитие желудочковой аритмии;
— диурез > 0,5 мл/кг/час;
— использование седативных препаратов и опиоидов короткого действия для возможности оценки неврологического статуса пациента;
— не рекомендуется рутинное применение миорелаксантов (за исключением обеспечения целевого температурного менеджмента);
— тромбопрофилактика и профилактика развития стрессорных язв желудочно-кишечного тракта;
— поддержание целевого уровня гликемии 7,8–10,0 ммоль/л. При превышении верхней границы уровня глюкозы — коррекция инсулином короткого действия, не допуская при этом развития гипогликемии (< 4,0 ммоль/л);
— начало насколько возможно раннего энтерального питания;
— не рекомендуется рутинное проведение антибиотикопрофилактики;
— не рекомендуется рутинное использование глюкокортикоидов [3].
Контроль судорожной активности. Судорожный синдром, и особенно ранний эпистатус, является предиктором неблагоприятного исхода. С целью выявления судорожной активности и оценки эффективности действия назначенных противосудорожных препаратов рекомендуется использование электроэнцефалографии.
Для купирования судорожной активности рекомендуется применение левотирацетама или натрия вальпроата в качестве препаратов первой линии в дополнение к седативным препаратам. Рутинное введение противосудорожных препаратов с профилактической целью не рекомендуется [3].
Целевой температурный менеджмент. Лечебная гипотермия является наиболее многообещающим методом нейропротекторной защиты головного мозга, и с позиций доказательной медицины это единственный метод, который обеспечивает снижение летальности, улучшает неврологическое восстановление у пациентов, перенесших остановку кровообращения с развитием постреанимационного синдрома. Всем пациентам без сознания в постреанимационном периоде необходимо обеспечить поддержание температуры тела в диапазоне 32–36 °С.
В современных рекомендациях делается акцент на поддержании прежде всего нормотермии и недопущении развития гипертермии (> 37,7 °С) в первые 72 часа постреанимационного периода, поскольку риск неблагоприятного неврологического исхода повышается с каждым градусом выше температуры 37 °С [3].
Алгоритм интенсивной терапии в постреанимационный период представлен на рис. 5.
В заключение необходимо подчеркнуть, что крайне важно внедрение современного протокола сердечно-легочной и церебральной реанимации в клиническую практику лечебных учреждений и обучение на его основе медицинского персонала, как и стандартизированного протокола интенсивной терапии постреанимационного периода в соответствии с местными особенностями и возможностями.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Получено/Received 01.10.2021
Рецензировано/Revised 12.10.2021
Принято в печать/Accepted 20.10.2021
/15.jpg)

/19.jpg)
/21.jpg)
/23.jpg)