Вступ
Підслизові новоутворення шлунка та дванадцятипалої кишки (ДПК) — це група захворювань з різною етіологією, клінічною симптоматикою, діагностикою та тактикою лікування. Підслизові новоутворення часто являють собою випадкову знахідку при проведенні ендоскопії, і лише 3 % пацієнтів мають певну симптоматику, що пов’язана з наявністю підслизової пухлини. Звичайна гастродуоденоскопія дозволяє виявити підслизові новоутворення у 0,36–4 % випадків, тоді як шлунок є найбільш частим місцем локалізації підслизових новоутворень (до 60 %). Чутливість і специфічність ендоскопічного дослідження в диференціальній діагностиці підслизових новоутворень становлять 87 і 29 % відповідно [1], що, у свою чергу, свідчить про необхідність використання таких методів дослідження, як ендоскопічна ультрасонографія (ЕУС). Це метод дослідження стравоходу, шлунка, дванадцятипалої кишки, підшлункової залози, при якому ехоендоскоп (ультразвуковий датчик в ендоскопі) проводиться в стравохід і далі, до патологічного вогнища. Метод поєднує ендоскопічне й ультразвукове дослідження, що дозволяє отримати чітку картину будови стінок органів шлунково-кишкового тракту й анатомічних структур, виявити та оцінити патологічні новоутворення. Він є єдиним методом візуалізації шарів стінки стравоходу, шлунка і товстої кишки [2, 3].
Мета: показати роль ендоскопічного ультразвукового дослідження в діагностиці підслизових новоутворень шлунка та дванадцятипалої кишки.
Метод поєднує переваги ендоскопії та діагностичні можливості ультразвукового методу [4, 5]. Дослідження проводиться за допомогою відеоендоскопу, на кінці якого розташований скануючий ультразвуковий датчик. Переваги ендоскопічного ультразвуку перед традиційним ультразвуковим дослідженням через передню стінку живота полягають у тому, що ультразвуковий датчик по просвіту травної трубки під візуальним контролем можна провести безпосередньо до досліджуваного об’єкта.
Використання у приладі дуже високих частот ультразвуку (5,0; 7,5; 12 і 20 МГц) забезпечує високу якість зображення з роздільною здатністю менше 1 мм, недоступну іншим методам дослідження, таким як звичайне ультразвукове дослідження, комп’ютерна та магнітно-резонансна томографія, ендоскопічна холангіопанкреатографія. При цьому ендосонографія не пов’язана з ризиком рентгенологічного опромінення персоналу та пацієнта, відсутня небезпека виникнення ускладнень, властивих ендоскопічній ретроградній холагіопанкреатографії.
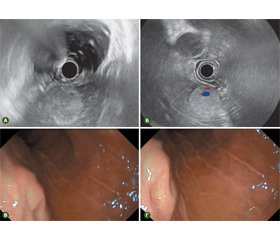
Сьогодні існують два різних типи ехоендоскопів відносно ультразвукових датчиків — радіального та конвексного типу сканування. Радіальне сканування дозволяє отримати панорамне зображення (360°), перпендикулярне осі ендоскопа (рис. 1А). Ці моделі ехоендоскопів використовуються тільки в діагностичних цілях. Ехоендоскопи конвексного типу сканування дозволяють отримувати 100° секторне ультразвукове зображення, паралельне осі ендоскопа, та застосовуються для ендоскопічних маніпуляцій (рис. 1Б) [6].
/68.jpg)
Основні показання до проведення ЕУС: діагностика підслизових новоутворень стравоходу, шлунка, дванадцятипалої та товстої кишки (фіброма, ліпома, лейоміома); діагностика пухлин травного тракту та визначення стадії злоякісного процесу і глибини ураження; діагностика вираженості змін паренхіми і протоки підшлункової залози при різних видах хронічного панкреатиту та його ускладнень; діагностика об’ємних новоутворень підшлункової залози, внутрішньопротокових пухлин, а також стадії їх поширення; діагностика доброякісних змін жовчного міхура, жовчних проток (холедохолітіазу); діагностика змін великого дуоденального соска; діагностика лімфаденопатії та новоутворень середостіння; діагностика портальної гіпертензії (варикозне розширення вен стравоходу); визначення ризику рецидиву кровотечі з ерозивно-виразкових уражень шлунково-кишкового тракту [7–12].
Використання апаратів даного типу, оснащених інструментальним каналом, дозволяє проводити пункційну біопсію під ЕУС-контролем. Комплектація ехосканерів допплерівськими й еластометричними опціями значно розширює діагностичні та лікувальні можливості дослідження [1, 6].
Дана процедура має безліч переваг:
— доступність;
— безпечність для пацієнта та персоналу, оскільки відсутнє джерело опромінення;
— високу інформатівність (згідно з результатами недавніх наукових досліджень, вірогідність ендосонографії з приводу новоутворень жовчного міхура становить 94,8 %, а пухлини фатерова сосочка — понад 97 %);
— точність діагностики: в разі трансабдомінального УЗД органів черевної порожнини ультразвуку потрібно пройти через кілька середовищ організму людини, в той час як ендосонографія дозволяє максимально близько підвести УЗ-датчик до досліджуваного органа;
— можливість проведення як УЗД, так і допплерографії;
— можливість виконання біопсії підозрілої ділянки під час ендосонографії для більш ретельного вивчення патологічного процесу.
Підготовка до процедури. Ендосонографія стравоходу вимагає ретельної підготовки. Після огляду лікарем, під час якого виявляються хронічні захворювання й алергічні реакції на лікарські препарати, пацієнту необхідно зробити загальноклінічний аналіз крові та сечі. За три дні до ЕУС шлунково-кишкового тракту необхідно приступити до очищення шлунка, виключивши з раціону всі важкі та жирні страви. Останній прийом їжі повинен відбутися не пізніше ніж за 8–10 годин до процедури. Після процедури пацієнта на пару годин переводять у стаціонар для спостереження за його станом. В домашніх умовах рекомендується забезпечити хворому спокій, а приймати їжу та пити йому можна через 2 години. Якщо перед ЕУС стравоходу були призначені заспокійливі препарати, то необхідно відмовитися від роботи, що вимагає концентрації, і самостійних поїздок на автотранспортних засобах [6].
Виконана відповідно до правил процедура зазвичай не залишає негативних наслідків. Ускладнення під час виконання ЕУС рідкісні, але все ж таки можливі у вигляді: травм слизової стравоходу і шлунка, що супроводжуються кровотечею з судин; наскрізного отвору внутрішнього органа через нанесену при діагностиці травму; серцевої аритмії; алергії на лікарські засоби; інфекційної хвороби жовчовивідних шляхів і легень. Однак зазвичай після обстеження пацієнт відчуває лише дискомфорт і загальну слабкість.
Протипоказання для виконання ЕУС. Абсолютні: тяжкий загальний стан пацієнта, що не дає можливості проводити ендоскопічне дослідження верхніх відділів травного тракту без загрози пригнічення дихання та серцевої діяльності. Відносні: виражені зміни системи згортання крові (якщо плануються оперативні маніпуляції). А також існують технічні обмеження для виконання ЕУС: анатомічні зміни, що перешкоджають проведенню ехоендоскопії (дивертикули стравоходу); стенозуючі захворювання стравоходу та проксимальних відділів шлунка; груба рубцево-виразкова та післяопераційна деформація цибулини ДПК; стан після оперативних втручань на стравоході та шлунку, якщо діаметр анастомозу менше 12–13 мм. Якщо пацієнту виконувались оперативні втручання на органах шлунково-кишкового тракту, а також є анатомічні особливості будови стравоходу або шлунка, необхідно повідомити про це лікаря заздалегідь і показати виписні довідки.
Особливості проведення ЕУС шлунка та дванадцятипалої кишки. Для створення оптимального середовища проведення ультразвукових хвиль і достатньої фокусної відстані, що становить 2 см, ультразвуковий датчик ехоендоскопа покривається змінним латексним балоном, який заповнюється водою на час дослідження. При піднесенні датчика впритул до новоутворення лікар здатний оцінити ураження стінки порожнистого органа, ехографічні характеристики новоутворень, що прилягають до досліджуваної ділянки. Однак балон може здавлювати новоутворення, що досліджується, викликаючи появу артефактів, що може ускладнювати інтерпретацію даних. Для подолання цих перешкод використовується методика наповнення шлунка 200–500 мл води, що дозволяє отримати хороші ультразвукові зображення структур без появи будь-яких артефактів, що викликаються компресією (рис. 2) [6, 7].
/69.jpg)
При проведенні ЕУС незмінна стінка стравоходу, шлунка та дванадцятипалої кишки являє собою структуру, що складається з 5 шарів: перший гіперехогенний шар відповідає найбільш верхній частині слизової оболонки шлунка; другий гіпоехогенний шар відповідає глибокій частині слизової оболонки, що може бути поєднана з м’язовою оболонкою; третій гіперехогенний шар відповідає підслизовій оболонці; четвертий — власне м’язовій оболонці стінки кишки; п’ятий гіперехогенний шар відповідає серозній оболонці або адвентиції (рис. 3).
На п’ятишаровій будові стінки заснована діагностика та диференціальна діагностика уражень слизової, підслизових новоутворень і пухлин шлунково-кишкового тракту.
ЕУС відкриває нові можливості діагностики підслизових новоутворень. Першою межею є розмежування новоутворень стінки та пухлин, що розташовані поза стінкою шлунка чи ДПК та можуть деформувати просвіт порожнистого органа. Крім доказів зв’язку новоутворення зі стінкою органа, при проведенні ЕУС ставиться завдання визначити можливий діагноз, характер новоутворення та його локалізацію щодо шарів стінки порожнистого органа, на підставі чого можна непрямо судити про характер ураження. Сукупність цих даних відіграє важливу роль у визначенні лікувальної тактики та методу видалення пухлини в кожному конкретному випадку [5, 7]. Основними характеристиками пухлини, що визначаються при ЕУС, є розмір новоутворення, ехогенність, внутрішня будова, чіткість контуру і шар, з якого вона виходить.
У більшості спостережень для остаточного визначення гістологічного характеру пухлини необхідне отримання тканини для проведення гістологічного й імуногістохімічного дослідження. Оснащення відділення операційної конвексним ендоскопом дозволяє проводити тонкоголкову пункцію патологічних утворень з подальшим гістологічним вивченням отриманого матеріалу. Під ЕУС-контролем вдається проводити пункції пухлини середостіння і панкреато-біліарної зони, кістозних утворень і лімфатичних вузлів середостіння і верхнього поверху черевної порожнини. Ця маніпуляція надає пацієнтам унікальну можливість уникнути операції з метою біопсії пухлинного новоутворення. Отримання біоптату під час виконання ендоскопічного обстеження надзвичайно важливе з позиції поліморфізму пухлин та, відповідно, правильного вибору тактики подальшого обстеження та лікування. Так, множинні нейроендокринні пухлини розміром до 2 см та з низьким мітотичним індексом вимагають виключно ендоскопічного моніторингу, натомість верифікація вторинного (метастатичного) ураження диктує необхідність поглибленого дообстеження з метою можливої верифікації первинного вогнища та вироблення індивідуалізованої лікувальної опції. Тому пункційна біопсія при ЕУС відкрила нові можливості для морфологічного й імуногістохімічного аналізу підслизових новоутворень [6, 15, 17].
Об’ємні новоутворення стінки шлунка та дванадцятипалої кишки, що діагностуються за допомогою ЕУС: епітеліальні новоутворення (поліпи, злоякісні новоутворення); неепітеліальні (внутрішньостінкові) новоутворення: ліпоми, ліпосаркоми, лейоміоми, лейоміосаркоми, метастази у стінку шлунково-кишкового тракту з інших органів, гастроінтестинальні стромальні пухлини, лімфоми, нейрогенні пухлини (рис. 4).
Поліпи при проведенні ЕУС визначаються як новоутворення підвищеної ехогенності з чіткими контурами, що виходять зі слизової оболонки. У поліпів великих розмірів може бути неоднорідна структура [5, 7]. Наявність ехонегативних включень підозріла щодо малігнізації. Підслизові новоутворення шлунка і ДПК є одним із основних показань до проведення ЕУС. За допомогою ЕУС можна чітко диференціювати екстрамуральну компресію, судинне ураження та солідну пухлину і, крім того, точно визначити шар стінки порожнистого органа, з якого виникла пухлина.
Гастроінтестинальні пухлини (ГІСП) — потенційно злоякісні новоутворення, які становлять 50 % у структурі діагностованих підслизових новоутворень. Тактиці лікування ГІСП приділяється особлива увага.
Серед підслизових новоутворень при ЕУС досить часто зустрічаються лейоміоми (14 % у структурі діагностованих підслизових новоутворень). Лейоміоми зазвичай гіпоехогенні, однорідні, мають чіткі контури, тоді як ліпома (1 % у структурі підслизових пухлин шлунка) — однорідне утворення підвищеної ехогенності — добре відмежована та розташована в межах підслизового шару. Карциноїдної пухлини в основному розташовані в третьому (підслизовому) шарі, мають середню ехогенність і чітко виражені контури. Кістозні утворення є анехогенними, добре відмежованими та найчастіше розташовані в підслизовому шарі. Також в підслизовому шарі нерідко виявляється ектопована тканина підшлункової залози (0,2–0,5 % у структурі підслизових пухлин шлунка). Це невелика пухлина, що має порожнистий вигляд, аналогічний паренхімі підшлункової золози з дрібними гіперехогенними ділянками, а в окремих випадках — і з трубчастими структурами правильної форми.
Злоякісні ураження слизової зазвичай візуалізуються у вигляді пухлинної тканини різної ехогенності, що порушує регулярну пошарову будову стінки органа; вони мають нечіткі контури, можливе потовщення стінки органа. ЕУС дозволяє визначити протяжність новоутворень, що є особливо актуальним при інфільтративних процесах, які мають схильність поширюватися в підслизовому шарі без видимих змін на слизовій [5, 7].
Еластографія є новим методом ультразвукового дослідження, що дозволяє отримувати зображення та вимірювання, пов’язані з жорсткістю тканин. Сьогодні для обстеження ЕУС доступний тільки компресійний метод. Це якісний метод, заснований на реакції тканин на зовнішню або внутрішню силу (рис. 5). За допомогою компресійної еластографії порівняно оцінюються деформації тканин, викликані компресією, в ділянці, що цікавить. Еластографія за допомогою ЕУС-дослідження може оцінити еластичність пухлин у безпосередній близькості від травного тракту, що складно досягти за допомогою звичайних чрезшкірних ультразвукових датчиків, зокрема утворення підшлункової залози та середостіння або черевні лімфатичні вузли, що підвищує діагностичну цінність процедури. Важливо відзначити, що ЕУС-еластографія не вважається методом, який може замінити біопсію.
/71.jpg)
Після встановлення діагнозу хворому пропонують оперативне втручання, яке може бути виконане ендоскопічним або лапароскопічним доступом, що залежить від розміру пухлини, ступеня інвазії, метастатичного ураження.
Спектр ендоскопічних оперативних втручань на сучасному етапі включає: ендоскопічну підслизову резекцію з використанням підслизової дисекції, ендоскопічну резекцію на повну товщину стінки, транслюмінальну ендоскопічну хірургію через природні отвори. Проте використання чисто ендоскопічних резекцій досить обмежене через ризик перфорації, пошкодження капсули пухлини, неможливість ендоскопічного закриття просвіту органа.
Для ілюстрації ролі ендоскопічного ультразвукового дослідження в діагностиці підслизових новоутворень шлунка та дванадцятипалої кишки наводимо випадки із власної практики. На проведення досліджень була отримана інформована згода пацієнтів.
Клінічний випадок 1 — дослідження ЕУС в умовах ДУ «Інститут гастроентерології НАМН України». Хвора М., 68 років.
27.07.2021 пацієнтка М. звернулась на консультацію до поліклінічного відділення ДУ «Інститут гастроентерології НАМН України» з попереднім діагнозом: GIST ДПК (підслизове новоутворення ДПК); постхолецистектомічний синдром, хронічний панкреатит. Супутній діагноз: ішемічна хвороба серця, дифузний кардіосклероз, серцева недостатність ІІ ст., гіпертонічна хвороба ІІ ст. Скарги на дискомфорт в епігастральній ділянці натщесерце, кислий і гіркий смак у роті. Анамнез життя: зі слів пацієнтки (медична документація не надана), меланома шкіри у 2019 році, оперована за місцем проживання; новоутворення заочеревного простору в 2019 році. Об’єктивний стан без особливостей. Коагулограма від 10.09.21 — у межах норми.
Мультиспіральна комп’ютерна томографія органів черевної порожнини з внутрішньовенним контрастуванням від 12.08.2021 р.: у верхній горизонтальній частині ДПК не можна виключити кругле, ймовірно, підслизове утворення до 14 мм з чіткими рівними контурами, що найкраще візуалізується в нативній фазі. Вільної рідини та лімфаденопатії не виявлено. Нирки у типовому місці, зліва в с/3 кісти до 1,9 см у діаметрі, чашково-мискова система не розширена. Висновок: КТ-картина може відповідати підслизовому об’ємному новоутворенню ДПК, хронічному панкреатиту, кісті лівої нирки.
Фіброгастродуоденоскопія виконана 05.07.2021 року з амбулаторної картки — кандидозний езофагіт ІІ ступеня. Підслизове утворення ДПК з виразкуванням (GIST?), еритематозна гастродуоденопатія, FOREST III.
Біопсія від 05.07.2021 року з амбулаторної картки — слизова ДПК з лімфолейкоцитарною інфільтрацією. Рентген шлунково-кишкового тракту від 19.07.21 р. з амбулатоої картки — картина рубцевої стриктури позацибулинного відділу та низхідної частини ДПК без ознак непрохідності. УЗД органів черевної порожнини від 25.06.21 р. з амбулаторної картки — жировий гепатоз І–ІІ ст. Хронічний пієлонефрит.
Було рекомендовано виконати ЕУС, що і було призначено на 17.09.21 р.
Відеогастродуоденоскопія з ЕУС ДПК від 17.09.2021 р. — система SonoScape UR-500.
Стравохід, шлунок, воротар — без особливостей. ДПК: слизова цибулини рожева, в просвіті жовч, в позацибулиному відділі слизова рожева рівномірно, в просвіті жовч. Великий дуоденальний сосочок поліпоподібний, розміром до 3 мм, слизова рожева. В ділянці переходу D1 в D2 визначається підслизове новоутворення до 2 см щільної консистенції, слизова над ним із рубцем. При ЕУС-скануванні дана структура гіпоехогенна, розміром 18 × 15 мм, з чіткими контурами, що не виходить за межі м’язового шару стінки ДПК (рис. 6). Еластографія підслизового новоутворення з перевагою синього патерну, що характеризує високу жорсткість тканини порівняно з паренхімою печінки. Висновок: кандидозний езофагіт ІІ ст. Підслизова пухлина ДПК з виразкуванням (GIST?), еритематозна гастродуоденопатія, FOREST III.
Після виконання ЕУС було встановлено, що дане утворення видалити ендоскопічним шляхом неможливо, тому пацієнтка направлена на консультацію до хірурга.
Клінічний випадок 2 — дослідження ЕУС в умовах ДУ «Інститут гастроентерології НАМН України». Хвора М., 71 рік.
04.06.2021 пацієнтка М. звернулась на консультацію до поліклінічного відділення ДУ «Інститут гастроентерології НАМН України» з попереднім діагнозом: підслизове утворення шлунка, хронічний гастрит з повною кишковою метаплазією антрального відділу шлунка, гастроезофагеальна рефлюксна хвороба з неерозивним езофагітом, кісти печінки (ДПК). Супутній діагноз: гіпоплазія щитоподібної залози.
Скарги на біль в епігастральній ділянці та правому підребер’ї, слабкість, схильність до запорів. Анамнез життя: вважає себе хворою з 2010 року, коли вперше був встановлений діагноз «хронічний гастрит». В 2018 році проведена лапароскопічна холецистектомія. В лютому стан погіршився, лікувалась за місцем проживання у стаціонарі. Об’єктивний стан: без особливостей.
За місцем проживання в амбулаторних умовах було виконане ендоскопічне дослідження (з амбулаторної карти): у верхній третині шлунка по задній стінці виявлено підслизове утворення до 2,0 × 3,0 см, слизова над новоутворенням не змінена.
УЗД органів черевної порожнини від 07.06.2021 року: печінка — ліва частка 47 мм, права частка 125 мм, ехогенність помірно підвищена, неоднорідна за рахунок гіперехогенного утворення в 2 сегменті, правильної форми, з чіткими контурами, розташована підкапсульно та щільно прилягає до шлунка, неоднорідної структури, зі скудною васкуляризацією по периферії, розмірами 33 × 21 мм, в 5 сегменті візуалізується анехогенне новоутворення неправильної форми 20 × 14 мм, аваскулярне, однорідне. Висновок: УЗ-ознаки вогнищевих новоутворень печінки: кавернозної гемангіоми лівої частки печінки та кісти правої частки печінки, дифузних змін паренхіми печінки.
Фіброгастродуоденоскопія виконана 07.06.2021 року з амбулаторної картки — хронічний атрофічний гастрит з вогнищевою атрофією слизової шлунка, підслизове новоутворення в/3 тіла шлунка.
Було рекомендовано виконати ЕУС, що і було призначено на 07.06.21 року.
Відеогастродуоденоскопія з ЕУС шлунка від 08.06.2021 р.: система SonoScape UR-500. Стравохід, ДПК — без особливостей. У шлунку помірна кількість прозорої рідини з домішками жовчі. Слизова оболонка шлунка складчаста, еластична, в верхніх відділах рожева, в антральному відділі слизова дрібноплямиста. У в/3 тіла шлунка по задній стінці визначається випинання до 3 см, слизова над ним не змінена. При виконанні ЕУС у цій зоні визначаються нормальні шари стінки шлунка, до неї тісно прилягають 2 сегменти печінки, в яких локалізується гіперехогенне новоутворення з чіткими контурами розміром 3 × 2 см. Висновок: гастропатія (антральний відділ), гемангіома 2 сегмента печінки (рис. 7).
Так, у пацієнтки після дообстеження, а саме виконання відеогастродуоденоскопії з ЕУС, було виключене підслизове новоутворення шлунка. В подальшому хвора направлена на консультацію до хірурга.
Таким чином, підслизові новоутворення шлунка та дванадцятипалої кишки перебігають безсимптомно та часто являють собою випадкову знахідку при проведенні ендоскопії. Зазвичай такі підслизові новоутворення на гастродуоденоскопії проявляються у вигляді випуклостей у шлунково-кишковому тракті зі звичайною слизовою оболонкою. Ендоскопічна ультрасонографія, що поєднує можливості двох досліджень (ендоскопічного й ультразвукового), значно підвищила інформативність ендоскопічного дослідження підслизових новоутворень шлунка та дванадцятипалої кишки, оскільки з’явилась можливість визначення поширеності патологічного процесу та ступеня внутрішньостінкової інвазії, а також диференціальної діагностики підслизових новоутворень з патологічними процесами в прилеглих до стравоходу, шлунка та дванадцятипалої кишки органах.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконується відповідно до плану наукових досліджень відділу хірургії органів травлення Державної установи «Інститут гастроентерології НАМН України». Усі пацієнти підписали інформовану згоду на участь у цьому дослідженні.
Внесок авторів: Степанов Ю.М. — концепція та дизайн дослідження, редагування тексту; Пролом Н.В., Коненко І.С. — відбір пацієнтів, обробка клінічних даних, написання статті; Тарабаров С.О., Дементій Н.П., Адамська І.М. — виконання досліджень.
Отримано/Received 01.11.2021
Рецензовано/Revised 18.11.2021
Прийнято до друку/Accepted 25.11.2021

/68.jpg)
/69.jpg)
/70.jpg)
/71.jpg)
/72.jpg)
/73.jpg)