Международный эндокринологический журнал Том 18, №1, 2022
Вернуться к номеру
Аналіз значущості деяких прогностичних факторів метастазування медулярного раку щитоподібної залози
Авторы: Паламарчук В.О. (1), Смоляр В.А. (1), Товкай О.А. (1), Куц В.В. (1, 2)
(1) — Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
(2) — ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
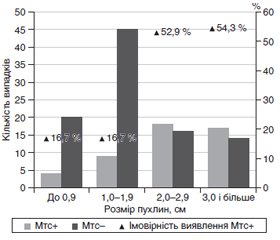
Актуальність. Актуальність дослідження зумовлена необхідністю пошуку ефективних методів діагностики та лікування медулярного раку щитоподібної залози. Базальний кальцитонін є біомаркером, що визначає як факт наявності даного захворювання, так і рівень метастазування. Однак надпорогові рівні кальцитоніну мають невисоку прогностичну цінність позитивного результату. Метою дослідження було проаналізувати значущість додаткових факторів (окрім кальцитоніну) у прогнозуванні метастазування медулярного раку щитоподібної залози: віку, статі, фокальності пухлини, розміру (сумарного розміру) пухлини. Матеріали та методи. Ретроспективний моноцентровий аналіз був проведений за результатами лікування 194 пацієнтів з медулярним раком щитоподібної залози. У дослідженні брали участь 143 пацієнти з первинними формами даного захворювання. Необхідні характеристики пухлини оцінювалися в післяопераційному періоді на основі патоморфологічного дослідження. Результати. Зв’язку між віком та метастазуванням виявлено не було, але показана наявність зв’язку середньої сили між статтю та метастазуванням. При цьому співвідношення шансів виявлення метастазів у пацієнтів чоловічої статі оцінюється як 3 : 1. Доведено, що за наявності мультифокальності пухлини ступінь виявлення метастазів зростає. При співвідношенні шансів, що дорівнює 2,368, фактор мультифокальності виявляє слабкий, але статистично значущий зв’язок з наявністю метастазів. Загальний розмір пухлини має зв’язок з метастазуванням. Більше половини (54,5 %) випадків спостерігаються у діапазоні розмірів пухлин, менших від обраного порогу відсікання, причому кількість випадків метастазування становить 16,7 %. Натомість доля випадків перевищення порогу відсікання (Cut-off = 1,9 см; AUC = 0,703, Se = 0,745, Sp = 0,680) становить 45,5 %, а метастазування спостерігається у 53,8 % хворих з цього діапазону. Висновки. Зв’язку віку та метастазування не виявлено. Чоловіча стать є фактором ризику метастазування. Мультифокальність є фактором ризику метастазування зі слабким зв’язком. Загальний розмір пухлини має зв’язок з метастазуванням середньої сили.
Background. The urgency of the study is due to the need to find effective methods for the diagnosis and treatment of medullary thyroid cancer. Basal calcitonin is a biomarker that determines both the presence of this disease and the level of metastasis. However, above-threshold calcitonin levels have a low prognostic value of the positive result. The study was aimed to analyze the importance of additional factors (besides calcitonin) in predicting the medullary thyroid cancer metastasis: age, sex, tumor focus, tumor volume (total volume). Materials and methods. A retrospective monocenter analysis was performed using the records of 194 patients treated for medullary thyroid cancer. The study involved 143 patients with primary forms of the disease. The required characteristics of the tumor were assessed in the postoperative period based on the pathomorphological examination. Results. The association between age and metastasis was not found, but a moderate relationship between sex and metastasis has been shown. The ratio of the chances of metastases detected in male patients is estimated at 3 : 1. It is proved that in the presence of tumor multifocality, the likelihood of metastasis detection increases. With an odds ratio of 2.368, the multifocal factor shows a weak but statistically significant strong association with the presence of metastases. Total tumor size is associated with metastasis. More than half (54.5 %) of cases are in the range of tumor sizes smaller than the selected cut-off threshold, with 16.7% metastasizing. On the other hand, the share of cases of exceeding the cut-off threshold (Cut-off = 1.9 cm; AUC = 0.703, Se = 0.745, Sp = 0.680) is 45.5 %, and metastasis is observed in 53.8 % of patients in this range. Conclusions. No association was found between age and metastasis. Male gender is a risk factor for metastasis. Multifocality is a risk factor for metastasis with a weak connection. The total size of the tumor is associated with metastasis with medium strength.
медулярний рак щитоподібної залози; кальцитонін; предиктор метастазування; рецидив
medullary thyroid cancer; calcitonin; predictor of metastasis; relapse
Вступ
Матеріали та методи
Результати
/12.jpg)
/14_2.jpg)
Обговорення
Висновки
- Torre L.A., Siegel R.L., Ward E.M., Jemal A. Global Cancer Incidence and Mortality Rates and Trends — An Update. Cancer Epidemiol. Biomarkers Prev. 2016. Vol. 25 (1). P. 16-27. doi: 10.1158/1055-9965.EPI-15-0578.
- Ceolin L., Duval M.A.D.S., Benini A.F., Ferreira C.V., Maia A.L. Medullary thyroid carcinoma beyond surgery: advances, challenges, and perspectives. Endocr. Relat. Cancer. 2019. Vol. 26 (9). P. 499-518. doi: 10.1530/ERC-18-0574.
- Turkdogan S., Forest V.I., Hier M.P. et al. Carcinoembryonic antigen levels correlated with advanced disease in medullary thyroid cancer. J. of Otolaryngol. Head & Neck Surg. 2018. Vol. 47. № 55. https://doi.org/10.1186/s40463-018-0303-x.
- Wells S.A. Jr., Asa S.L., Dralle H., Elisei R., Evans D.B., Gagel R.F., Lee N., Machens A., Moley J.F., Pacini F., et al. Revised American Thyroid Association guidelines for the management of me–dullary thyroid carcinoma. Thyroid. 2015. Vol. 25. P. 567-610. doi: 10.1089/thy.2014.0335.
- Oltmann S.C., Schneider D.F., Chen H., Sippel R.S. All thyroid ultrasound evaluations are not equal: Sonographers specialized in thyroid cancer correctly label clinical N0 disease in well differentia–ted thyroid cancer. Ann. Surg. Oncol. 2015. Vol. 22. Р. 422-428. doi: 10.1245/s10434-014-4089-4.
- Kumbhar S.S., O’Malley R.B., Robinson T.J., Maximin S., Lalwani N., Byrd D.R., Wang C.L. Why Thyroid Surgeons Are Frustrated with Radiologists: Lessons Learned from Pre- and Postoperative US. Radiographics. 2016. Vol. 36. Р. 2141-2153. doi: 10.1148/rg.2016150250.
- Yip D.T., Hassan M., Pazaitou-Panayiotou K., Ruan D.T., Gawande A.A., Gaz R.D., et al. Preoperative basal calcitonin and tumor stage correlate with postoperative calcitonin normalization in patients undergoing initial surgical management of medullary thyroid carcinoma. Surgery. 2011. Vol. 150. P. 1168-1177. doi: 10.1016/j.surg.2011.09.043.
- Haddad R.I., Nasr C., Bischoff L., Busaidy N.L., Byrd D., Callender G., Dickson P., et al. NCCN Guidelines Insights: Thyroid Carcinoma, Version 2.2018. J. Natl. Compr. Cancer Netw. 2018. Vol. 16. Р. 1429-14. doi: 10.6004/jnccn.2018.0089.
- Patel K.N., Yip L., Lubitz C.C., Grubbs E.G., Miller B.S., Shen W., Angelos P., Chen H., Doherty G.M., Fahey T.J. 3rd, et al. The American Association of Endocrine Surgeons Guidelines for the Defi–nitive Surgical Management of Thyroid Disease in Adults. Ann. Surg. 2020. Vol. 271. P. 21-93. doi: 10.1097/SLA.0000000000003580.
- Park H., Park S.Y., Park J., Choe J.H., Chung M.K., Woo S.Y., Choi J.Y., et al. Prognostic Value of Preoperative Serum Calcitonin Levels for Predicting the Recurrence of Medullary Thyroid Carcinoma. Front Endocrinol. (Lausanne). 2021. Vol. 12. 749973. doi: 10.3389/fendo.2021.749973. PMID: 34675884; PMCID: PMC8523916.
- Palamarchuk V., Smolyar V., Tovkay O., Nechay O., Kuts V., Sichinava R., Mazur O. The role of calcitonin in the preope–rative stage as the predictor of medullary thyroid cancer metastasis. The Ukrainian Scientific Medical Youth Journal (USMYJ). 2021. [Epub ahead of print].
- Kandil E., Gilson M.M., Alabbas H.H., Tufaro A.P., Dac–kiw A., Tufano R.P. Survival implications of cervical lymphadenectomy in patients with medullary thyroid cancer. Ann. Surg. Oncol. 2011. Vol. 18. Р. 1028-1034. doi: 10.1245/s10434-010-1363-y.
- Moley J.F., DeBenedetti M.K. Patterns of nodal metastases in palpable medullary thyroid carcinoma: Recommendations for extent of node dissection. Ann. Surg. 1999. Vol. 229. Р. 880-888. doi: 10.1097/00000658-199906000-00016.
- Scollo C., Baudin E., Travagli J.P., Caillou B., Bellon N., Leboulleux S., Schlumberger M. Rationale for central and bilateral lymph node dissection in sporadic and hereditary medullary thyroid cancer. J. Clin. Endocrinol. Metab. 2003. Vol. 88. P. 2070-2075. doi: 10.1210/jc.2002-021713.
- Perros P., Boelaert K., Colley S., Evans C., Evans R.M., Gerrard Ba G., et al. Guidelines for the management of thyroid cancer. Clin. Endocrinol. (Oxf.) 2014. Vol. 81. Suppl. 1. P. 1-122. doi: 10.1111/cen.12515.
- Wang T.S., Cheung K., Farrokhyar F., Roman S.A., Sosa J.A. A meta-analysis of the effect of prophylactic central compartment neck dissection on locoregional recurrence rates in patients with papillary thyroid cancer. Ann. Surg. Oncol. 2013. Vol. 20. P. 3477-3483. doi: 10.1245/s10434-013-3125-0.
- Chen L., Sun W., Qian K., Guo K., Sun T., Wu Y.I., Wang Z. High Ratio of Early Postoperative Calcitonin to Preoperative Calcitonin Could be a Novel Indicator of Poor Prognosis in Patients with Biochemical Incomplete Responses in Sporadic Medullary Thyroid Cancer. Endocr. Pract. 2020. Vol. 26. № 7. Р. 738-747. doi: 10.4158/EP-2019-0404. Epub 2020 Nov 24.
- Tovkay O.A., Palamarchuk V.О., Lishchinsky P.О., Kuts V.V., Stotska L.V., Chirkov Y.E. Possibilities of ultrasound –examination to detect metastases of papillary thyroid cancer in the central lymph nodes of the neck. Clinical Endocrinology and Endocrine Surgery. 2020. Vol. 3 (71). P. 7-15. doi: 10.30978/CEES-2020-3-7 (in Ukrainian).
- Henry N.L., Hayes D.F. Cancer Biomarkers. Mol. Oncol. 2012. Vol. 6. Р. 140-146. doi: 10.1016/j.molonc.2012.01.010.
- Yotsukura S., Mamitsuka H. Evaluation of Serum-Based Cancer Biomarkers: A Brief Review From a Clinical and Computational Viewpoint. Crit. Rev. Oncol. Hematol. 2015. Vol. 93. P. 103-115. doi: 10.1016/j.critrevonc.2014.10.002.
- Machens A., Schneyer U., Holzhausen H.J., Dralle H. Prospects of Remission in Medullary Thyroid Carcinoma According to Basal Calcitonin Level. J. Clin. Endocrinol. Metab. 2005. Vol. 90. Р. 2029-2034. doi: 10.1210/jc.2004-1836.
- Machens A., Dralle H. Biomarker-based risk stratification for previously untreated medullary thyroid cancer. J. Clin. Endocrinol. Metab. 2010. Vol. 95. Р. 2655-2663. doi: 10.1210/jc.2009-2368.
- Park H., Park J., Choi M.S., Kim J., Kim H., Shin J.H., et al. Preoperative Serum Calcitonin and Its Correlation With Extent of Lymph Node Metastasis in Medullary Thyroid Carcinoma. Cancers (Basel). 2020. Vol. 12 (10). 2894. doi: 10.3390/cancers12102894.
- Gimm O. Extent of Surgery in Clinically Evident But Operable MTC — When is Central and/or Lateral Lympadenectomy Indicated? Thyroid Res. 2013. Vol. 6. Suppl. 1. Р. 3. doi: 10.1186/1756-6614-6-S1-S3.
- Cohen R., Campos J.M., Salaun C., Heshmati H.M., Kraimps J.L., Proye C., Sarfati E., Henry J.F., Niccoli-Sire P., Modig–liani E. Preoperative calcitonin levels are predictive of tumor size and postoperative calcitonin normalization in medullary thyroid carcinoma. Groupe d’Etudes des Tumeurs a Calcitonine (GETC). J. Clin. Endocrinol. Metab. 2000. Vol. 85. Р. 919-922. doi: 10.1210/jcem.85.2.6556.
- Machens A., Lorenz K., Dralle H. Prediction of Biochemical Cure in Patients With Medullary Thyroid Cancer. Br. J. Surg. 2020. Vol. 107. Р. 695-704. doi: 10.1002/bjs.11444.
- Yen T.W., Shapiro S.E., Gagel R.F., Sherman S.I., Lee J.E., Evans D.B. Medullary Thyroid Carcinoma: Results of a Standardized Surgical Approach in a Contemporary Series of 80 Consecutive Patients. Surgery. 2003. Vol. 134. P. 890-899. doi: 10.1016/s0039-6060(03)00408-2.
- Jung K.Y., Kim S.M., Yoo W.S., Kim B.W., Lee Y.S., Kim K.W., et al. Postoperative Biochemical Remission of Serum Calcitonin is the Best Predictive Factor for Recurrence-Free Survival of Medullary Thyroid Cancer: A Large-Scale Retrospective Analysis Over 30 Years. Clin. Endocrinol. (Oxf.). 2016. Vol. 84. Р. 587-597. doi: 10.1111/cen.12852.
- Lindsey S.C., Ganly I., Palmer F., Tuttle R.M. Response to Initial Therapy Predicts Clinical Outcomes in Medullary Thyroid Cancer. Thyroid. 2015. Vol. 25. Р. 242-249. doi: 10.1089/thy.2014.0277.
- Kahneman D. Thinking, Fast and Slow: Macmillan. New York: Farrar, Straus and Giroux. 2013. Р. 199-208. doi.org/10.1080/13669877.2013.766389.
- Haugen B.R., Alexander E.K., Bible K.C., Doherty G.M., Mandel S.J., Nikiforov Y.E., et al. 2015 American Thyroid Association Management Guidelines for Adult Patients With Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016. Vol. 26. Р. 1-133. doi: 10.1089/thy.2015.0020.
- Ray P., Le Manach Y., Riou B., Houle T.T. Statistical evaluation of a biomarker. Anesthesiology. 2010. Vol. 112. P. 1023-1040. doi: 10.1097/ALN.0b013e3181d47604.

/12_2.jpg)
/13.jpg)
/13_2.jpg)
/13_3.jpg)
/14.jpg)